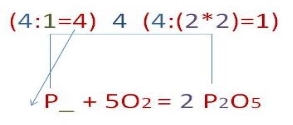ХІМІЧНІ РІНЯННЯ - конспект уроку
Дата ___/____/____ Клас _________ Прізвище вчителя __________________________
Урок № 21
Хімічні рівняння
Мета уроку: сформувати поняття про хімічні рівняння; закріпити знання учнів про закон збереження маси речовини, навчити пояснювати його, підтверджуючи теоретичні відомості обчисленнями; формувати вміння складати рівняння хімічних реакцій та розставляти в них коефіцієнти.
Очікувані результати: учні мають характеризувати хімічне рівняння як умовний запис хімічної реакції; уміти складати й читати рівняння хімічних реакцій, розставляти коефіцієнти на основі закону збереження мас.
Базові поняття й терміни: хімічна реакція, хімічне рівняння, закон збереження маси, коефіцієнт, реагент, продукт реакції.
Обладнання: ___________________________________________________________
Тип уроку: комбінований.
1. Організаційний етап
1.1. Привітання.
1.2. Перевірка присутності учнів: кількість за списком _________,
кількість присутніх на уроці ___________, відсутніх ___________.
1.3. Перевірка готовності учнів до уроку.
2. Етап перевірки домашнього завдання
2.1. Перевірка наявності в учнів виконаних письмових робіт. Обговорення питань, які виявилися найбільш складними.
2.2. Фронтальне опитування.
- Коли й хто відкрив закон збереження маси?
- Сформулюйте закон збереження маси речовини.
- На основі атомно-молекулярного вчення поясніть, чому загальна маса речовин до й після реакції не змінюється.
- Наведіть приклади дослідів, які підтверджують закон збереження маси.
- Як пояснити те, що маса вугілля й золи, які утворюються в результаті горіння дров, менша за масу цих дров?
- Яке значення має закон збереження маси речовини?
2.3. Бліцконтроль.
І варіант
Нагріванням меркурій(ІІ) оксиду було добуто ртуть масою 20,1 г і кисень масою 1,6 г. Скільки меркурій(ІІ) оксиду розклалося під час нагрівання? (21,7 г.)
ІІ варіант
Під час спалювання 12,4 г фосфору витратився кисень масою 16 г і утворився фосфор(V) оксид. Яка маса фосфор(V) оксиду утворилася? (28,4 г.)
3. Актуалізація опорних знань і мотивація навчальної діяльності
3.1. Інтерактивна гра «Бумеранг».
Один учень називає хімічний елемент, другий визначає його валентність. Якщо валентність названо неправильно, виправити помилку має той учень, який називав елемент.
3.2. Практичне завдання.
Запишіть хімічні формули речовин, які складаються з:
а) Феруму(ІІ) та Сульфуру(ІІ); б) Натрію та Оксигену; в) Алюмінію та Оксигену. (FeS; Na2O; Al2O3.)
3.3. Бесіда.
1. Яким є алгоритм складання формул за валентністю?
2. Що називають хімічним рівнянням?
3. Що вам відомо про хімічні рівняння?
3.4. Повідомлення теми уроку.
3.5. Формулювання разом з учнями мети й завдань уроку.
4. Етап засвоєння нових знань
План пояснення нового матеріалу
- Хімічний зміст реакції. Схема хімічної реакції. (Коментар учителя.)
- Реагенти (вихідні речовини) — це речовини, які вступають у хімічні реакції.
- Продукти реакції (кінцеві речовини) — це речовини, що утворилися в результаті реакції. Хімічні реакції записують за допомогою хімічних формул у вигляді схеми.
-
 Реагенти Продукти реакції
Реагенти Продукти реакції
- С + O2 → CO2
- Цей схематичний запис називається схемою хімічної реакції.
- Схема реакції є лише її якісною характеристикою. Кількісну характеристику реакції показує закон збереження маси речовин. Згідно з цим законом кількість атомів різних елементів під час хімічних реакцій не змінюється. Якщо це відображено в схемі хімічної реакції, то вона перетворюється на хімічне рівняння.
- Рівняння хімічних реакцій. (Розповідь учителя, алгоритм складання рівняння хімічної реакції.)
Ми звикли вважати, що рівняння — це математичний приклад, у якому є невідоме, і це невідоме потрібно обчислити. А ось у хімічному рівнянні зазвичай нічого невідомого не буває: у ньому просто записано формулами, які речовини вступають у реакцію і які утворюються по її завершенні. Найпростіше рівняння реакції ми з вами вже записували:
Fe + S → FeS.
Рівняння реакції потрібно вміти не тільки записати, а й прочитати. Це рівняння в найпростішому вигляді читають так: молекула заліза взаємодіє з молекулою сірки, виходить одна молекула ферум(ІІ) сульфіду.
Найважче в написанні рівняння реакції — скласти формули продуктів реакції, тобто тих речовин, що утворюються. Тут правило тільки одне: формули молекул будуються чітко за валентностями складових елементів. Крім того, під час складання рівнянь реакцій потрібно пам’ятати про закон збереження маси речовин: усі атоми молекул вихідних речовин мають увійти до складу молекул продуктів реакції. Жоден атом не повинен зникнути або несподівано з’явитися. Тому іноді, коли записано всі формули в рівнянні реакції, доводиться порівнювати число атомів в кожній частині рівняння — розставляти коефіцієнти. Наведемо приклад:
С + O2 → CO2.
У ньому в кожного елемента однакове число атомів і в правій, і в лівій частині рівняння. Рівняння готове:
Cu + O2 → CuO.
А в цьому рівнянні атомів Оксигену в лівій частині більше, ніж у правій. Потрібно, щоб вийшло стільки молекул купрум оксиду (CuO), щоб у них було стільки ж атомів Оксигену, тобто 2. Тому перед формулою СuО ставимо коефіцієнт 2:
Cu + O2 → 2CuO.
Тепер неоднаковим є число атомів Купруму, тож у лівій частині рівняння перед знаком міді ставимо коефіцієнт 2:
2Cu + O2 → 2CuO.
Порахуйте, чи порівну атомів кожного елемента в лівій і правій частинах рівняння. Якщо так, то рівняння реакції складено правильно. Наведемо ще один приклад:
Al + O2 → Al2O3.
У ньому кількість атомів кожного елемента також різна до й після реакції. Вирівнювати починаємо з газу, тобто з молекул кисню:
1) Зліва 2 атоми Оксигену, а справа — 3. Шукаємо найменше спільне кратне для цих чисел. Це найменше число, яке ділиться і на 2, і на 3, тобто 6. Перед формулами кисню та алюміній оксиду (Al2O3) ставимо такі коефіцієнти, щоб загальна кількість атомів Оксигену в цих молекулах становила 6:
Al + 3O2 → 2Al2O3.
2) Позначаємо число атомів Алюмінію: зліва — 1 атом, а справа у двох молекулах — по 2, тобто загалом 4. Отже, перед знаком алюмінію в лівій частині рівняння ставимо коефіцієнт 4:
4Al + 3O2 → 2Al2O3.
3) Ще раз лічимо всі атоми до реакції й після неї: по 4 атоми Алюмінію й по 6 атомів Оксигену. Усе гаразд, рівняння реакції складено правильно. А якщо реакція відбувається за нагрівання, то над стрілкою додатково ставиться знак t.
Отже, рівняння хімічної реакції — це запис перебігу хімічної реакції за допомогою хімічних формул і коефіцієнтів.
Учні під керівництвом учителя складають алгоритм запису рівняння хімічної реакції.
Алгоритм складання рівняння хімічної реакції
|
Складемо рівняння хімічної реакції взаємодії фосфору й кисню |
|
1. У лівій частині рівняння запишіть хімічні формули реагентів (речовин, що вступають у реакцію). NB! Молекули більшості простих газоподібних речовин є двохатомними (H2, N2, O2, F2, Cl2, Br2, I2). Між реагентами поставте знак «+», а потім стрілку: P + O2 → |
|
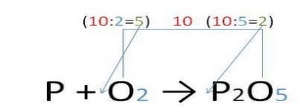
2. У правій частині (після стрілки) запишіть хімічну формулу продукту (речовини, що утворюється в результаті взаємодії): P + O2 → P2O5. NB! Хімічні формули необхідно складати, використовуючи валентності атомів хімічних елементів |
|
3. Відповідно до закону збереження маси речовин число атомів до й після реакції має бути однаковим. Це досягається шляхом розстановки коефіцієнтів перед хімічними формулами реагентів і продуктів хімічної реакції: • спочатку зрівняйте число атомів, яких у речовинах-реагентах (продуктах) міститься найбільше (у даному випадку це атоми Оксигену); • знайдіть найменше спільне кратне для чисел атомів Оксигену в лівій і правій частинах рівняння (найменше кратне для атомів Оксигену —10);
P + 5O2 → 2P2O5;
• отримайте рівняння хімічної реакції в завершеному вигляді, тож стрілку замініть на знак рівності (закон збереження маси речовини виконується): 4P + 5O2 = 2P2O5 |
Правила добору коефіцієнтів
1. Якщо число атомів елемента в одній частині схеми реакції парне, а в другій — ні, то перед формулою з непарним числом атомів слід поставити коефіцієнт 2, а потім зрівнювати число всіх атомів.
2. Розстановку коефіцієнтів слід починати з найбільш складної речовини. Робити це потрібно в такій послідовності: спочатку зрівняти число атомів металів, потім — кислотних залишків (атомів неметалів), потім — атомів Гідрогену, зрештою —
атомів Оксигену.
3. Якщо число атомів Оксигену в лівій і правій частинах рівняння однакове, коефіцієнти визначено правильно.
4. Після цього стрілку між частинами рівняння можна замінити знаком рівності.
5. Коефіцієнти в рівнянні хімічної реакції не повинні мати спільних дільників.
5. Узагальнення й систематизація знань
5.1. Дидактична гра «Хімічна естафета».
Учитель ділить клас на три групи (за кількістю рядів). Групи отримують аркуші із завданнями (своєрідну естафетну паличку). Кожен учень має якнайшвидше закінчити рівняння реакції й передати естафетну паличку наступному учаснику.
Перемагає команда, яка швидше за інші правильно закінчить рівняння реакцій.
2P+ 3H2 → 2PH3;
2Mg + O2 → 2MgO;
![]() ;
;
N2 + 3H2 → 2NH3;
H2 + Cl2 → 2HCl;
4Al + 3O2 → 2Al2O3;
2Ca + O2 →2CaO;
S + O2 → SO2;
2H2 + O2 → 2H2O.
5.2. Завдання на закріплення матеріалу.
1. Вставте замість пропусків формули речовин і (якщо потрібно) коефіцієнти:
а) ![]() ;
;
б) 4P + 3O2 = 2P2O3;
в) 2Al + 3S = Al2S3;
г) 2Na + Cl2 = 2NaCl;
д) 3K + P = K3P;
е) C + 2S = CS2.
2. Використовуючи алгоритм складання рівнянь хімічних реакцій, запишіть рівняння реакції взаємодії між такими речовинами:
а) Na і O2; б) Na і Cl2; в) Al і S.
Відповідь: а) 4Na + O2 = 2Na2O; б) 2Na + Cl2 = 2NaCl; в) 2Al ++ 3S = Al2S3.
6. Домашнє завдання, інструктаж щодо його виконання
6.1. Завдання для всього класу.
Підручник _____________________________________________
Збірник завдань ________________________________________
6.2. Індивідуальне завдання.
7. Підбиття підсумків уроку
Учитель просить учнів закінчити речення:
— Найцікавішим на цьому уроці для мене було…
1


про публікацію авторської розробки
Додати розробку