Хімічні властивості амфотерних гідроксидів
Про матеріал
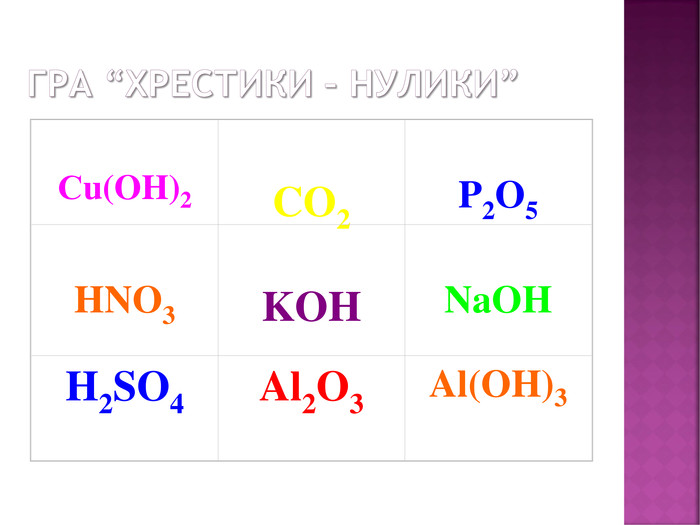
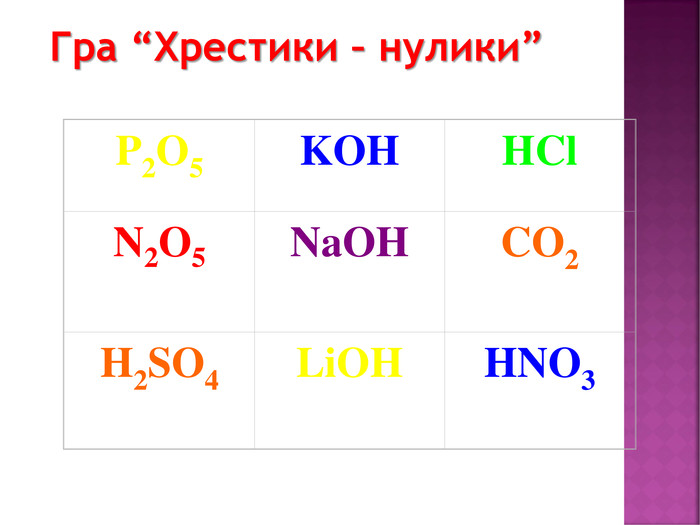
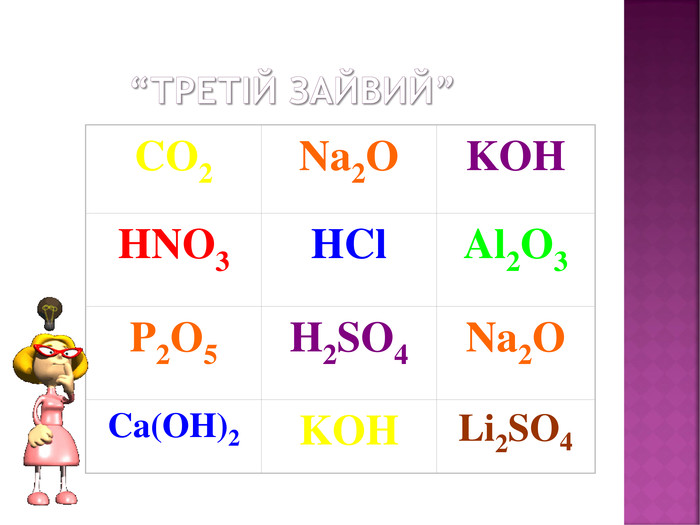
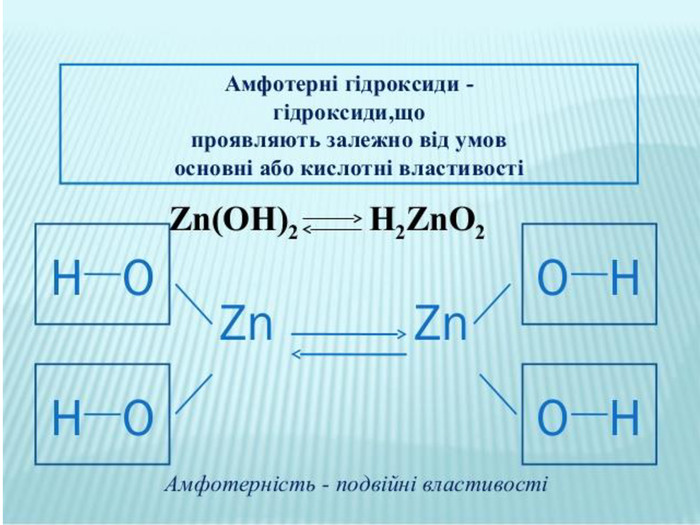
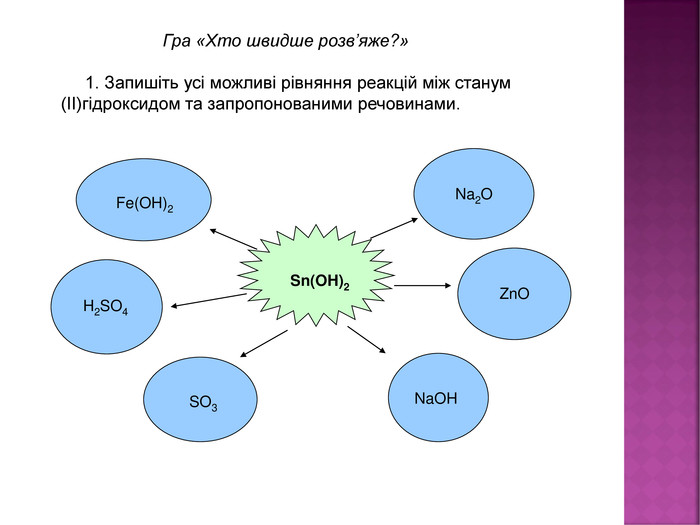
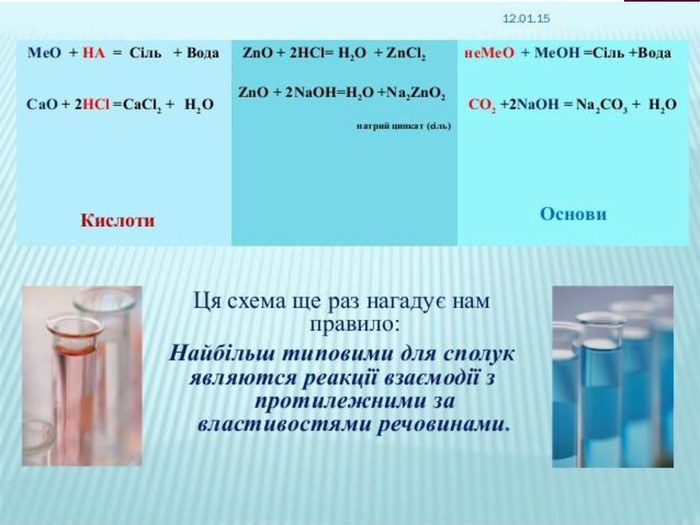
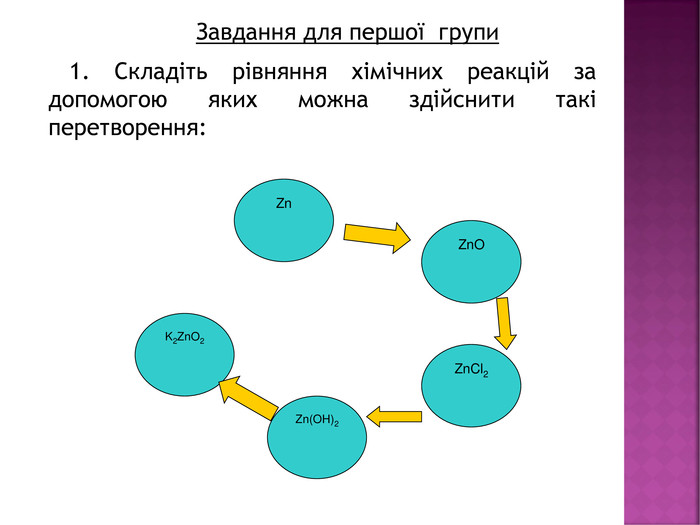
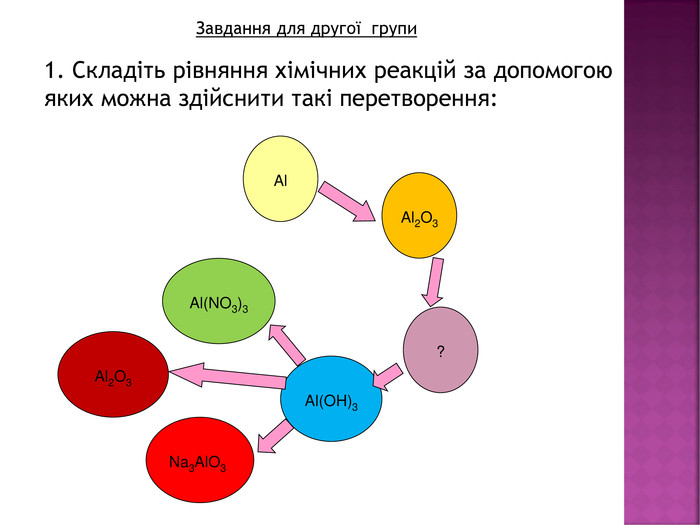
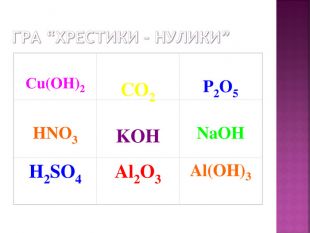
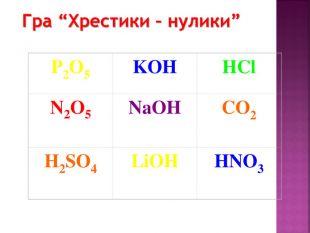
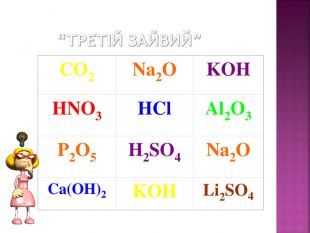
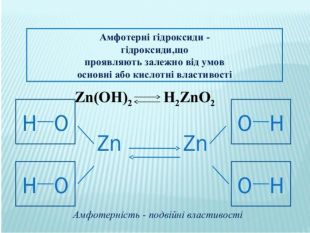
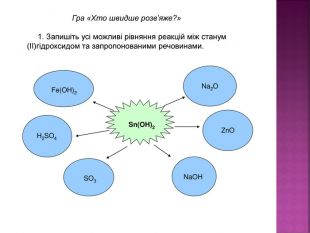
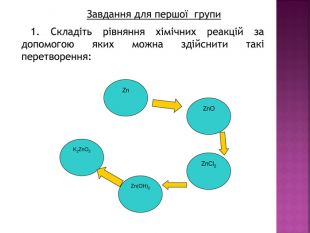
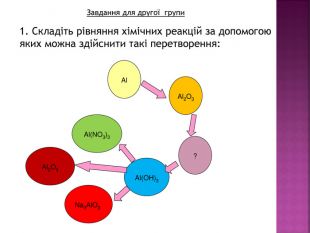
Презентація до уроку хімії в 8 класі на тему "Хімічні властивості амфотерних гідроксидів" містить опис основних закономірностей взаємодії амфотерних гідроксидів з іншими речовинами, способи утворення амфотерних гідроксидів, правила номенклатури солей, що утворюються внаслідок хімічних перетворень амфотерних гідроксидів, а також завдання для перевірки знань учнів на уроці Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку