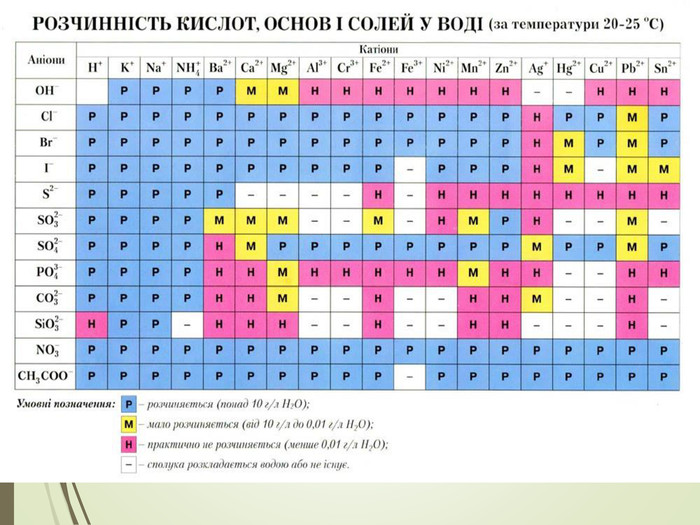
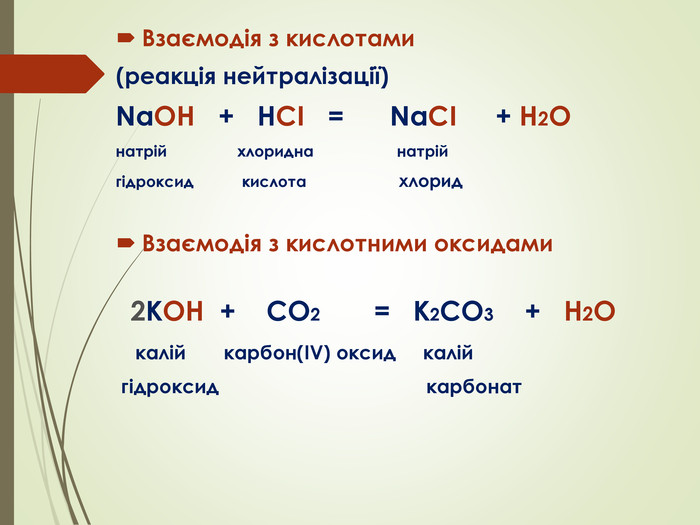
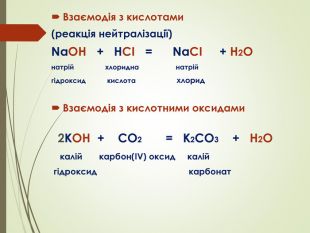
Презентація "Основи, будова та властивості, використання"
Про матеріал
Даний матеріал укладений відповідно до програми й можна використати у формі дистанційної роботи. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку