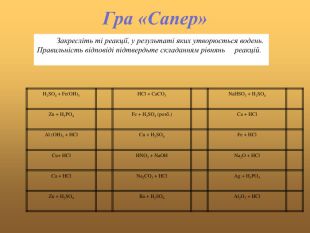
Хімічні властивості кислот.
Про матеріал
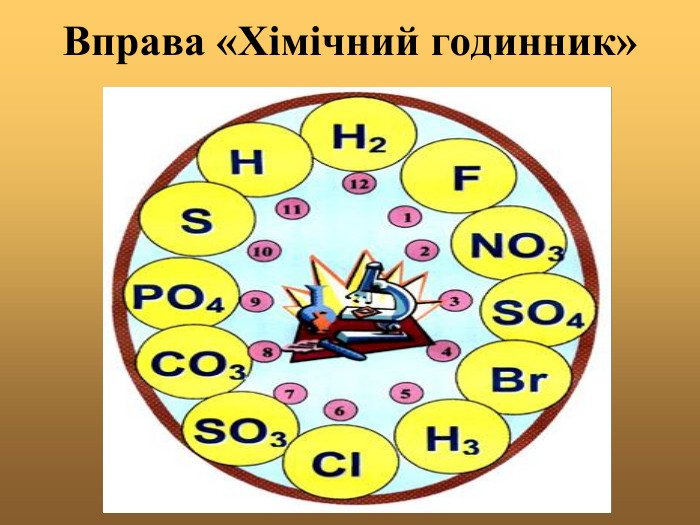
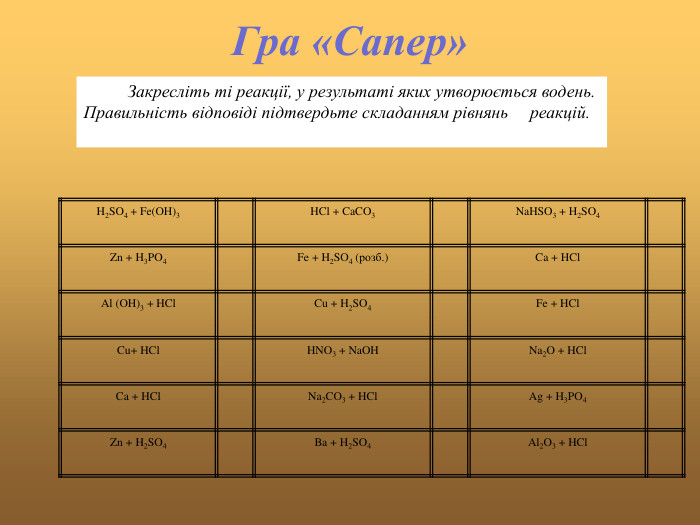
Хімічні властивості кислот.
Дія кислот на індикатори
Взаємодія кислот з металами Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку