Хімічні властивості кислот
Тема: Хімічні властивості кислот
Мета:
навчальна: вивчити: а) дію кислот на індикатори; б) взаємодію з металами; в) взаємодію з основними оксидами; г) реакцію заміщення; відпрацювати вміння складати хімічні рівняння;
розвиваюча: розвивати основні операції мислення та пізнавальні процеси, вміння використовувати набуті знання у нестандартних ситуаціях; формувати вміння спостерігати, аналізувати перебіг реакцій;
виховна: виховувати почуття відповідальності, творчий підхід до навчання, здатності до дослідництва та експериментування; виховувати здоров’язбережувальні компетенції.
Тип уроку: урок засвоєння нових знань.
Форма проведення уроку: урок-дослідження.
Обладнання і реактиви: роздаткові матеріали до уроку, ноутбук, набір для практичних дослідів.
Засоби наочності: правила техніки безпеки під час роботи з кислотами.
Форми роботи: словесні, тренувальні вправи, інтерактивні вправи, наочні, практичні.
Методи роботи: індивідуальна, фронтальна.
Очікувані результати:
Учень:
- знає і дотримується правил безпечного поводження з кислотами в лабораторії та побутових умовах;
- розрізняє реакції, що характеризують хімічні властивості кислот від інших класів речовин; реакції заміщення;
- пояснює хімічні властивості кислот, особливості взаємодії кислот з металами;
- характеризує дію кислот на індикатори, взаємодію з металами, основними оксидами;
- практично виконує лабораторні досліди і пояснює їх;
- складає рівняння реакцій заміщення та обміну;
- вміє використовувати ряд активності металів під час складання рівнянь реакцій взаємодії кислот з металами.
Девіз уроку: «Просто знати – ще не все, знання треба використовувати»
Й. Гете
Хід уроку
І Організаційний етап
Привітання учнів, перевірка готовності до уроку.
«Сьогодні у нас незвичайний урок, в нас присутні гості. Але як годиться в гарному домі, гості відпочивають, а господарі – працюють, то ж ми з вами почнемо працювати».
ІІ Актуалізація опорних знань та мотивація навчальної діяльності
Вправа «Хімічний годинник»
Скласти формули кислот та назвати їх.
Вправа «Хто зайвий?»
У кожному ряді знайдіть зайву речовину та вкажіть за яким принципом ви це визначили.
1) H2S, H2CO3, H3PO4, H2SO4, H2SO3
2) HNO3, HCl, HBr, HI, HF
3) H2CO3; KOH; H2SO3; H2SO4; HCl
4) H2CO3, H2SO4, HNO3, H2SO3, H2SiO3
5) BaSO4, H2SO3, H2CO3, H2S
6) H2SO4, HNO3 , KCl, H3PO4, HBr
ІІІ. Мотивація навчальної діяльності
Діти, ми вже з вами знаємо класифікацію кислот, а які ж їхні хімічні властивості? Це ми і з’ясуємо на нашому уроці. Тож запишіть тему уроку : «Хімічні властивості кислот, їх взаємодія з індикаторами, з металами, основними оксидами, основами, солями. Лабораторний дослід №3. Взаємодія хлоридної кислоти з металами» Дослідимо ці властивості кислот за допомогою експериментів.
IV. Вивчення нового матеріалу
Давайте згадаємо правила безпеки під час роботи з кислотами.
Учні називають правила техніки безпеки під час роботи з кислотами.
- Під час роботи з кислотами слід бути обережним. Особливо слід берегти очі. У разі потрапляння кислоти на руки необхідно негайно змити її великою кількістю води.
- Уважно читайте етикетку на банці з речовиною, яку берете для досліду.
- Не залишайте склянки з кислотами відкритими.
- Наливаючи рідини, посудину з реактивом беріть так, щоб етикетка була направлена в бік долоні, знімайте краплю з краю шийки, інакше рідина стікатиме по склу та псуватиме етикетку; може пошкодити шкіру рук.
- Посудину, з якої взяли реактив, відразу ж закрийте та поставте на місце.
6. Не виливайте залишки реактивів з пробірки назад у склянку, з якої він був узятий.
7. Якщо потрібно розбавити сульфатну кислоту, пам'ятайте правило:
„Спочатку-вода,
Потім-кислота.
Інакше - трапиться біда!”
1. Дія кислот на індикатори
Водні розчини кислот змінюють забарвлення індикаторів. Давайте пригадаємо :
- Які речовини називають індикаторами?
Індикатори — речовини, які змінюють колір залежно від середовища розчину.
- Назвіть основні види індикаторів.
У кислому середовищі лакмус, метилоранж і універсальний індикатор стають червоними.
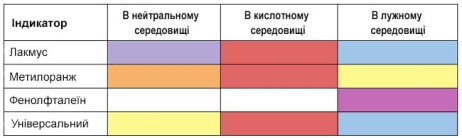
Демонстрація
Ваші спостереження запишіть в таблицю
|
Назва індикатору |
Колір що утворився |
|
|
|
|
|
|
|
|
|
|
|
|
2. Взаємодія з основними оксидами, основами, солями. Реакція нейтралізації.
- Взаємодія з основами. Перегляньте відео досліду за посиланням:
https://www.youtube.com/watch?v=HMrJTxRCe9w
А) Це реакція з виділенням газу.
Na2CO3 + 2HCl = 2NaCl + H2CO3
Б)Випадання осаду:
AgNO3 +HCl = AgCl↓ + HNO3
В)Утворення води:
2KOH + H2SO4 = K2SO4 + 2H2O
Висновок: Реакції кислот з солями відбуваються в трьох випадках:
- В результаті реакції утворюється газ;
- В результаті реакції випадає осад;
- Одним з продуктів реакції є вода.
Реакції між кислотами і основами називають реакціями нейтралізації.
-Взаємодія з основними оксидами. Демонстрація досліду взаємодії купрум(ІІ) оксиду із сульфатною кислотою.
https://www.youtube.com/watch?v=oBpHpu8IPhE
Насипаємо у пробірку купрум(ІІ) оксиду і додаємо краплями сульфатну кислоту. Що спостерігаємо? Запишемо рівняння реакції. Укажіть тип реакції.
CuO+H2SO4=CuSO4 +H2O
Спостерігаємо утворення зеленкувато-блакитного розчину. Реакція належить до реакцій обміну.
Фізкультхвилинка:
Якщо я піднімаю формулу кислоти – ви піднімаєте праву руку;
якщо я піднімаю формулу оксиду – ви піднімаєте ліву руку;
якщо я піднімаю формулу основи – ви торкаєтесь носа;
якщо я піднімаю формулу солі – ви торкаєтесь вуха.
Лабораторний дослід №3. Взаємодія хлоридної кислоти з металами.
Інструктивна картка
Тема: Взаємодія хлоридної кислоти з металами.
Мета: Виявити залежність між активністю металів та їх здатністю взаємодіяти з хлоридною кислотою.
Обладнання: штатив з пробірками.
Реактиви: розчин хлоридної кислоти, гранули цинку, стрічка магнію, мідна дротина.
ХІД РОБОТИ
1. У три пробірки всипаємо приблизно однакову кількість гранулу цинку, залізну дротину, мідну дротину. До кожної з них доливаємо хлоридної кислоти об'ємом по 1 мл. Спостерігаємо за перебігом хімічних реакцій.
2. Спостереження вносимо у таблицю. Пишемо рівняння реакцій, де це можливо, й робимо відповідні висновки.
|
Метал |
Спостереження |
Рівняння реакцій |
Висновки |
|
Zn |
|
|
|
|
Fe |
|
|
|
|
Cu |
|
|
|
Вчитель робить запис на дошці:
метал + кислота = сіль + водень
Більшість відомих вам кислот реагує з металами з виділенням водню і утворенням солей. Серед них – усі безоксигенові кислоти, сульфатна(у розбавленому розчині).
Під час таких реакцій атоми металічного елемента, які містяться в простій речовині, заміщують атоми іншого елемента (Гідрогену) у складній речовині. Такі реакції називають реакціями заміщення. Як видно із досліду, з кислотами взаємодіють не всі кислоти. Передбачити можливість реакції між металом і кислотою можна за допомогою ряду активності металів. Його склав у 1865 р. вітчизняний хімік
М.М. Бекетов на підставі вивчення реакцій металів із кислотами і солями. Формула неметалу водню поділяє ряд на дві частини. Метали, розміщені в його лівій частині, взаємодіють із названими кислотами(при цьому виділяється водень), а розміщені праворуч – не реагують з ними.
Висновок: Не всі метали реагують з розчинами кислот, а ті, що реагують, – реагують по-різному, це залежить від___________________________ металів.
IV Практичне застосування набутих знань
Конфуцій говорив, що добре мати природний дар, але тренувальні вправи дають більше. Тому перевіримо ваші практичні навички та вміння в ході гри «Сапер»
Гра «Сапер»
Закресліть ті реакції, у результаті яких утворюється водень.
Правильність відповіді підтвердьте складанням рівнянь реакцій.
|
H2SO4 + Fe(OH)3 |
|
HCl + CaCO3 |
|
NaHSO3 + H2SO4 |
|
|
Zn + H3PO4 |
|
Fe + H2SO4 (розб.) |
|
Ca + HCl |
|
|
Al (OH)3 + HCl |
|
Cu + H2SO4 |
|
Fe + HCl |
|
|
Cu+ HCl |
|
HNO3 + NaOH |
|
Na2O + HCl |
|
|
Ca + HCl |
|
Na2CO3 + HCl |
|
Ag + H3PO4 |
|
|
Zn + H2SO4 |
|
Ba + H2SO4 |
|
Al2O3 + HCl |
|
V Рефлексія
- Які властивость кислот ви вивчили?
- Чи можна цю властивість використати для визначення кислот?
- Який безпечний спосіб визначення кислот могли б запропонувати ви?
- Як називають речовини-визначники?
VI. Домашнє завдання
1. Опрацювати §
2. Виконати домашній експеримент: Дія на сік буряка чи червоноголової капусти лимонного соку, оцту, розчину харчової соди, мильного розчину.


про публікацію авторської розробки
Додати розробку
