Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Одержання етанової кислоти.
КОНСПЕКТ ВІДКРИТОГО УРОКУ ХІМІЇ (ДИСТАНЦІЙНО)
гейміфікована інтерактивна онлайн-конференція в середовищі Google Meet.
Тема уроку: Хімічні властивості насичених одноосновних карбонових кислот. Реакція естерифікації. Одержання етанової кислоти.
Мета уроку: навчитись характеризувати хімічні властивості насичених одноосновних карбонових кислот, способи одержання етанової кислоти; навчитись прогнозувати хімічні властивості насичених одноосновних карбонових кислот на основі знань про властивості характеристичної групи; навчитись виявляти наявність карбонових кислот; навчитись оцінювати безпечність органічних речовин і приймати обґрунтоване рішення щодо їхнього використання. Виховувати у здобувачів освіти самостійність, вміння виконувати поставлені перед ними завдання. Розвивати культуру хімічного запису, пам’ять.
Тип уроку: комбінований
Обладнання: ноутбуки або мобільні пристрої.
ХІД УРОКУ
- Організація групи. Під’єднання учасників до зустрічі
ІІ. Актуалізація життєвого досвіду і опорних знань
- Бліц опитування
- Які сполуки називаються мінеральними кислотами?
- Наведіть приклади відомих вам кислот, які ми використовуємо у побуті.
- За допомогою яких речовин можна виявити мінеральні кислоти?
- Які частинки, що входять до складу мінеральних кислот, змінюють забарвлення індикатора?
- Які хімічні властивості характерні для мінеральних кислот?
- Які сполуки називаються одноосновними насичені карбоновими кислотами?
- Що таке функціональна група? На що вона впливає?
- Яка функціональна група міститься у карбонових кислотах?
- Яку кислоту використовують для консервування та маринування?
- Яку кислоту містять молочнокислі продукти?
- Про утворення якої кислоти свідчать прогірклий смак і специфічний запах масла?
- Як по-іншому називається метанова кислота?
- Чому болять ікри ніг після тривалого бігу?
- Виконання інтерактивної вправи
https://learningapps.org/16889802

- Авторська навчальна гра «Карбонові кислоти»
https://wordwall.net/play/56488/488/493

- Проаналізуйте дані таблиці
«Фізичні властивості карбонових кислот» та охарактеризуйте фізичні властивості карбонових кислот:
Таблиця Фізичні властивості карбонових кислот
|
Формула
|
Назва |
Агрегатний стан |
t кип. 0С |
Розчинність у воді |
|
НСООН |
Мурашина |
рідина |
100,7 |
Необмежено |
|
СН3СООН |
Оцтова |
рідина |
117,7 |
Необмежено |
|
С2Н5СООН |
Пропіонова |
рідина |
140,8 |
Необмежено |
|
С3Н7СООН |
Масляна |
оліїста рідина |
163,3 |
Добре |
|
С4Н9СООН |
Валеріанова |
оліїста рідина |
186,4 |
Погано |
|
С5Н11СООН |
Капронова |
оліїста рідина |
205,3 |
Погано |
|
СІ5Н31СООН |
Пальмітинова |
тверда реч. |
390 |
Не розчиняється |
|
СІ7Н35СООН |
Стеаринова |
тверда реч. |
432 |
Не розчиняється |
Перші три члени гомологічного ряду кислот - мурашина, оцтова, пропіонова- безбарвні рідини з гострим подразливим запахом, які змішуються з водою в будь-яких співвідношеннях. Починаючи з масляної кислоти, йдуть оліїсті рідини з неприємним запахом (запах згірклого масла), вищі кислоти-тверді речовини, нерозчинні у воді.
Температури кипіння наведених кислот підвищуються.
Чим пояснюється добра розчинність у воді перших представників
гомологічного ряду карбонових кислот і погіршення розчинності карбонових кислот у зі збільшенням їх молекулярної маси?
За рахунок електростатичної взаємодії між атомами Гідрогену і Оксигену карбонових кислот і води між молекулами утворюються водневі зв’язки. Тому перші члени гомологічного ряду розчинні у воді. Зі зростанням молекулярної маси розчинність карбонових кислот погіршується за рахунок збільшення вуглеводневого радикала (гідрофобної частини молекули).
ІІІ. Повідомлення теми, мети, мотивація навчальної діяльності
Всім відомі фрукти: яблука, мандарини, апельсини, лимони.
Як ви думаєте, що їх об’єднує? Правильно, в них є фруктові кислоти з класу органічних карбонових кислот.
А ще в історії є відомий факт:
Римський історик Кай Пліній Старший (23-79 рр. до н.е.) переказав легенду про перлини Клеопатри. Єгипетська цариця влаштувала бенкет на честь римського полководця Марка Антонія. І треба сказати, що серед скарбів багатої Клеопатри найбільше славилися сережки з величезними грушоподібними перлинами, масу яких історики оцінювали в 40,2 г. Бажаючи вразити римського гостя, Клеопатра розчинила одну з перлин в кубку з вином і випила це вино за здоров’я Антонія. Яку реакцію здійснила Клеопатра? Відповідь на це питання ми зможемо знайти, коли розглянемо хімічні властивості насичених одноосновних карбонових кислот. Бажаю успіху!
ІV. Вивчення нового матеріалу
(паралельно проводиться робота з віртуальною дошкою Jamboard)
1.ЗАГАЛЬНІ ХІМІЧНІ ВЛАСТИВОСТІ ОДНООСНОВНИХ КАРБОНОВИХ КИСЛОТ
Дисоціація на йони. Дія етанової кислоти на індикатори
https://youtu.be/IPlgZL2esMM (дослід)

У водному розчині етанова кислота незначно дисоціює (є слабкою кислотою) і змінює забарвлення індикаторів:
CH3−COOH⇄CH3−COO−+H+
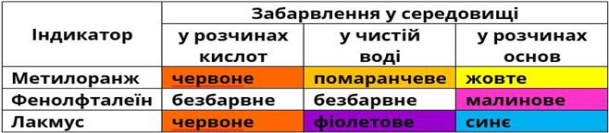
Розчини кислот змінили забарвлення індикаторів однаково: лакмус став червоний, метиловий оранжевий - рожево-червоний, універсальний індикаторний папір - червоний. Дія розчинів кислот на індикатори є універсальною, за допомогою індикаторів можна виявити наявність кислоти у розчині.
Які йони (назва та формула) у розчинах кислот дають таку зміну кольору індикаторів?
Йони Гідрогену надають розчинам кислот кислий смак, а також спільні з неорганічними кислотами хімічні властивості. У хімічних реакціях з багатьма речовинами утворюються солі карбонових кислот. Солі мурашиної кислоти – форміати (метаноати), солі оцтової кислоти – ацетати (етаноати):
Взаємодія з активними металами
https://youtu.be/KWiO0Nv4Mps (дослід)


Витісняють водень з кислот: Mg Al Zn
Не витісняють водень з кислот: Cu Ag Pt Au
2CH3COOH+Mg→(CH3COO)2Mg+H2↑
Взаємодія з основними оксидами
2CH3COOH+MgO→(CH3COO)2Mg+H2O
Взаємодія з лугами
https://youtu.be/-J7h4VD0iLs(дослід)

CH3COOH+NaOH→CH3COONa+H2O
Взаємодія з солями слабших кислот
https://www.youtube.com/watch?v=h39LqHkKiwo (дослід)

CH3COOH+Na2CO3→CH3COONa+H2O+CO2↑
Здобувачі освіти знаходять відповідь на запитання яку ж реакцію здійснила Клеопатра.
Перли – це перламутр, який складається з шестикутних пластинок арагоніту. Хімічна формула його CaCO3 (кальцій карбонат). Таку ж саму формулу має і яєчна шкаралупа CaCO3 (кальцій карбонат). А кальцій карбонат легко взаємодіє навіть з дуже слабкими кислотами (до яких відноситься етанова).
Цю реакцію, свого часу, і провела знаменита Клеопатра.
Формулювання висновків:
Розчинні у воді карбонові кислоти:
- мають характерний кислий смак
- забарвлюють універсальний індикаторний папірець у червоний колір
- взаємодіють з
- металами
- лугами
- основними і амфотерними оксидами
- солями слабших кислот
- органічні кислоти порівняно слабкі
- із збільшенням вуглеводневого радикала сила кислот знижується
2.СПЕЦИФІЧНІ ХІМІЧНІ ВЛАСТИВОСТІ ОДНООСНОВНИХ КАРБОНОВИХ КИСЛОТ
Реакція естерифікації
Розглянемо реакцію між етановою кислотою і етанолом:
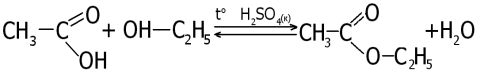
Дана реакція називається рекцією естерифікації, оскільки внаслідок реакції утворюється естер.
Реакція, яка відбувається в протилежному напрямку, називається гідролізом.
Умови перебігу реакцій естерифікації
Реакції естерифікації відбуваються повільно, йдуть не до кінця, оскільки відбувається гідроліз – розклад естерів водою:
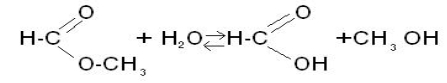
- подумайте, яким чином можна змістити рівновагу реакції в бік утворення естерів? (Видалити воду)
- Як ми можемо це зробити? За допомогою яких речовин? (конц.сульфата кислота)
Загальний висновок: Для карбонових кислот характерні властивості спільні з неорганічними кислотами а також специфічні, властиві тільки органічним кислотам – реакція естерифікації.
3. ДОБУВАННЯ ЕТАНОВОЇ КИСЛОТИ
Карбонові кислоти добувають в промисловості переважно за реакціями окиснення:
окиснення алканів (н-бутану):
2СН3 –СН2 –СН2 –СН3 + 5О2 → 4СН3–СООН + 2Н2О
окиснення спиртів і альдегідів :
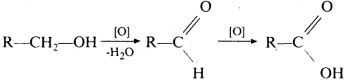
взаємодія солей карбонових кислот із сильними неорганічними кислотами:
СН3–СООNа + НСl → СН3 –СООН + NаСl
ферментація
Деякі бактерії, зокрема, роди Acetobacter і Clostridium, виробляють кислоту в процесі своєї життєдіяльності. Використання людиною подібних ферментаційних процесів відоме ще з давніх-давен. Таким чином утворюється низькоконцентрована оцтова кислота, яка цілком задовольняє побутові потреби.
- ЗАСТОСУВАННЯ ЕТАНОВОЇ КИСЛОТИ(презентує здобувач освіти)
Етанова кислота використовується для виробництва штучного шовку, пластмас, барвників, ліків (аспірину).
Є відмінним консервантом, тому застосовується для консервування харчових продуктів.
З етанової кислоти отримують гербіциди для боротьби з бур'янами.

Складні ефіри етанової кислоти входять до складу фруктових есенцій.

V. Закріплення нових знань
Робота з інтерактивним аркушем
https://www.liveworksheets.com/hb3384076ay

Виконання тесту «Хімічні властивості карбонових кислот» на
освітньому порталі «На Урок»
3384204

VІ. Підведення підсумків уроку
VІІ. Домашнє завдання
Опрацювати за електронним підручником «Хімія (рівень стандарту)» підручник для 10 класу закладів загальної середньої освіти (авт. Ярошенко О. Г.), сторінки 99-102 https://drive.google.com/file/d/1elbAxBsmZgRQLYbD_kvBazfeypY6YarD/view
- Виконати завдання 2, 3, 7 на сторінці 104 електронного підручника
- Підготувати повідомлення про застосування метанової кислоти та вищих карбонових кислот.


про публікацію авторської розробки
Додати розробку
