Хімічні властивості середніх солей. Лабораторні досліди № 4,5,6. Інструктаж з БЖД
Тема: Хімічні властивості середніх солей. Лабораторні досліди № 4,5,6. Інструктаж з БЖД
Мета: формування ключових компетентностей: закріпити знання учнів про солі (середні), їх склад, назви, фізичні властивості, повторити правила техніки безпеки під час виконання хімічних дослідів, поглибити знання про хімічні властивості солей; розвивати навички самостійної роботи, логічне мислення, пізнавальні здібності учнів, уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей середніх солей, продовжити формування умінь експериментувати, спостерігати, аналізувати досліди, робити висновки; виховувати інтерес до хімії як науки, сприяти формуванню здорового способу життя.
Очікувані результати: учні знають хімічні властивості солей; уміють називати солі за сучасною українською номенклатурою, складати відповідні рівняння реакцій, прогнозувати перебіг хімічних реакцій, формулювати висновки; оцінюють значення солей , висловлюють судження про значення хімічного експерименту як способу набуття нових знань.
Реалізація НЛ: «Екологічна безпека і сталий розвиток», «Громадянська відповідальність», «Здоров'я і безпека», «Підприємливість і фінансова грамотність».
Тип уроку: поглиблення знань і умінь.
Хід уроку
І. Організаціям класу.
ІІ. Перевірка ДЗ (врава №256)
IІI. Актуалізація опорних знань і умінь.
Робота з картками (1 на парту)
Завдання 1. Закінчити речення очікувань, використовуючи метод «Мікрофона».
1.Я знаю, що солі складаються з_______________ та ____________________________.
2.Я знаю, що сучасною українською номенклатурою назва солі утворюється
від назви _______________ та ____________________
3.Я знаю, що солі класифікують на _____________ , ___________ , ___________ ,____________ , _____________.
Завдання 2. Скласти формулу за назвою, вибери варіант.
Кальцій хлорид - ______, магній бромід - __________ алюміній сульфат -________, ферум (ІІІ) силікат - ______
натрій фосфат - _______, купрум (ІІ) нітрат - ___________.
Завдання 3. У даному переліку речовин підкресли солі. Дай назву середнім солям.
HCl, CaO, H2O, NaBr, Br2O7, CuSO4, NaHCO3, FeOHCl, NaKSO4, SO2, HNO3 ,
Завдання 4. . Пригадаймо фізичні властивості солей. Виконаємо вправу «Злови помилку».
1. Усі солі чорного кольору (Вони бувають різнокольорові:КМпО - фіолетовий, FеСІз— коричнево - червоний, АqзРО4—жовтий)
2.Борщ солять кислотою (сіллю, NaC1)
3.Речовини, які містять атоми металів і гідроксильну групу - солі (ні, гідроксиди)
4. Без солі СаСОз не можна провести жодного уроку (так, бо СаСОз - це крейда)
5.Усі нітрати розчинні (так, див. таблицю розчинності)
ІV. Мотивація навчальної та пізнавальної діяльності
Учитель: Сьогодні на уроці ми з вами закріпимо уже здобуті знання про цей клас неорганічних сполук, поглибимо знання про хімічні властивості солей, виконавши хімічні досліди.
(Запишіть тему уроку до робочого зошит).
Учитель. Головний герой однієї казки розповідає : ...І от пішли. Усі кімнати великі під землею стали, а стіни в них різні. То зелені, то жовті із золотими цяточками. Сині теж є, лазурові. Одним словом, прикрашено, що й висловити не можна. І сукня на ній - на господарці - змінюється. То вона блищить неначе скло, то раптом злиняє, а то діамантовим розсипом засяє, або червоно-мідною стане, потім знову шовком зеленим відливає.
Про кого йде мова?
Учитель: Як ви здогадались, мова йде про господарку Мідної гори з відомої казки П.П.Бажова "Малахітова шкатулка". Як ви думаєте, чи можуть описані явища відбуватися насправді, чи це лише талановита вигадка автора? Насправді мова йшла про перетворення напівдорогоцінного мінералу - малахіту, який є основною карбонатною сіллю купруму. Він зеленого кольору.
- Звідки ж беруться різні відтінки мінералу?
Учень: Малахіт - один із головних мінералів міді, що містить 57,4 % чистого металу. Поряд із ним у природі зустрічається інший карбонат купруму - азурит, якии відрізняється від малахіту вмістом купруму. Він темно - синього кольору. Крім того, до мінералів міді належать й інші самоцвіти: діоптаз, яскраво-блакитна бірюза, ризокол яскраво блакитний з ніжним зеленуватим відтінком. І все це - різні солі одного і того ж металу - купруму, на які перетворюється малахіт при дії на нього різних факторів довкілля. І всі ці перетворення є не чим іншим, як хімічними реакціями солей.
V. Поглиблення знань, умінь і навичок.
Учитель: Пригадайте, з ким взаємодіють середні солі?
Учитель: Ми отримали завдання від відомого вченого-хіміка Михайла Васильовича Ломоносова: «Юні друзі, я дуже любив експериментувати з різними хімічними сполуками. Пропоную і вам дослідити хімічні властивості солей, з'ясувати, з якими речовинами вони вступають у взаємодію, при яких умовах здійснюються реакції. Бажаю успіхів». Для того щоб знайти відповіді на запитання, виконаємо лабораторні досліди.
Учитель: Отже, сьогодні складна у нас задача, Хай нам з вами сприяє удача! Як і в будь-якій лабораторії нам не обійтися без правил техніки безпеки. Пригадаємо їх.
- Не можна брати речовини руками.
- Не можна пробувати хімічні речовини на смак.
- Не можна нахилятися над посудиною, в котру наливається яка-небудь речовина.
- Проводити досліди відповідно до інструктивної картки.
- Пам'ятайте, що кислоти та луги - їдкі речовини, які подразнюють шкіру, слизові оболонки, викликають опіки. Серед солей багато токсичних, фізіологічно небезпечних речовин.
- Прибирати за собою робоче місце.
Учитель: Розпочнемо роботу у хімічній лабораторії.
(Групи отримують інструктивні картках, знайомляться, проводять досліди, пишуть рівняння хімічних реакцій, роблять висновки.)
Лабораторний дослід 4. Взаємодія металів із солями у водному розчині
1 частина
1. Візьміть чисту пробірку.
2. На дно пробірки опустіть гранулу цинку.
3. У пробірку налийте 2 мл розчину купрум(ІІ) сульфату.
4. Ваші спостереження: Які зміни відбуваються у пробірці?
( Гранула цинку вкрилась тоненьким шаром заліза, бо більш активний метал витісняє менш активний метал із розчину солі).
5. Написати рівняння реакції.
Зверніться до ряду активності металів. Назвати тип реакції. Висновки. Більш активні метали витісняють менш активні метали із розчинів їх солей.
2 частина. 1 .Візьміть чисту пробірку.
2.На дно пробірки опустіть кусочки міді.
З.У пробірку налийте 2 мл розчину цинк сульфату.
4.Ваші спостереження: Які зміни відбуваються у пробірці?(Ніяких)
5.Написати рівняння реакції.
Зверніться до ряду активності металів.
Отже, солі реагують із металами, які у ряді активності розміщені ліворуч від металу, який входить до складу солі. Таким чином, більш активні метали витісняють менш активні із розчинів солей.

Перегляд відео «Сатурнове дерево»
Лабораторний дослід 5. Взаємодія солей з лугами у водному розчині
- Візьміть чисту пробірку.
- Налийте у пробірку 1 мл розчину ферум (III) хлориду.
- Додайте 1 мл розчину натрій гідроксиду.
Ваші спостереження: Які зміни відбуваються у пробірці? ( В результаті реакції випав бурий осад ферум (III) гідроксиду)
Написати рівняння реакції. Звертатися до таблиці розчинності, речовин. Назвати тип реакції.
Висновок. Солі взаємодіють із лугами за умови, якщо в результаті реакції одна з новоутворених речовин випадає в осад.
Лабораторний дослід 6. Реакції обміну між солями в розчині
1 .Візьміть чисту пробірку.
2.Налийте у пробірку 0, 5 мл розчину натрій сульфату.
3.Додайте 0, 5 мл розчину барій хлориду.
4.Ваші спостереження: Які зміни відбуваються у пробірці
В результаті реакції випав білий осад барій сульфату)
5.Написати рівняння реакції.
Звертатися до таблиці розчинності речовин.
Висновки. Солі реагують з солями, якщо в результаті реакції випадає осад.
VІ. Узагальнення та систематизація знань.
Вчитель. Гордон Драйвен говорив, що має значення тільки те знання, яке використовується на практиці.
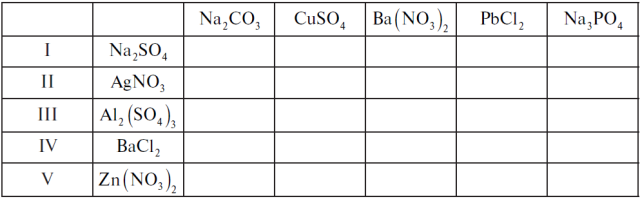
Завдання 1.
Складіть рівняння можливих реакцій за таблицею:
Вчитель. Максим Горький сказав: «…якомога уважніше вивчайте хімію. Це дивовижна наука, знайте!... Її пронизливий сміливий погляд проникає й у пітьму земної кори, і в невідомі частинки вашого серця, і таємниці будови каменю, і в безмовне життя дерев. Вона дивиться всюди і скрізь, відкриваючи гармонію, завзято шукає початок життя».
VІ. Підведення підсумків уроку
VІІ. Домащнє завдання.
§32, повторити властивості ОКНС,, підготуватись до пр ст.182


про публікацію авторської розробки
Додати розробку