Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями.
Урок хімії 8 клас
Тема. Хімічні властивості середніх солей: взаємодія з металами, кислотами, лугами, іншими солями.
Мета. Ознайомити з фізичними і хімічними властивостями середніх солей. Формувати науковий світогляд, розуміння причинно-наслідкового зв'язку між складом і властивостями речовин. Розвивати уміння спостерігати, аналізувати, робити висновки, складати формули солей і називати їх, складати і класифікувати рівняння хімічних реакцій, розвинути вміння і навички роботи з лабораторним обладнанням та хімічними реактивами, розв’язувати задачі.
 Обладнання: цифрові вимірювальні комплекси ТМ «Einstein», комп'ютер, мультимедійна презентація на тему уроку, роздатковий матеріал - картки; зразки солей і мінеральної води; транспаранти для магнітної дошки; етикетки від мінеральної води; пробірки, колби, розчини NaCI, AgNO3, Na2CO3, CuSO4, Fe (цвяхи), NaOH, H2SO4, BaCl2, Cu, FeSO4, FeCl3, NaHCO3, крейда, підручник О.Г. Ярошенко «Хімія 8 клас».
Обладнання: цифрові вимірювальні комплекси ТМ «Einstein», комп'ютер, мультимедійна презентація на тему уроку, роздатковий матеріал - картки; зразки солей і мінеральної води; транспаранти для магнітної дошки; етикетки від мінеральної води; пробірки, колби, розчини NaCI, AgNO3, Na2CO3, CuSO4, Fe (цвяхи), NaOH, H2SO4, BaCl2, Cu, FeSO4, FeCl3, NaHCO3, крейда, підручник О.Г. Ярошенко «Хімія 8 клас».
Демонстрації
15. Таблиця розчинності.
16. Зразки солей.
17. Хімічні властивості солей.
Лабораторні досліди
4. Взаємодія металів із солями у водному розчині.
5. Взаємодія солей з лугами у водному розчині.
6. Реакція обміну між солями в розчині.
Тип уроку. Rotation Model (“Ротаційна модель”) Blended Learning (Змішане навчання). Ротація за станціями – це модель організації курсу чи предмету, в якому учні переходять між різними «станціями» в межах одного чи декількох кабінетів. Ротація по станціях відрізняється від індивідуальної ротації тим, що учні мають пройти усі станції, а не лише ті, що встановлені їхнім індивідуальним графіком.
Хід уроку
1 етап. Організаційний момент. Перевірка домашнього завдання.
• у дошки працюють учні з домашніми вправами
• з місця: повторити номенклатуру кислотних залишків. Повторити правила: - закінчити фразу ...
реакція нейтралізації - це ...
кислоти - це ...
оксиди - це ...
класифікація оксидів ...
Дома потрібно будо заздалегідь опрацювати новий матеріал за параграфом та передивитись відео-урок за посиланням
https://mriya-urok.com/video/soli-himicheskie-svojstva-solej/ *
(якщо діти не зробили цього, передивитися відео у класі). *відео може бути окремо обране вчителем, або створене власноруч.
2 етап. Ротація за станціями (клас поділяється на чотири групи).
1 станція
Провести дослідження складу мінеральних вод Донецької області, використовуючи етикетки виробників. Учні отримують картку з завданнями і етикетку від конкретної води.
В цей же час учні працюють біля дошки з магнітами і картками за етикетками від мінеральних вод.
Використовуючи етикетку від мінеральної води, досліджуйте її сольовий склад:
- Зробіть заголовок - назва води;
- Знайдіть хімічний склад, в зошиті запишіть окремо катіони (іони+) і аніони (іони-);
-
Складіть з іонів формули солей (+) наприклад: 2Na+ + SO42-
 Na2SO4
Na2SO4
- Підкресліть формули солей, назвіть їх.
- Підрахуйте загальну кількість одержаних формул солей
Обговорити отримані результати.
- Де розташовано джерело?
- З якої глибини відбувається підйом води?
- До якого типу мінеральних вод вона відноситься?
- Яка ще інформація є на етикетці?
- Особисте ставлення до мінеральних вод.
2 станція
Учні працюють з цифровим вимірювальним комплексом «Einstein», визначаючи рН розчинів солей і виводять результати дослідження на екран в презентацію.
Визначення pH хімічних речовин.
 Мета: ознайомитись з показником рН та факторами, що на нього впливають.
Мета: ознайомитись з показником рН та факторами, що на нього впливають.
- Підготуйте цифрову лабораторію до роботи.
- Під’єднайте датчик рН до регістратора.
- Переведіть регістратор у режим статичного вимірювання.
Хід експерименту
- Налийте у різні стакани розчини солей, кислоти та лугу для дослідження.
- За допомогою рН-метру виміряйте рН кожної з речовин, занурюючи електрод у розчини.


Аналіз результатів
- Який максимальний та мінімальний рН створювали досліджувані речовини?
- Від чого залежить значення рН у розчині?
- Який рН створювали солі, кислоти та луги?
3 станція
Хімічні властивості солей.
Проведення реакцій по групах з реактивами, що стоять на столах.
Робота з підручником с. 175-176, таблицею розчинності. Звернути увагу на вказівки «Пам'ятаєте!»
Хімічні властивості солей розглянемо в ході лабораторних дослідів 4-6.
1.Взаємодія з металами CuSO4 +Zn= ; ZnSO4+Cu=
2.Взаємодія з розчинними основами – лугами CuSO4+NaOH=; FeCl3+NaOH=
3.Взаємодія з кислотами.
ВаCl2+H2SO4= ; Na2CO3+HCl=
4. Взаємодія з розчинами солей CuSO4+ВаCl2=
Взаємодія між солями.
Мета: ознайомитись з реакціями, що відбуваються між солями.
Реактиви і матеріали: CuSO4, розчин купрум (ІІ) сульфату, 5%; BaCl2, розчин барій хлориду, 5%
Реакція між двома солями відбуватиметься тільки тоді, коли обидві солі взято у розчині, а одна з новоутворених солей випадатиме в осад.
- Підготуйте цифрову лабораторію до роботи.
- Під’єднайте датчик електропровідності до регістратора.
-
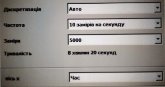 Переведіть регістратор у режим статичного вимірювання. Встановіть наступні параметри регістратора.
Переведіть регістратор у режим статичного вимірювання. Встановіть наступні параметри регістратора.
Хід експерименту
- У хімічний стакан налийте 20 млл розчину купрум (ІІ) сульфату.
- Занурите у стакан датчик електропровідності.
- Запустіть реєстрацію та долийте 20 мл розчину барій хлориду.
- Дочекайтесь завершення змін та зупиніть реєстрацію, графік збережіть.



Аналіз графіку
-
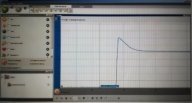 Поставте курсор на початкове значення та зафіксуйте його.
Поставте курсор на початкове значення та зафіксуйте його.
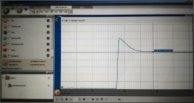
- Поставте курсор на кінцеве значення та порівняйте його з початковим.
-
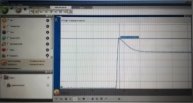 Поясніть наявність піку на графіку.
Поясніть наявність піку на графіку.
Аналіз результатів
- Реакція якого типу відбулася у розчині? Що є продуктами реакції?
- З яким речовинами не буде реагувати барій хлорид, а з якими барій сульфат?
Проведіть реакції, що характеризують загальні властивості солей. Заповніть таблицю:
|
Що робили |
Спостереження |
Рівняння реакції |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
Учні по черзі коментують спостереження і рівняння реакцій.
4 станція
Дослідження солей та їхніх водних розчинів на електричну провідність.
Мета: ознайомитись з показником електропровідності (фізико-хімічний показник, що характеризує вміст речовин, що здатні проводити електричний струм) розчину та визначити основні фактори, що впливають на нього. Дослідити вплив солей на електропровідність розчину.
Реактиви та матеріали: NaCl, водний розчин натрій хлориду (кухонної солі), 10%; СаСО3, водна суспензія кальцій карбонату (крейди), 10%; FeCl3, розчин ферум (ІІІ) хлориду, 10%; NaHCO3, водний розчин натрій гідрогенкарбонату (соди), 10%.
-
 Підготуйте цифрову лабораторію до роботи.
Підготуйте цифрову лабораторію до роботи.
- Під’єднайте датчик електропровідності до регістратора
- Переведіть регістратор у режим статичного вимірювання.
 Хід експерименту
Хід експерименту
- Налити в різні стакани досліджувані речовини.
-
 Виміряти електропровідність
Виміряти електропровідність
Аналіз результатів
- Які речовини впливають на значення електропровідності?
- Чи всі речовини створювали електропровідність у розчині однаково?
3 етап. Осмислення.
Дві властивості солей ми з вами вже вивчили.
• Які? З чим реагують кислоти? (Відповіді дітей і проведення дослідів з кислотами і основами).
• Що вийшло? Коментарі.
• А як ви думаєте, з чим ще можуть реагувати солі?
• Будь-які солі або є умова протікання реакції?
• Проведіть реакцію між нітратом срібла і хлоридом натрію.
• А як ви думаєте, з чим ще можуть реагувати солі? • З усіма? (Тільки, що стоять у ряді напруги до водню) проробляємо дослід з залізним цвяхом.
Колективне складання опорної схеми «Хімічні властивості солей»
4 етап. Підведення підсумків
• Що нового дізналися на уроці?
• Що було цікаво?
• Виставляння оцінок
Домашнє завдання. § 41, впр.155-159 с. 216 письмово, додатково №134 с.198, скласти та розв’язати задачу подібну за домашню №159 або класну.

про публікацію авторської розробки
Додати розробку
