Хімічні властивості вуглеводнів: відношення до розчинів кислот, лугів, калій перманганату; реакції повного окиснення, заміщення, приєднання водню та галогенів.
Урок 40
Тема уроку: Хімічні властивості вуглеводнів: відношення до розчинів кислот, лугів, калій перманганату; реакції повного окиснення, заміщення, приєднання водню та галогенів.
МЕТА УРОКУ:
ознайомити учнів з хімічними властивостями вуглеводнів (алканів, алкенів та алкінів) навчити писати їх хімічні реакції;
з’ясувати на прикладі трьох класів вуглеводнів як будова молекул вуглеводнів та поява кратних зв’язків в будові молекули речовини відображається на її хімічних властивостях;
показати значення реакцій горіння, повного й часткового окиснення для вуглеводнів;
продовжити формувати вміння аналізувати досліди, робити висновки про хімічні властивості вуглеводнів на основі експерименту;
розвивати навички й уміння складання рівнянь хімічних реакцій що характеризують хімічні властивості вуглеводнів, називати галогенопохідні згідно до їх формул;
вчити використовувати набуті теоретичні знання під час розв’язання практичних завдань;
розвивати логічне мислення, пам’ять, уміння спостерігати і аналізувати досліди, складати рівняння реакцій;
виховувати інтерес до вивчення хімії, самостійності в навчанні.
ТИП УРОКУ: вивчення нового матеріалу.
ОСНОВНІ ПОНЯТТЯ: реакції приєднання (електрофільне приєднання), окиснення, галогенування, гідрогалогенування, гідрування, гідратації та полімеризації.
ОБЛАДНАННЯ: Досліди 11, 12: колба В’юрца, капельна воронка, пробірка, газовідвідна трубка, промивалка, кристалізатор, циліндр, горілка, штатив (відношення метану та етилену до бромної води та перманганату калію), презентація до уроку, http://www.chemistry.ssu.samara.ru/chem2/index2.htm - відношення метану та етилену до бромної води та перманганату калію або http://www.youtube.com/watch?v=tzT2QehcgiI&list=PL0Rzc1qw08bNjBqCwbKN8p1-kpo-sSpfg -Алкани та алкени – відеодосліди: метан+О2, етилен+бромна вода, етилен + калій перманганат, етилен, отримання та горіння.
http://www.youtube.com/watch?v=x6WSEKw8I-I - хімічні властивості алкенів;
http://www.youtube.com/watch?v=BWCgAA1_TzE – взаємодія ацетилену з бромною водою; http://www.youtube.com/watch?v=S1j2H06vZtQ –фізичні та хімічні властивості ацетилену;
http://www.youtube.com/watch?v=hrdVO02_PQo - відео-досліди про хімічні властивості метану, http://www.chemistry.ssu.samara.ru/chem2/flash/clor0.swf - анімація реакції хлорування, http://www.chemistry.ssu.samara.ru/chem2/flash/clor_s.swf - анімація реакції хлорування зі звуковим коментарем.
ТЕХНІКА БЕЗПЕКИ: дотримуватися правил роботи з горючими газами, нагрівальними приладами, концентрованими кислотами та вогненебезпечними рідинами.
ФОРМИ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ: фронтальна робота, розповідь учителя, складання реакцій.
МЕТОДИ НАВЧАННЯ: самостійна робота, робота в групах – “навчання разом”, дискусійна - “мозковий штурм”, “ситуація з життя”, диференційний підхід до домашнього завдання.
ПЛАН УРОКУ
- Організація классу. Мотивація навчальної діяльності.
- Перевірка домашнього завдання. Актуалізація опорних знань. Фронтальна робота за
запитаннями.
- Вивчення нового матеріалу:
1. Визначення якісного складу вуглеводнів
2. Хімічні властивості вуглеводнів:
а) Хімічні властивості насичених вуглеводнів за н.у. .
б) Горіння – повне окиснення насичених та ненасичених вуглеводнів.
в) Термічний розклад.
г) Реакції заміщення у насичених вуглеводнів – галогенування по радикальному типу.
д) Реакція нітрування у насичених вуглеводнів (реакція Коновалова).
е) Реакції приєднання у ненасичених вуглеводнів: гідрування, галогенування, гідрогалогенування, гідратації, заміщення, утворення солей ацетилені дів, полімеризації / ди-, тримеризації.
3) Демонстрація – відношення насичених та ненасичених вуглеводнів до розчинів калій перманганату та бромної води та горіння вуглеводнів та визначення якісного складу вуглеводнів.
IV. Закріплення і систематизація знань учнів, осмислення об’єктивних зв’язків у вивченому
матеріалі.
V. Повторення вивченого матеріалу під час бесіди.
VI. Первинний контроль знань під час виконання тестових завдань
VII. Підбиття підсумків уроку.
VIII. Домашнє завдання.
ХІД УРОКУ
- Мотивація навчальної діяльності.
Ми продовжимо вивчати органічні сполуки. Ми ознайомимося з хімічними властивостями вуглеводнів (алканів, алкенів та алкінів), навчимося писати рівняння їх хімічних реакцій, на прикладі трьох класів вуглеводнів з’ясуємо як будова молекул вуглеводнів та поява кратних зв’язків в будові молекули речовини відображається на її хімічних властивостях, вияснимо значення реакцій горіння, повного й часткового окиснення для вуглеводнів; переглянемо демонстрації дослідів щодо відношення насичених та ненасичених вуглеводнів до бромної води та калій перманганату, проаналізуємо їх та зробимо висновки про хімічні властивості вуглеводнів на основі експерименту. (Слайд 1)
II. Перевірка домашнього завдання. Актуалізація опорних знань.
а) Фронтальна робота: Гра «Закінчи речення» (Слайд 2).
б) Розв’яжіть кросворд «Особливості будови алкенів та алкінів» (Слайд 3).
в) 1. Самостійна робота
Варіант І
1. Дайте назви сполукам:
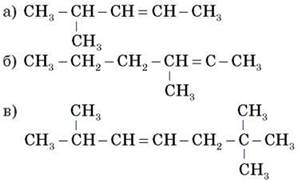
2. Напишіть структурні формули вуглеводнів:
а) 2-метил-2-пентен;
б) 2,2,5,5-тетраметил-3-гептин.
Варіант ІІ
1. Дайте назви сполукам
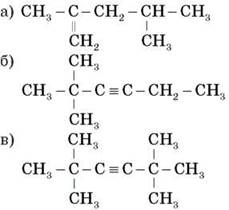
2. Напишіть структурні формули таких вуглеводнів:
а) 2,2,3-триметил-3-гексен;
б) 2-метил-3-гексин.
Проблемне питання:
Розгляньте молекули ацетилену, етилену та етану та поясніть, чи можна вважати їх гомологами. Чи наділені ці три сполуки однаковими хімічними властивостями? Як ви гадаєте, які типи реакцій властиві кожній з цих трьох сполук?
Вивчення нового матеріалу.
1. Визначення якісного складу вуглеводнів
Дослід 8: Горіння парафінів, визначення якісного складу вуглеводнів за продуктами горіння. (Слайд 4)
За допомогою реакції горіння парафіну, можна визначити якісний склад алканів.
С14Н30 + 21,5 О2 → 14 СО2 + 15 Н2О
2) Як можна довести наявність у продуктах окиснення вуглекислого газу? (Реакція з вапняною водою, яка каламутніє)
Газ, що утворюється пропускаємо через вапняну воду – вона каламутніє
СО2 + Са(ОН)2 → СаСО3↓ + Н2О
3) Як можна довести наявність у продуктах окиснення води? (Безводний купрум (ІІ) сульфат в результаті утворення кристалогідрату змінює забарвлення з білого на блакитний)
СuSO4 + 7Н2О → СuSO4 · 7Н2О
білий синій
Якщо холодне скло потримати над полум’ям, то на ньому конденсується вода. Отже, до складу алканів входять С і Н.
4) Запишіть рівняння реакцій:
Хімічні властивості вуглеводнів.
Хімічні властивості будь-якої сполуки визначаються її будовою, тобто природою атомів, що входять до її складу та характером зв’язків між ними.
Виходячи з цього положення спробуємо визначити які властивості характерні для насичених та ненасичених вуглеводнів.
Насамперед насиченість вуглеводнів не допускає реакцій приєднання, але не перешкоджає реакціям розкладу та заміщення. По-друге симетричність неполярних С-С і слабо полярних С-Н ковалентних зв’язків допускає гемолітичний (симетричний) розрив на вільні радикали. Тому для реакцій алканів характерний радикальний механізм.
Оскільки гетеролітичний розрив зв’язків С-С і С-Н за нормальних умов не відбувається, то алкани практично не вступають йонні реакції. Давайте подивимося чи вступає метан в реакції з калій перманганатом та бромною водою.
За н.у. метан досить інертний: (Слайд 6).
- не реагує з лугами і кислотами;
- не окиснюється перманганат калію (KMnO4);
- не знебарвлює бромну воду (Вr2).
Дослід 11: http://www.chemistry.ssu.samara.ru/chem2/index2.htm - відношення метану до бромної води та калій перманганату.
Метан отримуємо прокалюванням безводного ацетату натрію з гідроксидом натрію.
СН3СООNa + NaОН → Na2СО3 + СН4↑
Пропускаємо метан через розчин калій перманганату. Ніяких змін не спостерігаємо. Бромна вода також не змінює забарвлення. Отже, метан стійкий до окиснювачів і не вступає в реакцію з бромом за даних умов.
Хімічні властивості алкенів визначаються будовою і властивостями подвійного зв’язку С=С, який значно активніший інших зв’язків в молекулах цих сполук. Алкени більш реакційно здатні, аніж алкани.
За хімічними властивостями ацетиленові вуглеводні схожі з етиленовими, для них також характерні реакції приєднання, окиснення та полімеризації. Реакції приєднання алкінів супроводжуються постадійним розривом двох p-зв’язків. Спочатку розривається один p-зв’язок і на місці потрійного зв’язку залишається подвійний, який після розриву другого p-зв’язку перетворюється на простий С‑С зв’язок. Таким чином, завдяки наявності двох p-зв’язків, до однієї молекули ацетиленового вуглеводню може приєднатись дві молекули реагенту. Але, на відміну від алкенів, для алкінів з кінцевим потрійним зв’язком характерні також і реакції заміщення (утворення ацетиленідів). Це зумовлено слабкими кислотними властивостями ≡С–Н-групи. Отже, ацетиленові вуглеводні вступають в 1) реакції електрофільного приєднання в ацетиленів відбуваються повільніше ніж в алкенів; 2) алкіни вступають в реакції нуклеофільного приєднання; 3) проявляють кислотні властивості і здатні вступати в реакції з активними металами, утворюючи солі.
Реакції окиснення:
Давайте подивимося чи вступають ненасичені вуглеводні в реакції з калій перманганатом та бромною водою.
Дослід 12 - відношення етилену до калій перманганату. (Слайди 7,8) http://www.youtube.com/watch?v=ECzR7WJ2zII або http://www.youtube.com/watch?v=tzT2QehcgiI&list=PL0Rzc1qw08bNjBqCwbKN8p1-kpo-sSpfg Алкани та алкени–відеодосліди: метан+О2, етилен+бромная вода, етилен + калій перманганату, отримання та горіння.
Отримуємо етилен нагріванням суміші етилового спирту з концентрованою сірчаною кислотою (дегідратація спирту).
Н2SO4(конц), t0C
СН3-СН2ОН → СН2=СН2 + Н2О
Етилен, який виділяється пропускаємо через розчин калій перманганату, спостерігаємо знебарвлення розчину. Отже, для ненасичених вуглеводнів характерні реакції окиснення.
а) Реакція Вагнера
3CH2 = CH2 + 2КМnО4+4Н2О →3НО-СН2-СН2-ОН+ 2КОН + 2МnО2↓ етиленгліколь (етандіол)
КМnО4,(Н+), t0C
б) СН3-CH = CH-СН3 + 4[О] → 2СН3СООН (оцтова кислота)
3CH ≡ CH + 8КМnО4+ 4Н2О → НОО-С-С-ООН + 8КОН + 8МnО2↓
щавлева кислота
Ця реакція є якісним визначенням ненасичених вуглеводнів (кратний зв’язок).
Реакції горіння - повне окиснення. (Слайд 10)
Метан горить характерним блакитним полум'ям з виділенням великої кількості теплоти, утворюючи вуглекислий газ і воду.
СН4 + 2О2 →СО2↑ + 2Н2О; ∆Н = 890 кДж/моль
У разі нестачі кисню метан окиснюється не повністю. І тоді замість карбон(IV) оксиду CO2 утворюється карбон(II) оксид CO, відомий як чадний газ.
2CH4 + 3O2 → 2CO↑ + 4H2O.
Запамятай! Суміш СН4 і О2 дуже вибухонебезпечна. Спричинює аварії в шахтах, може статися вибух в приміщенні.
Реакції горіння етилену та ацетилену також відбуваються з великим виділенням тепла (Слайди 11, 12) http://www.youtube.com/watch?v=n7VMP9bh0g4
Запишіть рівняння реакцій горіння етилену та ацетилену:
С2Н4 + 3O2 → 2СО2↑ +2Н2О +Q – світне полум’я
Ацетилен горить яскравим полум’ям з виділенням копоті, так як в молекулі ацетилену масова частка Карбону більша, ніж в молекулі етилену.
2С2Н2 + 5O2 → 4СО2↑ +2Н2О +Q
Отже, чим більша масова частка Карбону, тим більш кіптявим буде полум’я. У етану масова частка Карбону найменша – Карбон швидко згорає (етан горить безбарвним полум’ям). У етану масова частка Карбону більша, тому перед тим як згоріти Карбон розжарюється (ми бачимо світне полум’я). У ацетилена масова частка Карбону найбільша, тому Карбон не весь згорає через нестачу кисню (ми бачимо кіптяве полум’я.
Термічний розклад.
Алканам властиві реакції термічного розкладу. (Слайд 13)
t›1000°C
а) СН4 → С + 2Н2↑
1500°С
б) 2СН4 → С2Н2 + 3Н2↑
Водень, який утворюється при термічному розкладі (вище 1000 °C) використовують для синтезу амоніаку та соляної кислоти, а сажу - для добування гуми і фарб.
Запишіть рівняння реакції термічного розкладу етану:
С2Н 6 → 2С + 3Н2 ↑
Реакції заміщення.
Алкани вступають в реакції заміщення по радикальному типу (Слайд 14) http://www.chemistry.ssu.samara.ru/chem2/flash/clor0.swf -анімація р-я хлорування
http://www.chemistry.ssu.samara.ru/chem2/flash/clor_s.swf -р-я хлорування анімація зі звуковим коментарем
Запамятай! Усі продукти хлорування алканів токсичні й руйнують озоновий шар.
hν
СН4 + Cl2 → CH3Cl + HCl
хлорметан
hν
CH3Cl + Cl2 → CH2Cl2 + HCІ
дихлорметан
hν
CH2Cl2+ Cl2 → CHCl3 + HCl
трихлорметан (хлороформ)
hν
CHCl3 + Cl2 → CCl4 + HCl
тетрахлорметан
Запишіть сумарне рівняння реакції хлорування метану:
hν
СН4 + 4Cl2 → CCl4 + 4HCl
Метан вступає в реакції заміщення. Серед реакцій заміщення найбільше значення мають реакції галогенування (хлорування, бромування) та нітрування. Реакція хлорування відбувається при освітленні суміші метану і хлору розсіяним ультрафіолетовим промінням (або при нагріванні). В ході реакції відбувається поступове заміщення атомів Гідрогену в молекулі метану атомами Хлору. Продуктами реакції є відповідно на першій стадії хлорометан CH3Cl і HCl, на другій - дихлорометан CH2Cl2 і HCl, на третій - трихлорометан CHCl3 і HCl; і на четвертій - тетрахлорометан CHCl4 і HCl. Це ланцюгова реакція, яка відбувається за вільнорадикальним механізмом. Вивченням механізму таких реакцій займався російський учений Микола Миколайович Семенов, за що й був нагороджений Нобелівською премією.
Реакція нітрування (реакція Коновалова) .
Алкани також вступають в реакції нітрування. (Слайд 15)
Механізм реакції нітрування метану вперше дослідив російський учений Коновалов, і тому ця реакція носить його ім’я. Реакція нітрування метану відбувається при температурі 140 °С в присутності суміші двох концентрованих кислот - нітратної і сульфатної. Суміш цих кислот називають нітруючою сумішшю. У результаті реакції нітрування утворюється нітроментан CH3NO2 (застосовують як розчинник, напівпродукт для синтезу вибухових речовин, як реактивне паливо) і вода:
140-1500С, р
СН3 - Н + НО -NО2 → CH3 - NО2 + H2О
(розбавлена) нітрометан
Дегідрування алканів.
Дегідруванням алканів ми отримуємо алкени (Слайд 15)
t0C, kat.
СnН2n+2 → CnH2n + H2↑
Утворення ацетиленідів.
Характерною особливістю алкінів є здатність вступати в реакції з активними металами з утворенням солей - ацетиленідів. http://www.chemistry.ssu.samara.ru/chem2/link_v9.htm (Слайд 16)
СН≡СН + NaNH2 →NaН≡СNa+NH3
СН≡СН + 2[Cu(NH3)2]OH → CuНС≡ССu+ 4NH3 +2H2O
Запишіть рівняння реакції утворення ацетилен іду срібла:
HCCH+2[Ag(NH3)2]OH AgCCAg +4NH3+2H2O
Давайте розглянемо реакції приєднання, властиві ненасиченим вуглеводням: Гідрування, галогенування, гідрогалогенування, гідратації, полімеризації. (Слайд 17)
Гідрування - приєднання Гідрогену (Слайд 18)
Реакції приєднання (електрофільного приєднання)
відбуваються за місцем розриву π - зв’язку в СН2 = СН2 та двох π-зв’язків у 2 стадії в СН≡СН
СН2= СН2 + Н2→ СН3 - СН3
Н2 Н2
СН≡СН → СН2= СН2 → СН3- СН3
Pt Pt
Галогенування - приєднання галогенів (Слайд 19)
Дослід 12 - відношення етилену до бромної води. http://www.chemistry.ssu.samara.ru/chem2/index2.htm (бромна вода)
http://www.youtube.com/watch?v=BWCgAA1_TzE Взаємодія ацетилену з бромною водою
Пропускаємо етилен через розчин брому в воді (бромну воду). Бромна вода дуже швидко знебарвлюється. Бром приєднується до етилену за місцем подвійного зв’язку. При цьому утворюється 1,2- диброметан.
СН2=СН2 + Br2 → СН2Br-СН2 Br
Запишіть рівняння реакцій бромування етилену та ацетилену
СН ≡ СН + Br2 → СН2 Br = СН2 Br
СН ≡ СН + 2Br2→ СНBr2 – СНBr2
Реакція знебарвлення водного розчину брому є якісною реакцією на ненасиченість органічних сполук.
Гідрогалогенування - приєднання НСІ, НBr, тощо (Слайд 20) http://www.chemistry.ssu.samara.ru/chem1/flash/AdE.swf інтерактивна анімація-електрофільне приєднання
![]()
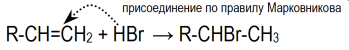
Правило Марковнікова
Якщо атоми Карбону, які утворюють кратний зв’язок, з’єднані з різною кількістю атомів Гідрогену, то Гідроген із НСl або НВr приєднується до найбільш гідрогенізованого атома Карбону (того атома Карбону, біля якого атомів Гідрогену більше).
Запишіть рівняння реакцій гідрогелогенування етилену та ацетилену
СН3- С≡СН + НCI → СН3- СCI= СН2 → СН3- СCI2–СН3.
СН≡СН +НСІ→ СН2=СН-СІ +НСІ→ СН3-СНСІ2
Гідратації - приєднання води (Слайд 21)
СН2= СН2 + 2Н2О → СН3- СН2ОН
В реакціях несиметричних алкенів спостерігається правило Марковнікова.
Запишіть рівняння гідратації пропілену.
Н+
СН3- СН= СН2 + Н2О → СН3- НС(ОН) – СН3
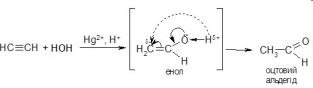 реакція Кучерова
реакція Кучерова
Реакції полімеризації
Реакції полімеризації – реакції утворення високомолекулярної сполуки (полімера) шляхом
поступового приєднання молекул низькомолекулярної речовини (мономера - М): nМ → Мn (Слайд 22)
кат.
nСН2= СН2 → (-СН2- СН2-)n – поліетилен
Запишіть рівняння полімеризації пропану
кат.
nСН2- СН-СН3 → (-СН2- СН(СН3 )-)n – поліпропілен
Димеризація та тримеризація алкінів. Ацетилен під впливом солей купруму (І) в кислому середовищі димеризується з утворенням вінілацетилену: (Слайд 23)
CuCl
СН≡ СН + СН≡ СН → СН2=СН-C≡CH
NH4Cl вінілацетилен
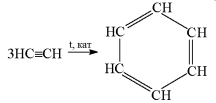 бензен
бензен
IV. Закріплення і систематизація знань учнів, осмислення об’єктивних зв’язків у вивченому
матеріалі. (Слайди 24-30)
2) Розпізнайте речовини. (Слайд 25)
Вам дано дві речовини. Одна з них етилен, а інша – етан. Запропонуйте, як можна розпізнати ці речовини. (а – етан, б – етилен)
3) Виберіть реакції, характерні для алканів:(натисніть на відповідний прямокутник) (Слайд 26)
4) З якими представниками ненасичених вуглеводнів ви вже знайомі? (Етилен, ацетилен.) (Слайд 27)
5) Виберіть реакції, характерні для ненасичених вуглеводнів: (натисніть на відповідний прямокутник) (Слайд 28)
6) Дайте назви реакціям (Слайд 29)
СН2=СН2+Cl2→СН2Cl- СН2Cl
СН2Cl- СН2Cl → СН2= СНCl
- HCl
СН2= СНCl → ( -СН2- СНCl -)n
СН2=СН2+ Н2О → C2H5OH
СН2=СН2 + C6H6 → C6H5-CH2-CH3
C6H5-CH2-CH3 → ( -(C6H5)СН- СН-)n
[O]
СН2=СН2 → CH3CHO
СН≡СН + HCl → СН2= СНCl
СН2= СНCl →( -СН2- СН Cl -)n
СН≡СН + Н2О → CH3CHO
[O]
CH3CHO → CH3COOH
7) Установіть відповідності між хімічними реакціями та застосуванням метану: (Слайд 30)
|
Реакції за участю метану |
Застосування метану |
|
Повне окиснення |
Паливо |
|
Хлорування |
Виробництво розчинників |
|
Термічний розклад |
Одержання сажі та водню |
V. Повторення вивченого матеріалу під час бесіди.
Порівняйте хімічну активність насичених вуглеводнів (алканів) і ненасичених вуглеводнів (алкенів і алкінів). (Слайд 31)
VI. Первинний контроль знань під час виконання тестових завдань
8) Здійсніть перетворення: (Слайд 32)
CО2 С2Н4Cl2
↑ ↑
С → СН4 → С2Н2 → С2Н4 → С2Н6 →СО2
↓ ↓
С2Н2Br4 С2Н5Cl
9) Вкажіть, яку масу хлору може приєднати етен кількістю речовини 0,1 моль: (Слайд 33)
10) Визначте невідомий вуглеводень у реакції
2СхНу + 11О2 → 8СО2↑+ 6Н2О
VII. Підбиття підсумків уроку.
VIII. Домашнє завдання.
Хімія, 9 клас, О.Г.Ярошенко: §21, с.126-128; §23, с.133-137; Впр. 1-4, с. 138-139


про публікацію авторської розробки
Додати розробку
