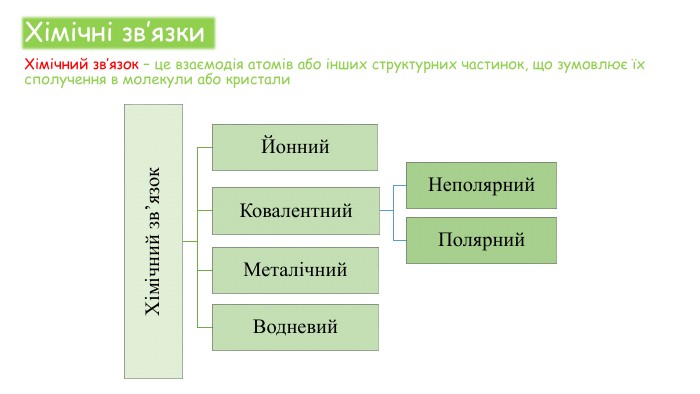
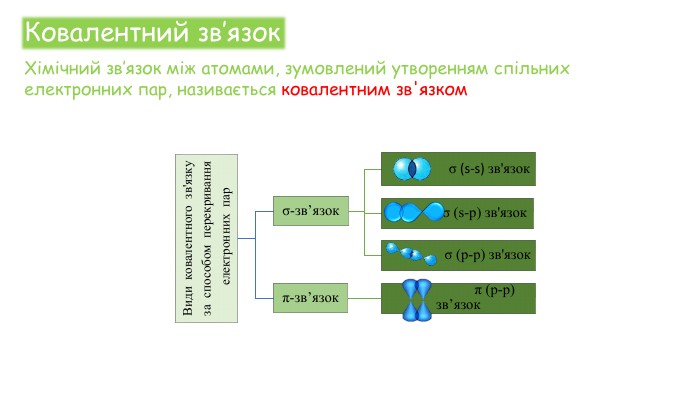
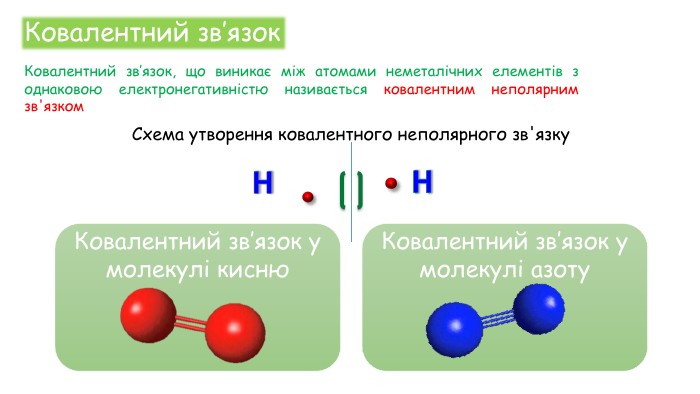
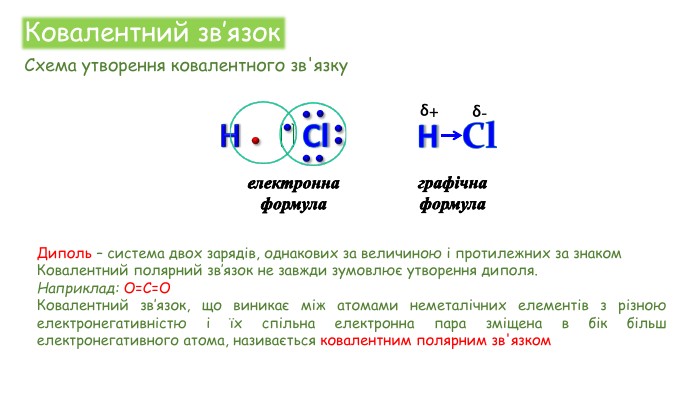
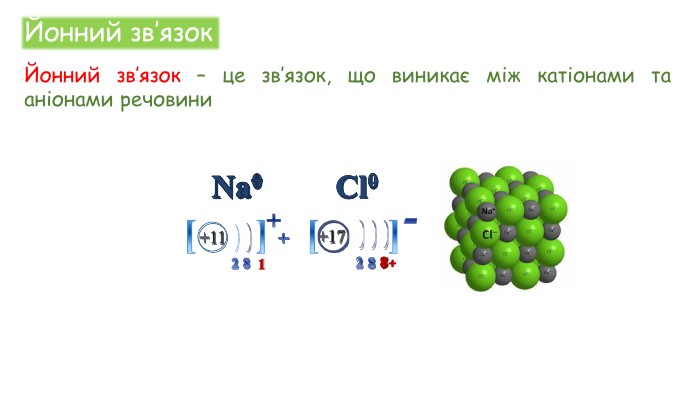
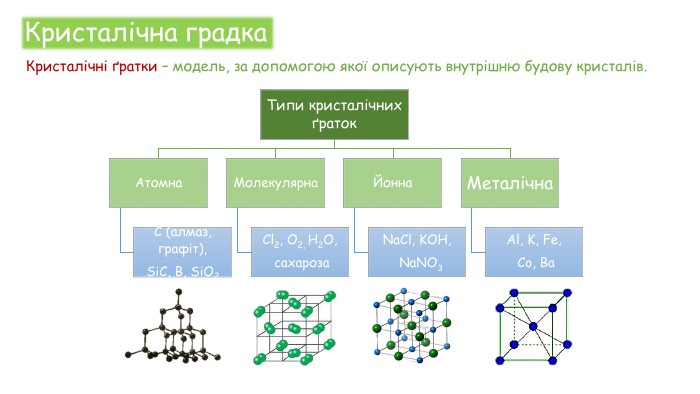
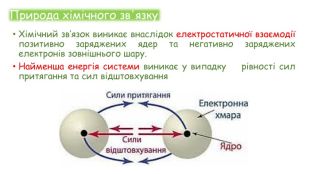
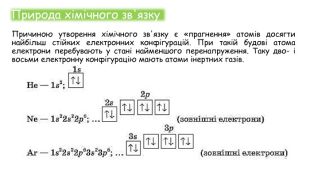
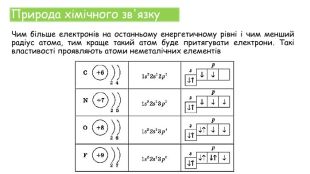
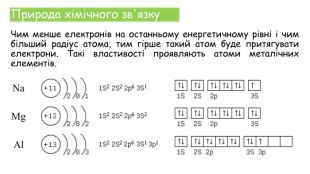
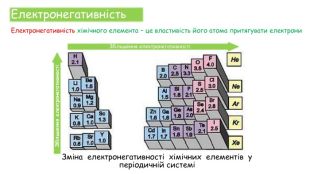
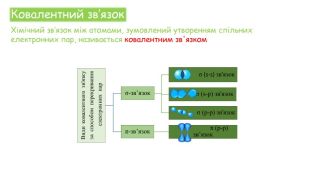
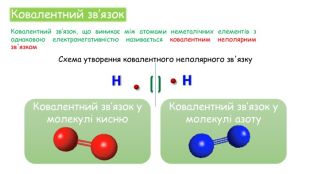
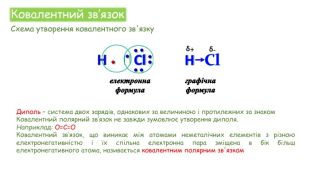
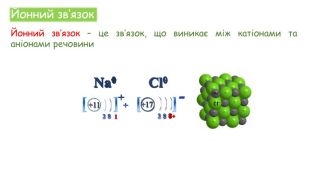
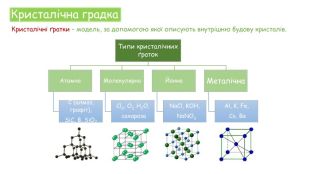
Хімічні зв'язки. Будова речовини
Про матеріал
Презентація для уроку з теми "Хімічні хв'язки. Будова речовини"
Урок містить фотографії з відкритих джерел
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку