Презентація "Хімічний зв’язок і будова речовини"
Про матеріал
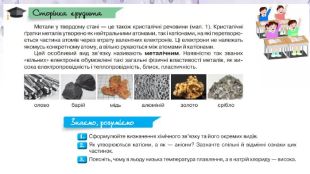
Презентація "Хімічний зв’язок і будова речовини" складена для супроводу дистанційного уроку з Хімії 9 клас за підручником Ярошенко О.Г. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку