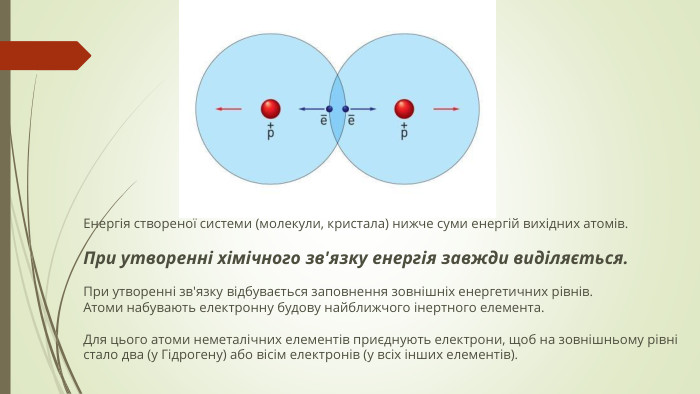
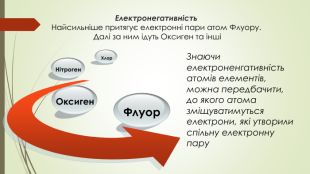
Хімічний зв'язок і будова речовини. Природа хімічного зв’язку. Електронегативність атомів хімічних елементів
Про матеріал
Хімічний зв'язок і будова речовини. Природа хімічного зв’язку. Електронегативність атомів хімічних елементів
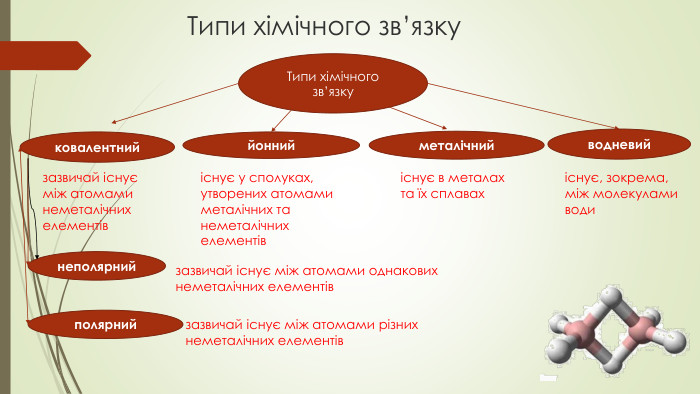
Типи хімічного зв’язку Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку