Презентація "Стан електронів в атомі. Електронні орбіталі.енергетичнв рівні.Поняття про енергетичні підрівні.Радіус атома.Графічні та електронні формули атомів хімічних елеме""
Про матеріал
Презентація являє собою лекційний матеріал за підручником О.Г. Ярошенко
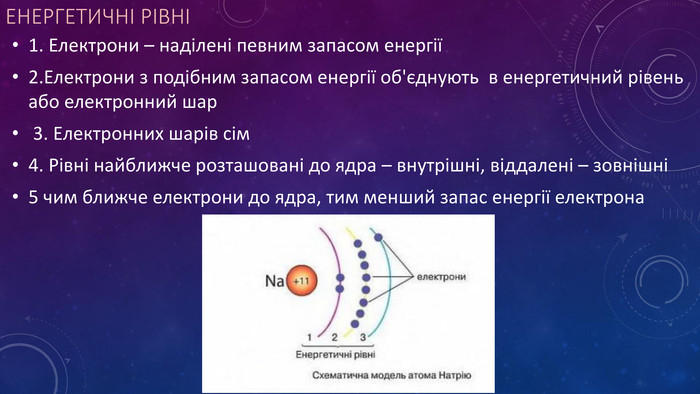
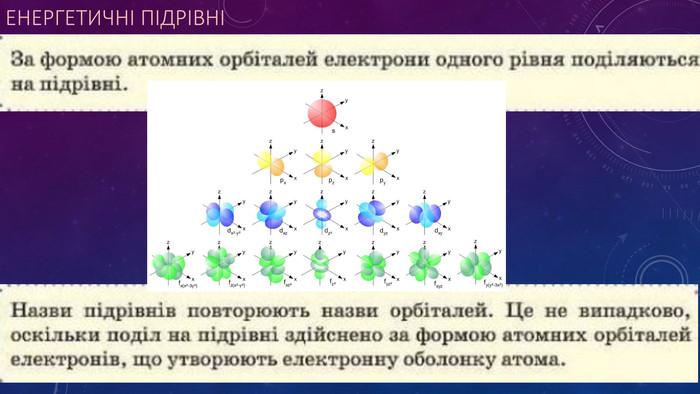
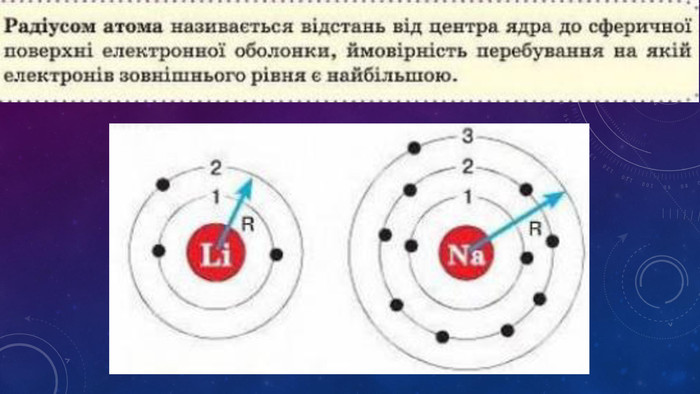
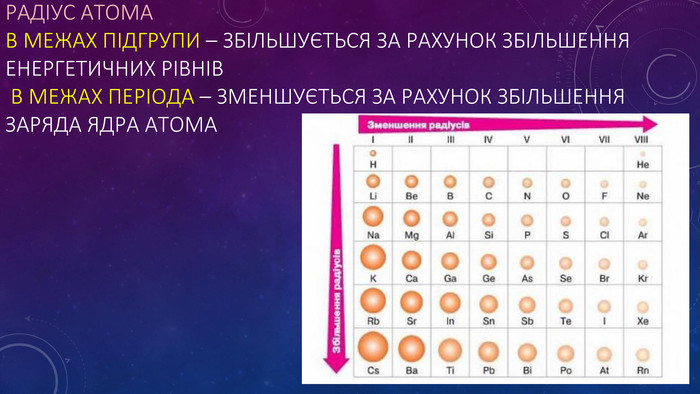
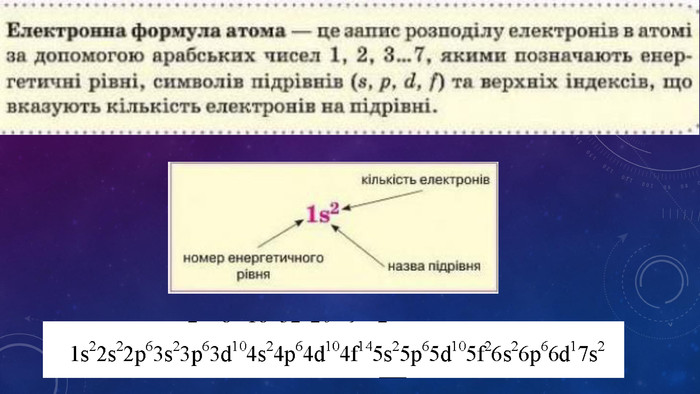
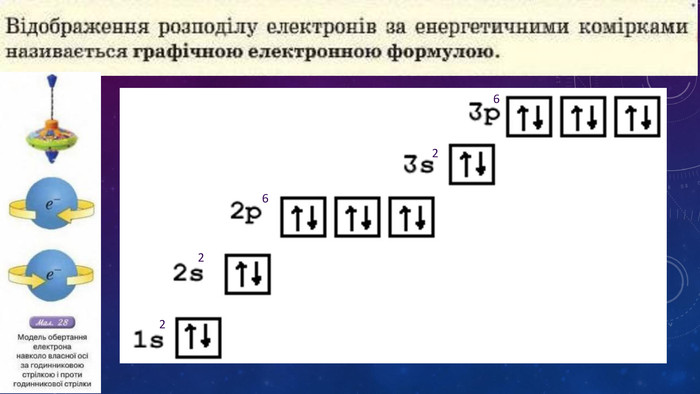
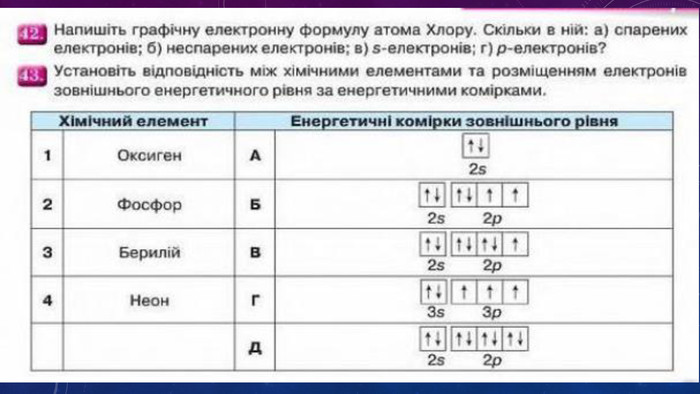
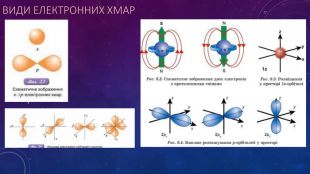
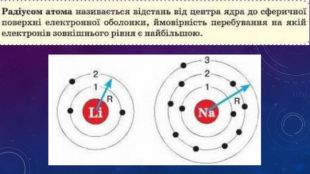
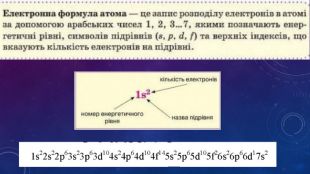
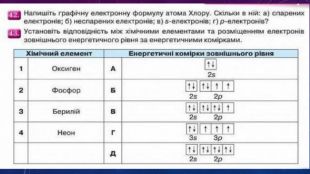
Стан електронів в атомі. Електронні орбіталі.Енергетичні рівні.Поняття про енергетичні підрівні.Радіус атома.Графічні та електронні формули атомів хімічних елементів №1-20
Зверніть увагу 3 слайд містить помилку, замість атом, потрібно читати електрон
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Атом - хвиля?
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку