Інтегрований проект «Вода це наше життя!»

















































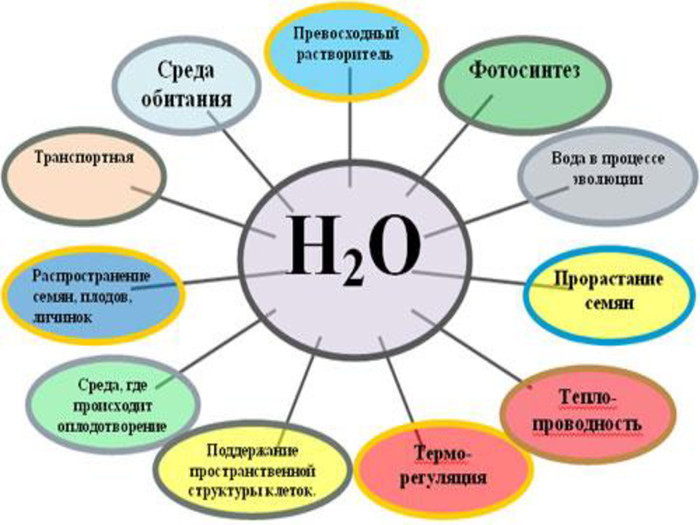


Дидактична мета проекта Формування цілісного погляду на роль води на планеті Формування дослідницької та експериментальної роботи Розвиток навичок работи в групі Методичні задачі проекта Вдосконалити навички пошука інформації з різних джерел Навчити проводити експерименти з вивчення хімічних та фізичних властивостей води, розчинності речовини у воді Навчити встановлювати взаємозв’язок між будовою, властивостями та біологічною роллю води в клітині Продовжувати розвивати навички обробки інформації
Етапи проекта Формулювання тем дослідження учнів Формування груп для проведення досліджень, висування гіпотез розв’язання проблем Вибір творчої назви проекта Обговорення плану роботи учнів індивідуально або в групі Обговорення можливих джерел інформації Самостійна робота груп з виконання завдань Підготовка учнями презентацій, публікацій з звітами про зроблену роботу Захист отриманных результатів та висновків
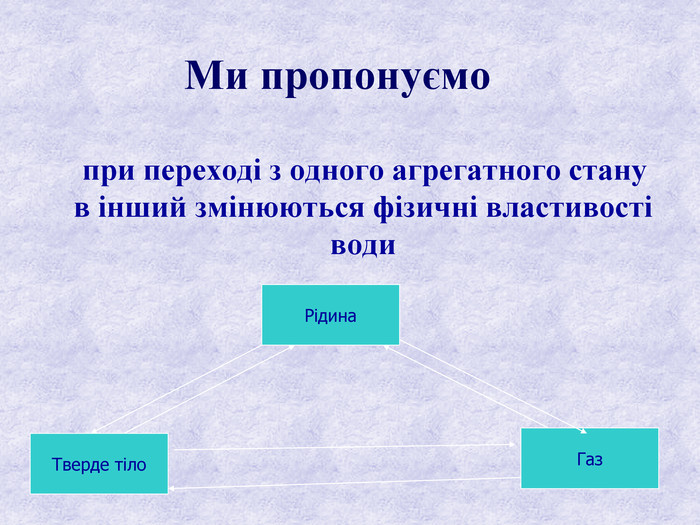
Для того щоб вивчити перехід води з твердого стану в рідкий ми зробили дослід з нагрівання льоду на спиртівці та за результатами досліду побудували графік . Нагрівання льоду відбувається з підвищенням температури. Плавлення при постійній температурі (температура плавлення – 0 С) . Тільки після того, як весь лід ростанув температура води починає підніматися. Результати досліджень С А В Д АВ- нагрівання льоду. ВС- плавлення льоду. СД – нагрівання води t Графік залежності температури плавлення від часу.
Результати дослідження Охолодження води відбувається з зниженням температури. Тверднення ( кристалізація) відбувається за сталої температури – температура кристалізації- 0 С. Після того, як вся вода перетвориться у лід, температура льода почне знижуватися. А В С Д АВ- охолодження води. ВС – кристалізація льоду. СД – охолодження льоду. Для того ,щоб вивчити перехід води з рідкого стану в твердий ми зробили дослід з охолодження води та за результатами досліду побудували графік. Графік залежності температури кристалізації від часу
Результати дослідження Випаровування Відбувається з поверхні рідини. Швидкість випаровування залежить: Від температури води ( чим вище температура, тим більша швидкість випаровування) Від площі вільної поверхні Від наявності вітру над вільною поверхнею. Кипіння Відбувається по всьому об’єму рідини. Відбувається при постійній температурі ( 1000 С). Відбувається при появі бульбашок повітря. Вивчив відповідну літературу, ми визначили властивості випаровування та кипіння води
Висновки: Перехід води з твердого стану в рідкий відбувається при підвищенні температури, лід плавиться за постійної температури- 00 С, відбувається поглинання енергії. Обернений процес відбувається при зниженні температури, вода твердне при 0 С, відбувається виділення енергії. Перехід води з рідкого стану в газоподібний відбувається двома способами: випаровування і кипіння ( процес випаровування залежить від температури та площі поверхні)
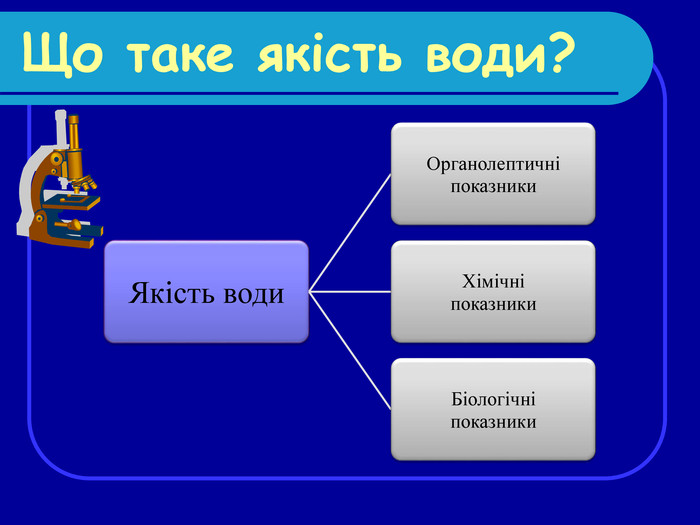
Завдання: Розглянути зовнішні, хімічні і біологічні показники якості води. Оцінити якіть води, яку використовують мешканці м.Кіровограда для харчових, побутових і технічних цілей. Виявити способи очищення води. З’ясувати, який вплив здійснює якість води на здоров’я людини . Дати рекомендації щодо покращення якості води.
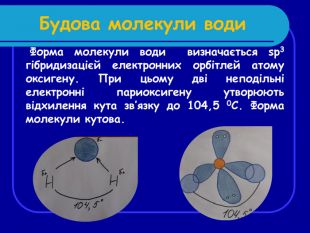
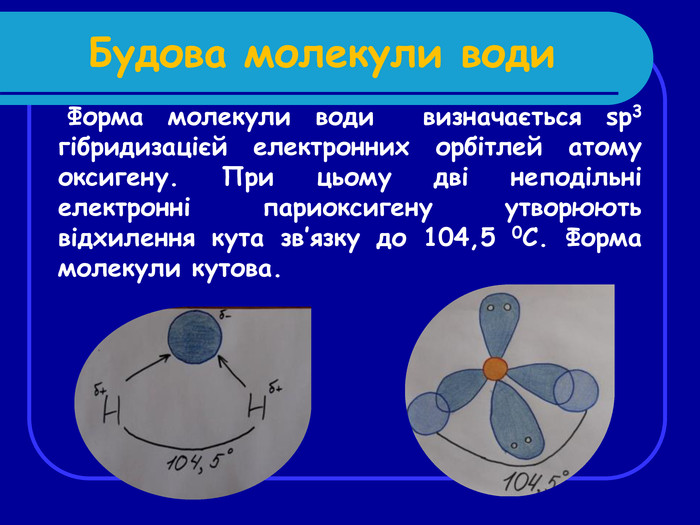
Водневі зв’язки між молекулами води Оскільки атоми в молекулі лежать не на одній лінії, то протилежні заряди не гасять один одного і молекула води стає диполем. Між атомами сильно електронегативного елементу і електропозитивними атомами водню утворюються слабкі водневі зв'язки. Вони роблять значний вплив на фізичні властивості води, підвищуючи її температури плавлення і кипіння, в результаті вода є рідиною(н.у.)
Доказ гідратації речовин Вода вступає в хімічну реакцію з розчинними в ній речовинами. Цей процес називають гідратацією. Доказом служать теплові явища при змішуванні речовин з водою. Початкова температура води 20 С. При додаванні навіть розбавленої сірчаної кислоти спостерігається значне виділення теплоти, вода нагрівається до 30 С.
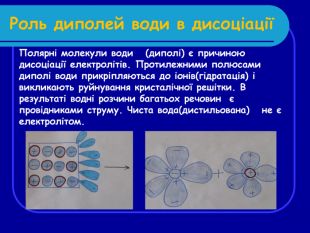
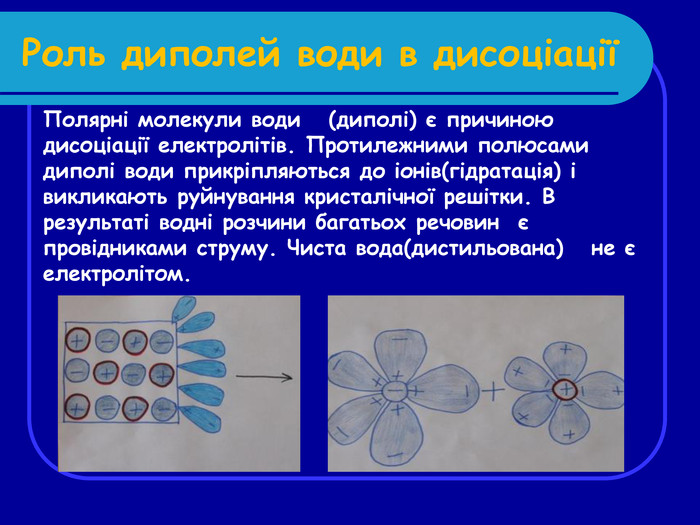
Роль диполей води в дисоціації Полярні молекули води (диполі) є причиною дисоціації електролітів. Протилежними полюсами диполі води прикріпляються до іонів(гідратація) і викликають руйнування кристалічної решітки. В результаті водні розчини багатьох речовин є провідниками струму. Чиста вода(дистильована) не є електролітом.
Висновки: Вода - складна речовина молекулярної будови. Форма молекули кутова. Молекула води є диполем, оскільки сильно поляризована. У молекулах води зв'язок ковалентний полярний, а між молекулами - воднева. Вода має особливі фізичні властивості, визначувані особливостями її будови (підвищені температури плавлення і кипіння, поверхневе натягнення, висока теплоємність, зменшення щільності при замерзанні
Визначення запаху води Аналіз проводили при кімнатній температурі і при нагріванні води до 50-60 0С 100 мл кожної води заливали в колбу, закривали пробкою і струшували 5-10 секунд. Потім виймали пробку і визначали запах за допомогою нюху. Інтенсивність запаху визначали за шкалою(1-5 балів).
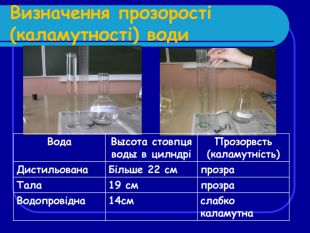
Результати визначення запаху Запахи діляться на природні(наприклад запах грунту в талій воді) і штучні(запах металевих труб у водопровідній воді). Вода Характер запаху Інтенсивність запаху Дистильвана Запах відсутній 0б -відсутність запаху Водопровідна Металічний запах 2б - Запах слабкийщо не привертає уваги Тала Прілий запах 2б - Запах слабкийщо не привертає уваги
Визначення густини води Визначення густини води проводили лабораторним аерометром. Результати вимірів отримали приблизно однакові(1000 кг/м3 або 1г/см3). Вміст солей в талій і водопровідній воді незначний, тому різниця у величині густини не помітна(чи для її визначення потрібний точніший прилад). Аерометр Водопровідна вода Дистильоваеа Тала вода
Визначення значення рН води Для визначення рН води використали як універсальний індикаторний папір(верхній малюнок), так і лакмусову різного кольору. Колір лакмусу не змінився, що говорить про нейтральне середовище. А універсальний індикатор показує слабокисле середовище. Відхилення від норми незначне.
Визначення хлоридів у воді Для виявлення іонів хлору в пробірки відбирали по 5 мл води і додають 3 краплі 10%-го розчину нітрату срібла, що підкисляє азотною кислотою. Зміст хлоридів визначали візуально по помутнінню або появі осаду хлориду срібла білого кольору. Cl - + Ag+ = AgCl Зліва направо: водопровідна, дистильована, тала вода. Невелике помутніння вказує на наявність солей хлору(1-10 мг/л ) в природній воді. Дистильована вода не містить домішок.
Визначення іонів марганцю у воді У кожну пробу води додали рожевий розчин перманганату калію. Порівняли зміни, що відбуваються через деякий час. Розчинені у воді з'єднання марганцю окислюється з утворенням малорозчинного оксиду марганцю(осад бурого кольору) згідно з наступним рівнянням: 3 Mn2+ + 2 KMnO4 + 2 H2O = 5 MnO2↓ + 4 H+ Результати досвіду через 10 і 60 хвилин. Підвищений вміст іонів марганцю у водопровідній(ліва пробірка) і наявність цих іонів в талій(права пробірка) воді.
Визначення заліза в воді До 5 мл води додали 1-2 краплі концентрованої соляної кислоти і 5 крапель 10%-ного розчину роданіду калію. У присутності іонів тривалентного заліза утворюється роданід заліза(III) червоного кольору. Ледве помітне рожеве фарбування в лівій пробірці(водопровідна вода 0,4-0,95 мг/л), червона пляма в правій пробірці(тала вода 1-3 мг/л). Дистильована вода не містить розчинних солей.
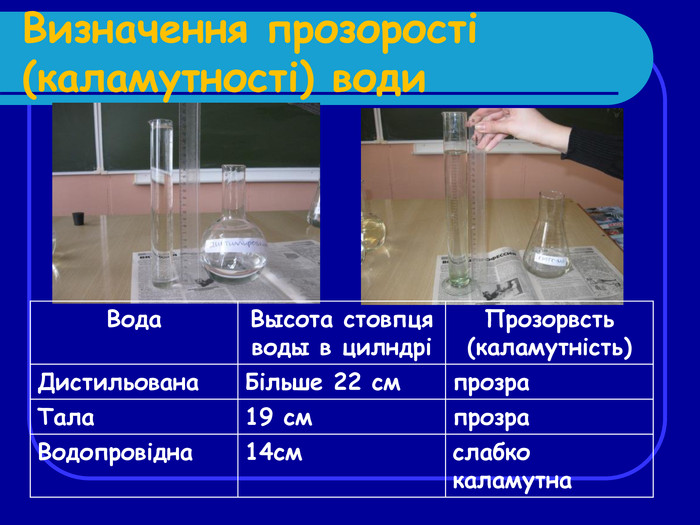
Результати дослідження Дистильована вода безбарвна, прозора, не має запаху. Вона не містить розчинених солей. Природні води різних джерел можуть відрізнятися прозорістю, запахом, значенням рН, оскільки містять різну кількість розчинених солей. Ці солі надають їм різне забарвлення. У досліджуваній водопровідній воді виявлена наявність іонів хлору, марганцю і заліза в допустимих, але помітних кількостях. Тала вода, отримана з тільки що випавшого снігу, виявилася чистою і прозорою. Але в ній теж є присутніми хлориди, з'єднання марганцю і значна кількість з'єднань заліза(III).
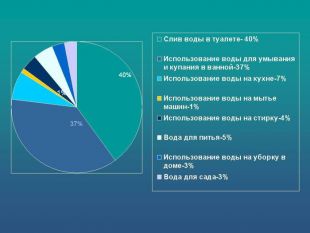
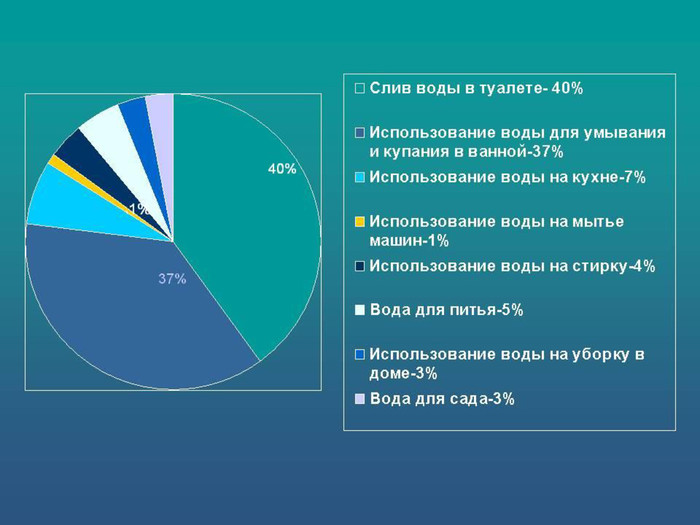
Вода в організмі. Наш організм на 70% складається з води. Вода входить до структури кожної клітини, приймає участь в усих хімічних, фізіологічних процесах в організмі.Обмін речовин без води неможливий. В рідкому іодному середовищі відбуваються процеси травлення і засвоєння їжі; синтез живої речовини в клітинах організму.Втрата людиною 10% - 20% води може привести до смерті. Зневодження організму страшніше ніж відмова від їжі.Кількість води, яку споживає людина залежить від виду їжі, кількості в ній солей. Людина повинні споживати 2,5 – 4 літра за добу. Також потрібно очищувати воду. Забруднена вода може викликати холеру, дизентерію, брюшний тиф, паратиф. За 70 років життя людина з’їдає і випиває більше 50 тон води!!!!
Вода в крові. Кров – це рідке середовище організму. У дорослої людини близько 5 літрів крові. Більшу частину якої являє вобою рідка міжклітинна речовина – плазма. Плазма складається з води, в якій розчинні органічне і неорганічні речовини.Води в плазмі близько 90%, інші 10% - це білки, жири, глюкоза, мінеральні солі та інші речовини. Зміна складу плазми шкідливо впливає на організм. Надлишок речовин виводиться з плазми через органи виділення.
Вода в лімфатичній системі. Лімфатична система відіграє велику роль в імунній системі і є бар’єром для мікробів і інших шкідливих речовин. Все затримується в лімфатичних вузлах. Дренажна функція лімфатичної системи здійснюється через всмоктування з тканин води і розчинних в ній білків, продуктів розпаду клітин, бактерій і т.д. Об’єм утвореної лімфи залежить від кількості води в міжклітинній речовині. Загальна кількість білку яке надходть з лімфи в кров приблизно 100 г на добу.Загальна кільсть лімфи, яка циркулює по лімфатичним судинам приблизно 4 літри за добу.
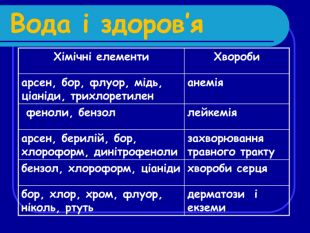
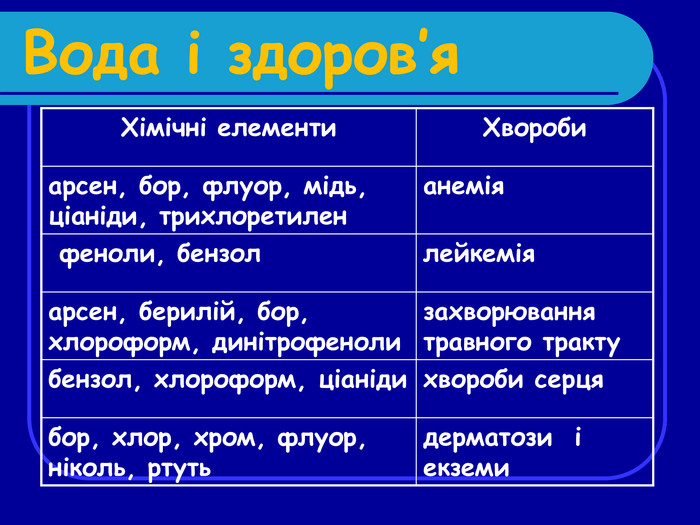
Вода і здоров’я Хімічні елементи Хвороби арсен, бор, флуор, мідь, ціаніди, трихлоретилен анемія феноли, бензол лейкемія арсен, берилій, бор, хлороформ, динітрофеноли захворювання травного тракту бензол, хлороформ, ціаніди хвороби серця бор, хлор, хром, флуор, ніколь, ртуть дерматози і екземи
Вода в живих організмах Організм дорослої людини перебуває в середньому на 65 % з води. З віком її кількість води в організмі людини зменшується. Зародок людини містить 97 % вод організм новонароджених - 77 %, до 50 років кількість води в організмі складає лише 60 %. Основна маса води(70 %) зосереджена усередині клітини а 30 % - це позаклітинна вода.
ФІЗІОЛОГІЧНЕ ЗНАЧЕННЯ ВОДИ Усі біохімічні реакції пов'язані з процесами травлення і засвоєння поживних речовин, протікають у водному середовищі. Разом з солями вода бере участь в підтримці найважливішої фізіологічної константи організму - величини осмотичного тиску. За рахунок малої в'язкості, а також здатності розчиняти різні хімічні речовини і вступати з ними в не міцні зв'язки вода є основною частиною крові і грає роль транспортного засобу. Вода є основою кислотно-лужної рівноваги в організмі, оскільки проявляє властивості як кислот, так і основ. Усі процеси засвоєння і виділення в організмі також протікають у водному середовищі.
«Вода, у тебя нет ни света, ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни: ты – сама жизнь. Ты наполняешь нас радостью, которую не объяснишь нашими чувствами. С тобою возвращаются к нам силы, с которыми мы уже простились». А. Сент-Экзюпери


про публікацію авторської розробки
Додати розробку