Інтегрований урок з фізики та хімії на тему "Закон електролізу. Лабораторна робота "Дослідження явища електролізу. Застосування електролізу"
Інтегрований урок з фізики та хімії на тему "Закон електролізу. Лабораторна робота "Дослідження явища електролізу". Застосування електролізу" проводиться в 10 класі для дітей з порушеннями слуху з метою удосконалення знань учнів про електроліти, експериментального підтвердження існування електричного струму в електролітах, формування знань про носії електричного струму в електролітах, вивчення законів електролізу, та застосування електролізу на практиці
Комунальний заклад «Черкаський навчально-реабілітаційний центр
«Країна добра Черкаської обласної ради»
Інтегрований урок
з фізики та хімії у 10 класі
Закон електролізу.
Лабораторна робота №9 «Дослідження явища електролізу»
Решетнікова В.А, вчитель фізики, спеціаліст вищої категорії
Антоненко О.М., вчитель хімії, спеціаліст І категорії
Мета уроку: Формувати ключові компетентності:
Вміння вчитися: організовувати своє робоче місце, виконувати логічні послідовні дії
Комунікативні: уміння сприймати, розуміти і аналізувати матеріал, передавати інформацію, користуватися хімічною та фізичною термінологією, висловлювати і відстоювати свою думку та контролювати відповіді товаришів, вести діалог, поповнювати словниковий запас, удосконалювати вміння учнів розуміти артикуляцію вчителя, коригувати вимову
Здоровязбережувальні: створювати позитивний настрій на уроці, виховувати культурно-гігієнічні навички, відповідальне ставлення до свого здоров’я, бажання бути здоровим
Фінансова грамотність:розвивати лідерські ініціативи, забезпечити розуміння практичних аспектів фінансових питань щодо добування алюмінію, застосовувати знання для ініціатив щодо вирішення питань, пов’язаних з енергетичними ресурсами, вміння аналізувати економічну ситуацію, показати економічну доцільність в добуванні металів за допомогою електролізу.
Формувати предметні компетентності: узагальнити знання учнів про електроліти, експериментально підтвердити існування електричного струму в електролітах, формувати знання про носії електричного струму в електролітах, пояснити закони електролізу, ввести поняття електрохімічного еквіваленту речовини, вчити визначати залежність між величинами, робити відповідні висновки; вчити користуватися таблицею для визначення електрохімічного еквівалента речовини, вчити розв’язувати задачі на обчислення маси виділеної на електроді речовини, виховувати почуття взаємодопомоги та відповідальності, самостійності та дисциплінованості, розвивати мислення, спостережливість та увагу, виховувати інтерес до природничо-наукових знань, продовжувати знайомити учнів з біографіями видатних вчених, показати взаємозв’язок між природничими предметами.
Тип уроку: комбінований
Обладнання: цифрова візуальна лабораторія «Ейнштейн», віртуальна фізична лабораторія 10-11 клас, презентація, набір карточок (для оцінювання)
Міжпредметні зв’язки: фізика, хімія, математика
Словник: катод, анод, електроліт, електроліз, електролітична дисоціація, катіон, аніон, електрохімічний еквівалент
Хід уроку.
Чим більше у мене справ, тим більше я навчаюсь.
М. Фарадей
І. Організаційний момент.
Вчитель хімії. Добрий день! Сідайте. Все готово до уроку? Апарати у вас є? Вони працюють? Хто черговий? Хто відсутній? (учні відповідають на питання вчителя)
ІІ Психологічний настрій. Вчитель пропонує набір смайлів з різними емоціями. Учні обирають ті, які підходять для їхнього емоційного стану на початок уроку. (Слайд 2)


ІІІ. Актуалізація опорних знань. Розмовна хвилина. Вчитель під час проведення розмовної хвилинки використовує екран для слабочуючих дітей-вони повинні сприймати питання на слух. Глухі учні зчитують питання з губ вчителя.
- Який зараз урок? Урок фізики та хімії.
- Що таке електролітична дисоціація? Електролітична дисоціація- це розпад речовин під впливом полярних молекул розчинника або в розплаві на вільно рухливі йони.
- Що таке електроліти? Електроліти – це речовини,водні розчини чи розплави яких проводять електричний струм.
- Що таке неелектроліти? Неелектроліти – це речовини,водні розчини чи розплави яких не проводять електричний струм.
- Хто придумав класифікувати речовини на електроліти та неелектроліти? Майкл Фарадей.
- Який заряд має катіон? Катіон має заряд «+».
- Який заряд має аніон? Аніон має заряд «-».
Вчитель фізики. Ви вже зрозуміли, що сьогоднішній урок не звичайний. Це урок, який доведе вам, що фізика і хімія – науки, які вивчають одні і ті ж явища, використовують одні і ті ж терміни, тільки пояснюють їх з позицій своїх завдань. На уроці ви будете отримувати бали за правильні відповіді, а в кінці уроку бали переведуться у оцінку. Давайте пригадаємо терміни, якими ми будемо користуватися на уроці.
Інтерактивна вправа «Дешифровщик». Вчитель пояснює, що слова з хаотично розміщеними буквами потрібно скласти в правильні терміни, а учні повинні розгадати ці слова: ролілектез (електроліз), літеролект (електроліт), соціадиція(дисоціація). За кожну правильну відповідь вчитель дає учням карточку (Слайд3) -3бали
Вправа «Відеоопитування». За малюнком потрібно назвати термін, яким можна назвати дане зображення. (Слайд 4) -10 балів. Зображення: Атом, молекула, анод, діелектрики, катод, дисоціація, ядро, орбіта, Архімед, джерело струму.
ІІІ. Мотивація навчальної діяльності. Вчитель фізики. Давайте прочитаємо епіграф до уроку. Як ви думаєте, що Фарадей хотів сказати? (Учні висловлюють свої припущення, вчитель аналізує та коментує) Всі закони і явища,які ми вивчаємо у фізиці та хімії мають практичне застосування. Сьогодні ми з’ясуємо теоретичну основу електролізу та розглянемо практичне застосування явища електролізу.
Вчитель хімії. Щоб переконатися, які речовини проводять і які не проводять електричний струм, ми з вами виконаємо досліди за допомогою цифрової візуальної лабораторії «Ейнштейн».
Дослід. Дослідження речовин та їхніх водних розчинів на електричну провідність.
Вчитель проводить досліди на визначення електричної провідності у різних речовинах:
сіль NaCl, водаH2O, розчин солі у воді.
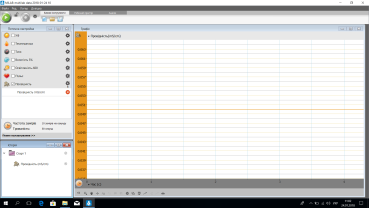
Графік електропровідності NaCl
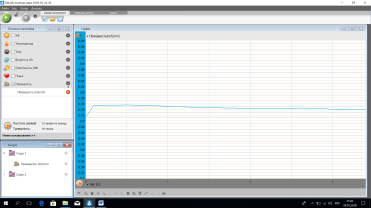
Графік електропровідності H2O
Графік електропровідності розчину солі у воді
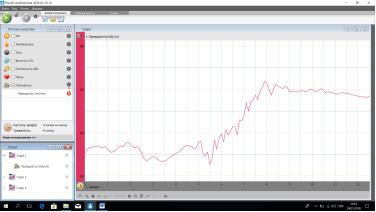
Учні спостерігають за дослідами. Аналізують відповідні графіки та роблять висновки, що сіль та вода не проводять електричний струм- вони є неелектролітами, а розчин солі у воді проводить електричний струм –це електроліт.
Вчитель хімії. Вивчення струму в електролітах привели англійського фізика Деві до відкриття ряду нових хімічних елементів: Натрію, Калію, Кальцію. Застосувавши електроліз води та лугу, Деві довів, що вода та луг не є простими речовинами, як вважали в той час.
- Повідомлення теми та мети уроку.
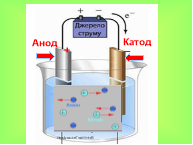
Вчитель фізики проводить фронтальну бесіду, використовуючи метод незакінченого речення. Учні уважно слухають та закінчують речення і за правильну відповідь отримують бали. До джерела струму приєднаємо два електроди. Електрод, приєднаний до позитивного полюса джерела називається … анод -1бал.
Електрод, приєднаний до негативного полюса називається.. катод -1бал.
Якщо через електроліт пропустити електричний струм, то ….(атом розпадається на катіони та аніони) -1бал.
Аніони рухаються до анода, віддають зайві електрони і стають нейтральними. Катіони рухаються до катода, отримують електрони, яких не вистачає, стають нейтральними і осідають на катоді. Йони можуть осідати на електрод або випадати в осад або виділятися в атмосферу. (Слайд 5). Кожний йон має масу і переносить певний заряд. Тобто, чим більше йонів осяде на електроді, тим більший перенесений заряд і тим більша буде маса електрода. (Слайд 6)
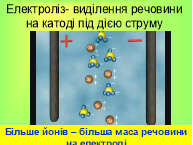

Сьогодні на уроці ми з вами навчимося визначати масу речовини, яка виділяється на електроді під час електролізу. Записуємо тему уроку, словник. (слайд7)
- Сприйняття та засвоєння нового матеріалу.
Наше завдання сьогодні – записати закон, який дозволить визначити масу речовини, яка виділяється на електроді під час електролізу. Треба з’ясувати від чого залежить маса виділеної речовини. Ми встановили, що маса буде залежати від кількості йонів на електроді. При якій умові осяде більше йонів? (час) -1бал. За більший проміжок часу осяде більше йонів. Ми це перевіримо під час виконання лабораторної роботи за допомогою віртуальної фізичної лабораторії.
Вчитель фізики проводить інструктаж з безпеки життєдіяльності під час роботи на комп’ютері:
- Сідати так, щоб екран знаходився на відстані 60см від очей;
- Зошит та підручник не повинен перешкоджати роботі комп’ютера;
- Працювати на клавіатурі чистими руками;
- Плавно натискати на клавіші;
- Не намагатися самостійно усувати неполадки;
- Не чіпати розєми кабелів, не торкатися до проводів живлення;
- Не класти предмети на обладнання комп’ютера;
- Не займатися сторонніми справами
Вчитель пояснює хід роботи. Учні слухають, аналізують та виконують роботу в зошитах для лабораторних робіт. (попередньо записані тема роботи, мета, обладнання та підготовлено таблиці для запису результатів дослідів)
В ролі електроліта у нас розчин сульфату міді (мідний купорос).Тобто на катоді буде осідати…..(мідь)-1бал. Будемо визначати масу електрода через 10 с, 20 с
|
Час, с |
Початкова маса катода, m0, г |
Маса катода після досліду, m1, г |
Маса виділеної речовини m=m1-m0, г |
|
10 |
28 |
29,97 |
1,97 |
|
20 |
28 |
32,12 |
4,12 |
Отже, чим більший час проходження струму, тим _______. Учні роблять висновок про залежність маси виділеної речовини від часу електролізу.
Від яких величин ще може залежати маса виділеної речовини? Від сили струму.
|
Час, с |
Сила струму, А |
Початкова маса катода, m0, г |
Маса катода після досліду, m1, г |
Маса виділеної речовини m=m1-m0, г |
|
10 |
2 |
28 |
29,43 |
1,43 |
|
10 |
4 |
28 |
29,52 |
1,52 |
Учні роблять висновок про залежність маси виділеної речовини від сили струму і пишуть висновок до лабораторної роботи.
Хвилина релаксації. Вправи для очей. (Слайд 10)
Евристична бесіда.
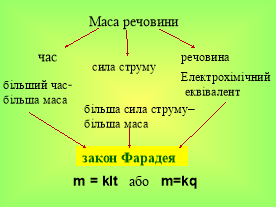
Вчитель фізики. А як ви думаєте, чи буде маса такою ж, якщо взяти інший електроліт? Чи однакова кількість йонів утворюється під час дисоціації у різних електролітах? (різна). Отже, маса речовини залежить від електроліта. Ми вже знаємо від яких величин залежить маса виділеної речовини. Залишилось записати закон електролізу.
Закон електролізу встановив М. Фарадей у 1834р., тому його називають законом Фарадея.
Давайте послухаємо розповідь про життя вченого. Слайди 11-13
Методичний коментар
Учні за бажанням отримали випереджувальне завдання і підготували презентацію про життя та відкриття Майкла Фарадея
Учень1. Фарадей народився в Лондоні у 1791році. Батько був коваль. Сім’я жила бідно, тому Майклові потрібно було працювати. З 12 років розносив газети, потім вчився переплітати книги. В школу не ходив, вчився сам, любив читати книги з хімії та електрики.
Учень2. Одного разу клієнт майстерні подарував йому подарували білет на лекції в академії, які читав відомий вчений Деві. Лекції були дуже цікавими і Фарадей попросив вченого взяти його на роботу в лабораторію. Вчений був вражений знаннями хлопця і запросив на роботу. Це і вирішило його долю - Фарадей став вченим.
Учениця. В 33 роки став директором Королівської лабораторії. Встановив багато законів з електрики і магнетизму. Дружив з такими вченими як Ампер,Вольт. Був почесним членом 72 товариств. Його називали королем експерименту. Він виконав близько 30 тисяч експериментів. Англійська королева подарувала йому будинок, в якому Фарадей і помер у віці 76 років. Портрет вченого зображений на 20 франковій купюрі.



Вчитель фізики пояснює закон електролізу. Учні слухають, запам'ятовують та аналізують матеріал. Вчений встановив залежність маси речовини, виділеної на електроді, від заряду, який пройшов через електроліт. Слайди 14-15
m = kIt або m=kq
m- маса речовини, кг, г, мг
k-електрохімічний еквівалент речовини, див в таблиці
I- сила струму, А ![]() I= m/kt, I= q/t
I= m/kt, I= q/t
t- час електролізу, с t=m/Ik
q- заряд, Кл q=m/k, q= It
Слайд 16. Відкрили ст.105 підручника. Дивимось таблицю значень електрохімічних еквівалентів. Знайдіть значення k для міді. Яка одиниця вимірювання k? -0,33 мг/Кл
Яка речовина має найбільший еквівалент? -срібло, 1,12 мг/Кл +1б
Яку масу нікелю можна добути з електроліта, якщо використати 1Кл електрики? -0,3мг
- Складання опорного конспекту. Осмислення об’єктивних зв’язків.
Вчитель разом з учнями складають ОК вивченого матеріалу.
Учні під керівництвом вчителя роблять аналіз задачі, роблять короткий запис, перетворення величин та розв’язують задачу
Слайд 17. Задача: 1.Яка маса нікелю виділиться на електроді електролітичної ванни за 2 хв при силі струму 2А?
Фізкультхвилинка. Кінезіологічні вправи.
Слайд 18. Вчитель фізики повідомляє про застосування електролізу у техніці та промисловості. Учні слухають розповідь. Гальванотехніка — галузь прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих, так і неметалевих виробів при проходженні постійного електричного струму через розчини їхніх солей.
Гальванотехніка ділиться на гальваностегію та гальванопластику.
За допомогою електролізу можна покрити металеві предмети шаром іншого металу. Цей процес називається гальваностегією.
Особливе технічне значення мають покриття важкоокисними металами, зокрема нікелювання й хромування, а також сріблення й золочення, що часто застосовуються для захисту металів від корозії.
За допомогою електролізу можна не тільки покрити предмети шаром того чи іншого металу, але й виготовити їхні рельєфні металеві копії (наприклад, монет, медалей). Такий процес називається гальванопластика. Розповідь супроводиться відеофрагментами


- Вчитель хімії. Зараз важко знайти галузь промисловості, де б не використовували алюміній або його сплави-від мікроелектроніки до важкої металургії. Алюміній –один з найпоширеніших і дешевих металів. Його називають металом 20століття. Він добре піддається обробці. А от у природі чистого алюмінію немає. І добувають його тільки за допомогою електролізу. Зараз наш починаючий вчений-хімік ознайомить вас з цим красивим металом.
Учень ( вчений-хімік) підготував повідомлення про добування алюмінію
Виступ учня. Завдяки хорошим фізичним властивостям алюміній займає лідируюче місце у електротехніці, авіабудуванні та приладобудуванні, у будівництві та в побуті, у фармацевтичній та харчовій промисловості, в ювелірних виробах та скловарінні. Алюміній входить до складу 250 мінералів. У природі є чистий оксид Al2O3 у вигляді кріоліту та корунду. Кристали корунду – це коштовні камені рубін і сапфір. Алюміній міцно зв'язаний у мінералах, тому його важко виділити. У 1855р.на Всесвітній виставці у Парижі вперше виставили чистий алюміній під назвою “срібло з глини”. Добувають алюміній електролізом розчину глинозему в розплаві кріоліту Na3AlF6, внаслідок чого на катоді виділявся металічний алюміній, а на аноді ‒ кисень. Ця технологія і тепер застосовується в усьому світі для одержання алюмінію. Процес електролізу проводять за температури близько 960°С, напруги 5-10 В та сили струму (10-20)104 А.


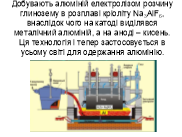
Вчитель фізики. Для виробництва 100 кг алюмінію потрібно : 192 кг глинозему, 6,5 кг криоліту, 60 кг анодної маси (графітова суміш) та 1,5-2,5 тис. кВт·год електрики.
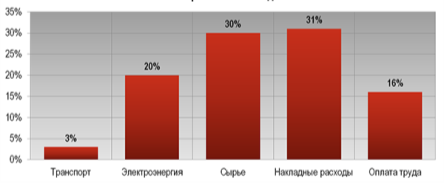 Отже, давайте розрахуємо витрати електроенергії для отримання 100кг алюмінію. Вартість електроенергії для підприємств становить 2,12грн/кВт·год. В середньому для добування алюмінію потрібно затратити 2тис.кВт·год електрики. 2,12·2000=4240грн. Це тільки вартість електроенергії. Погляньте на структуру собівартості алюмінію, яка складає 2100$/т
Отже, давайте розрахуємо витрати електроенергії для отримання 100кг алюмінію. Вартість електроенергії для підприємств становить 2,12грн/кВт·год. В середньому для добування алюмінію потрібно затратити 2тис.кВт·год електрики. 2,12·2000=4240грн. Це тільки вартість електроенергії. Погляньте на структуру собівартості алюмінію, яка складає 2100$/т
- Підсумок уроку.
- Хто відкрив закон електролізу?
- Від чого залежить маса виділеної речовини на катоді?
- Як зміниться маса речовини, якщо збільшити час проходження струму?
- Як зміниться маса речовини, якщо зменшити силу струму?
- В якому випадку маса речовини буде більшою якщо цинковий розчин замінити на срібний, якщо сила струму і час не зміниться?.
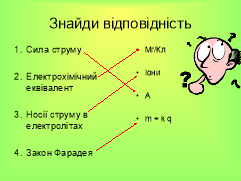
Встанови відповідність Слайд 20

- Картина психологічного настрою. Слайд 21
- Рефлексія. Слайд 22
- Оцінювання. 19-20б –10
17-18 – 9
15-16 -8
13-14 -7
11-12 – 6
9-10 -5
Домашнє завдання: вчити словник, ОК, читати § 25,26, завд.12 №1 ст.108
Використані джерела:
- Хімія: підручник для 9класу загальноосвітніх навчальних закладів/О.Г. Ярошенко.-К.:Освіта, 2009
- Фізика: підручник для 9класу загальноосвітніх навчальних закладів/М.І. Шут, М.Т. Мартинюк, Л.Ю. Благодаренко.-Ужгород.:Іва, 2009
- Інтернет-песурси:
http://dovidka.biz.ua/tsikavi-fakti-pro-alyuminiy


про публікацію авторської розробки
Додати розробку
