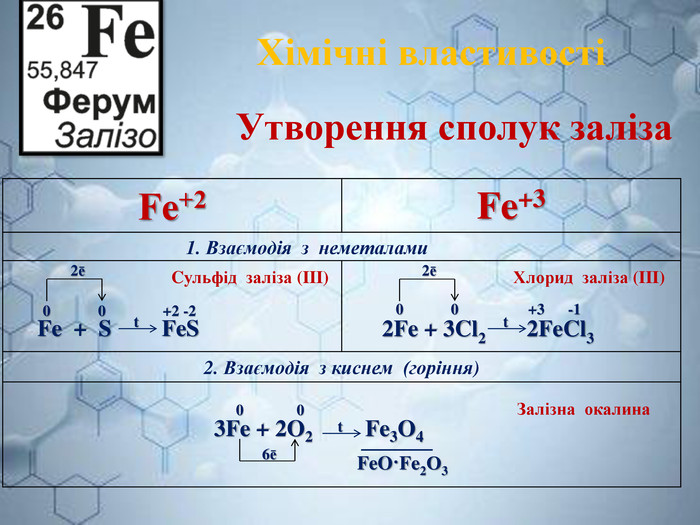
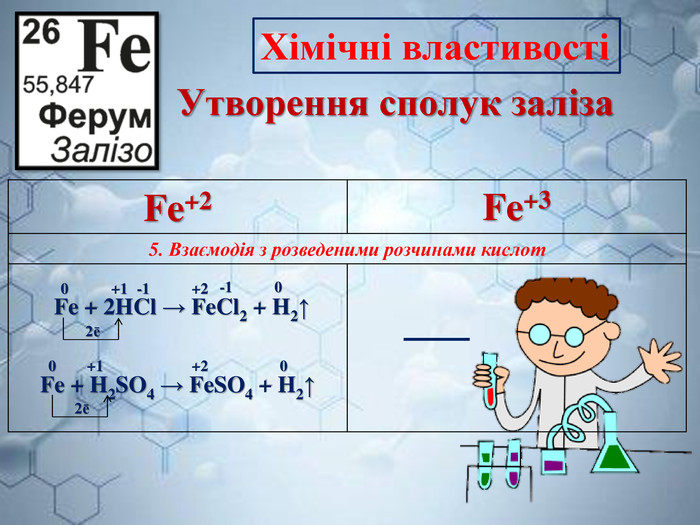
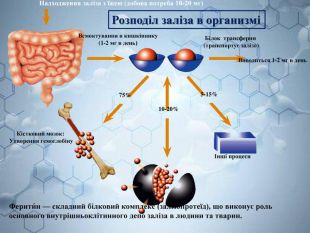
Інтерактивна навчальна презентація "Ферум як представник металічних елементів"
Про матеріал
Інтерактивна навчальна презентація "Ферум як представник металічних елементів" Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку