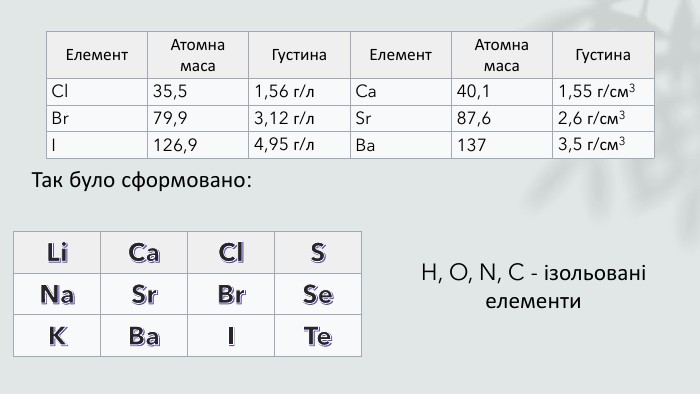
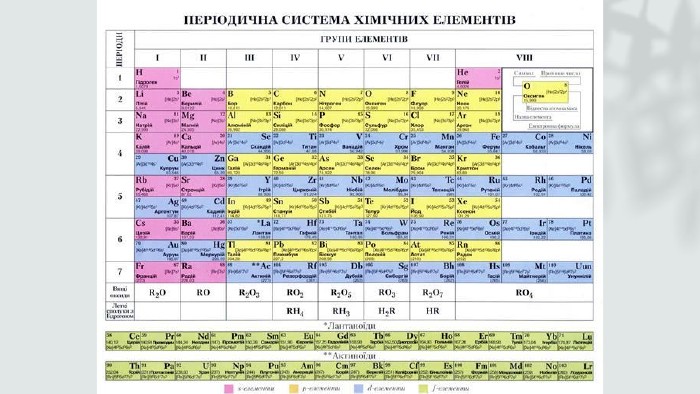
Історія періодичної системи. Вчені та поступове відкриття періодичної системи
Про матеріал
Історія періодичної системи. Вчені та поступове відкриття періодичної системи. Чи правда, що Д.І. Менделеєв був першовідкривачем періодичного закону? Ці та інші питання, які цікавлять весь світ в одній презентації. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку