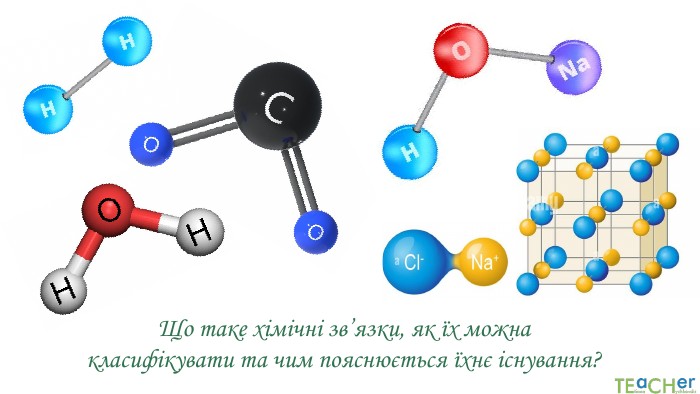
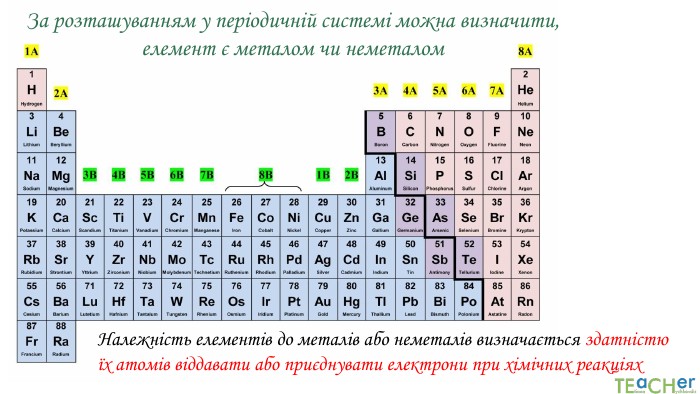
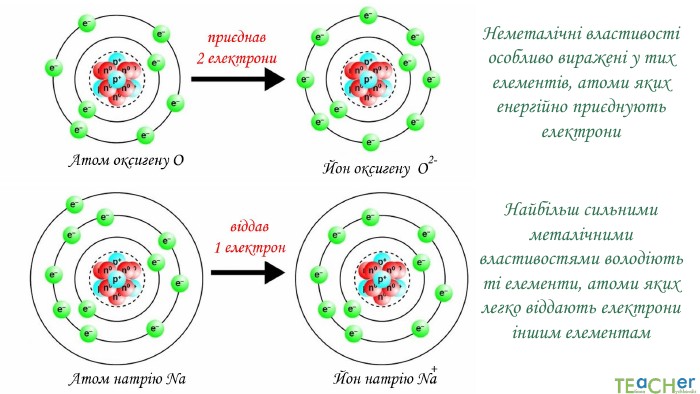
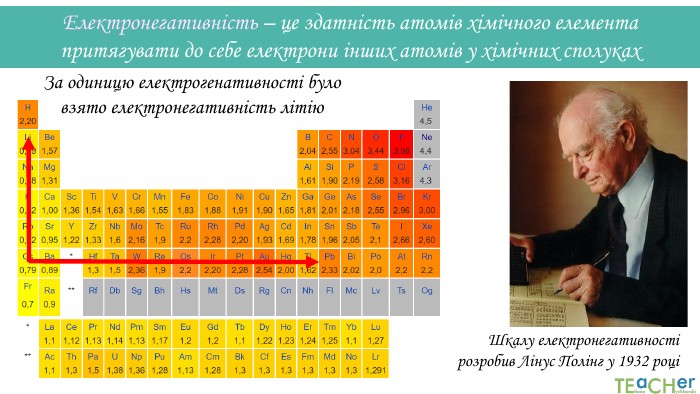
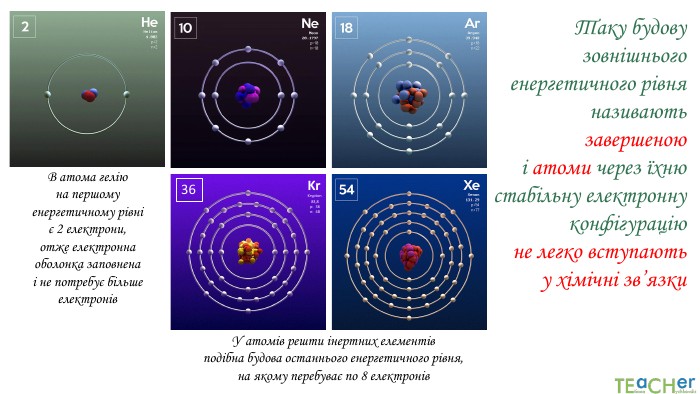
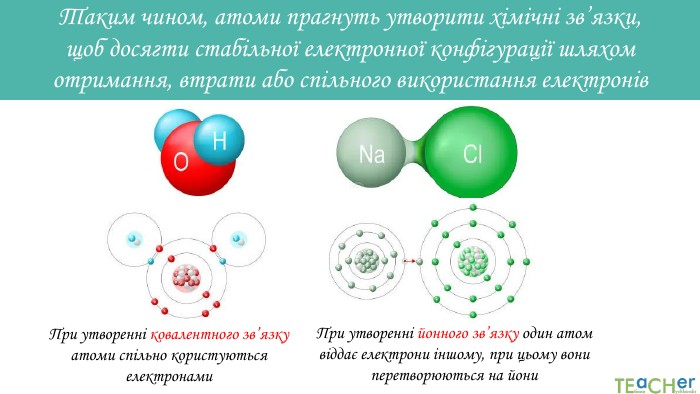
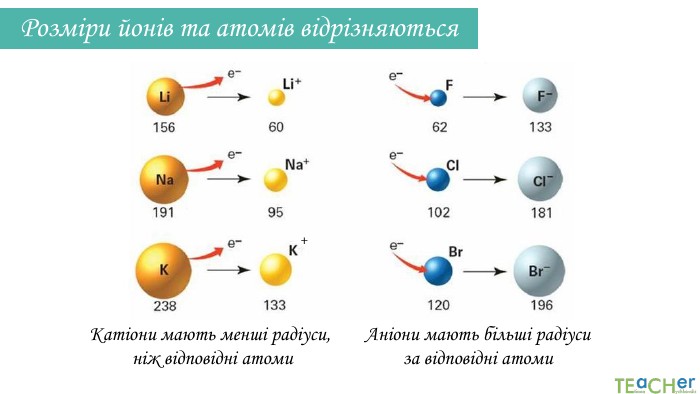
Презентація до уроку: "Природа хімічного зв'язку"
Про матеріал
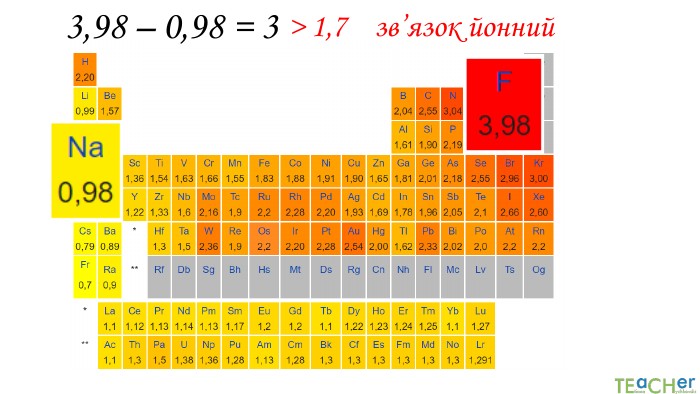
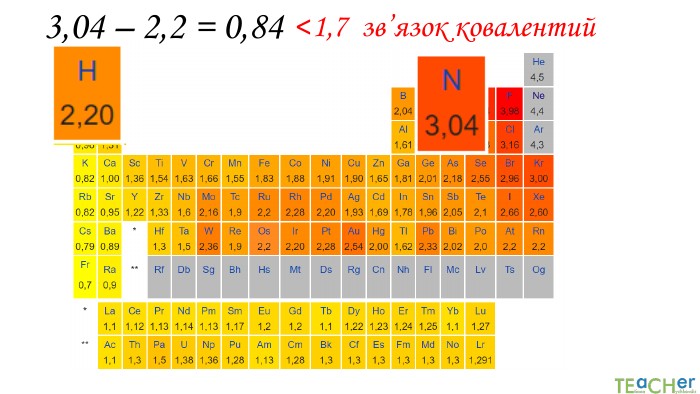
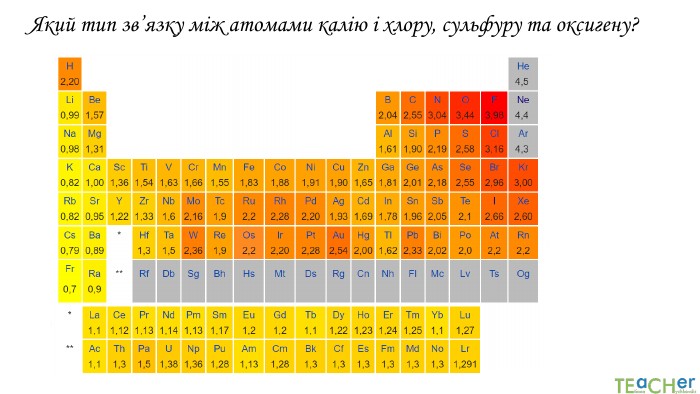
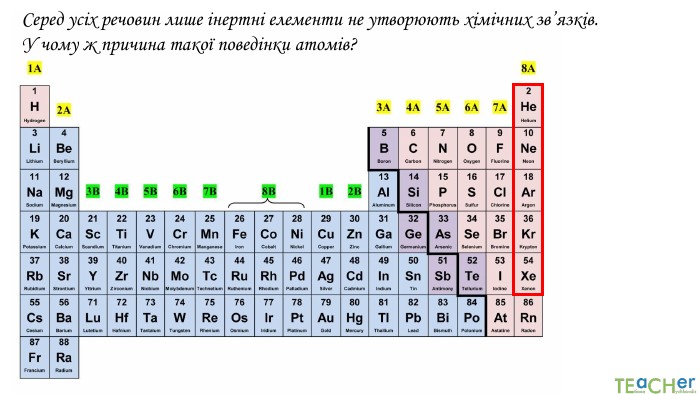
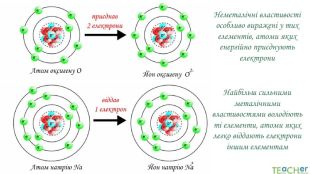
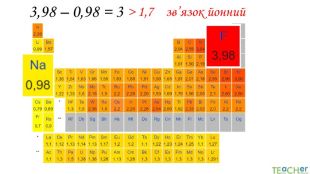
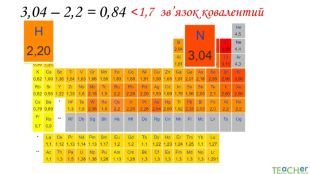
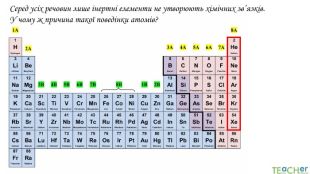
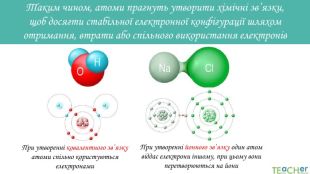
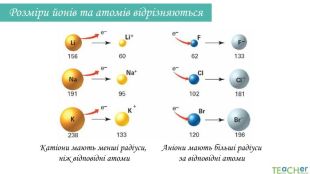
У презентації подано поняття електронегативності, що розкриває розуміння причини утворення хімічних зв'язків між атомами, поняття хімічного зв'язку. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Щиро дякую за методичну допомогу!
-
Дуже дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку