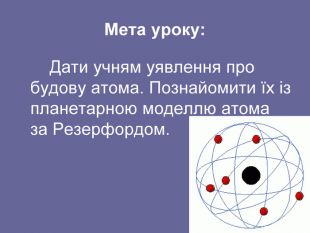
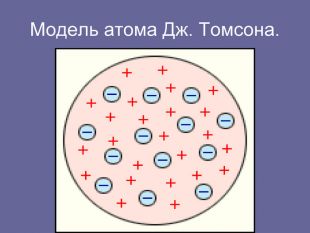
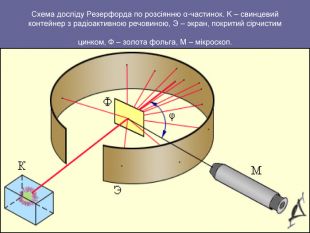
«Історія вивчення атома. Ядерна модель атома. Квантові постулати Н. Бора»
Про матеріал
Методична розробка уроку фізики 11 клас «Історія вивчення атома. Ядерна модель атома.
Квантові постулати Н. Бора»
Перегляд файлу


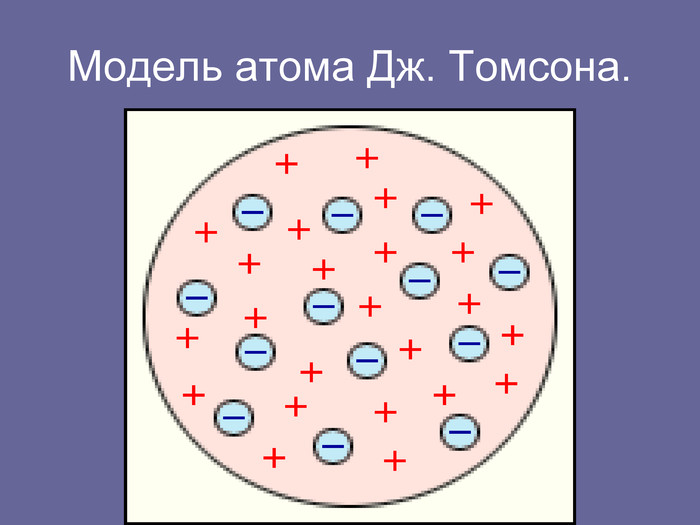

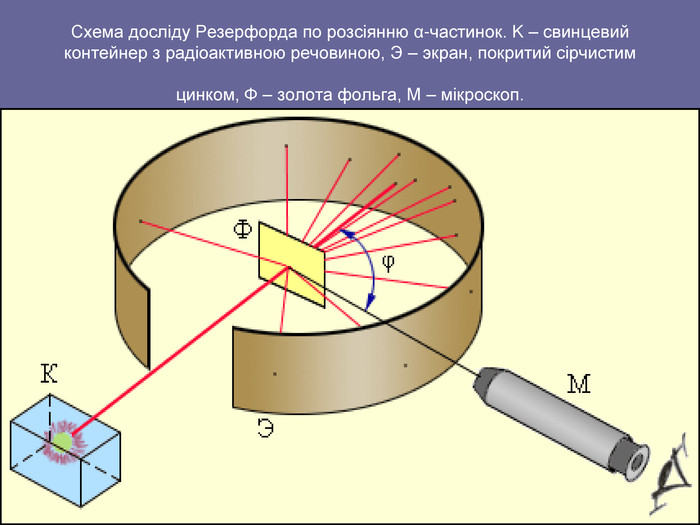
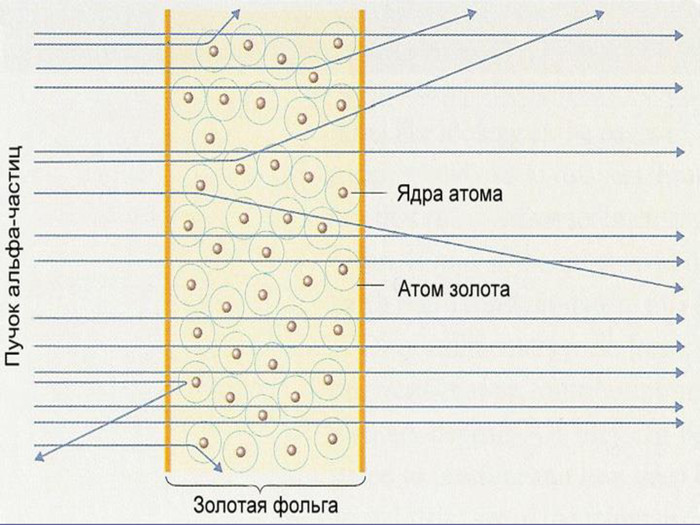
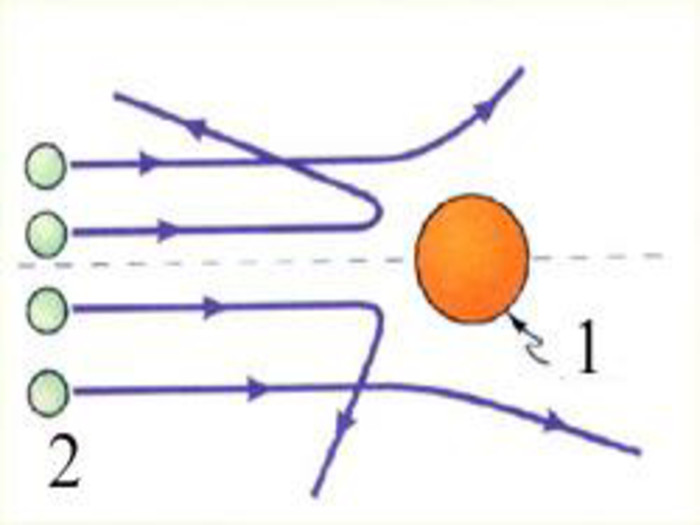



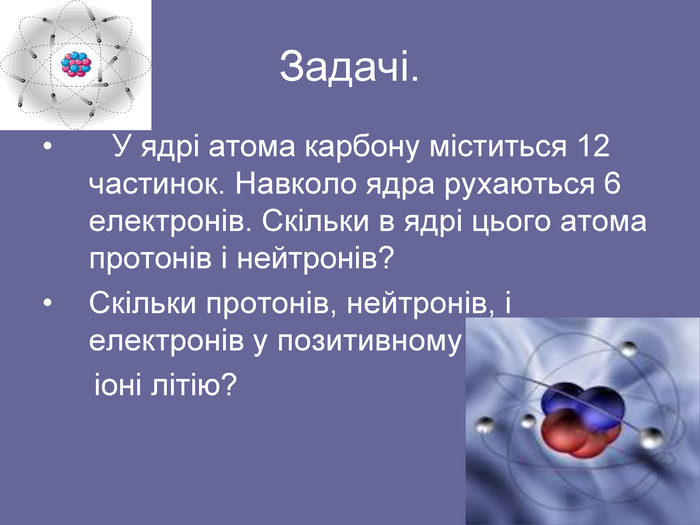

Зміст слайдів
Номер слайду 11
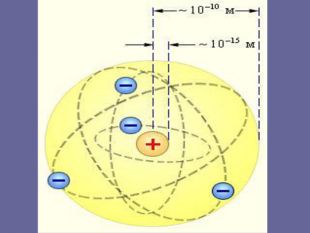
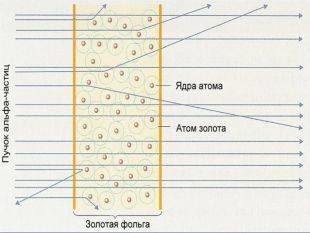
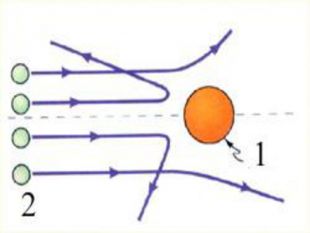
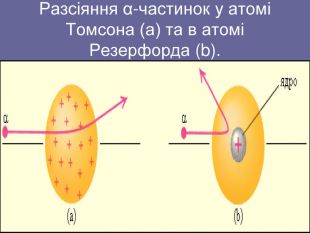
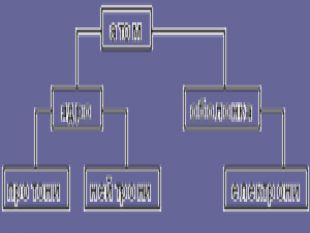
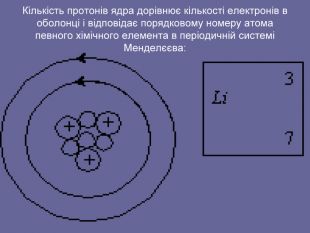
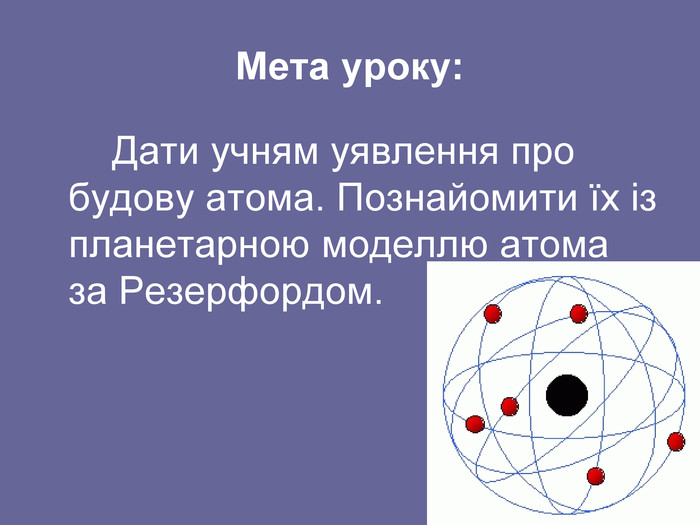
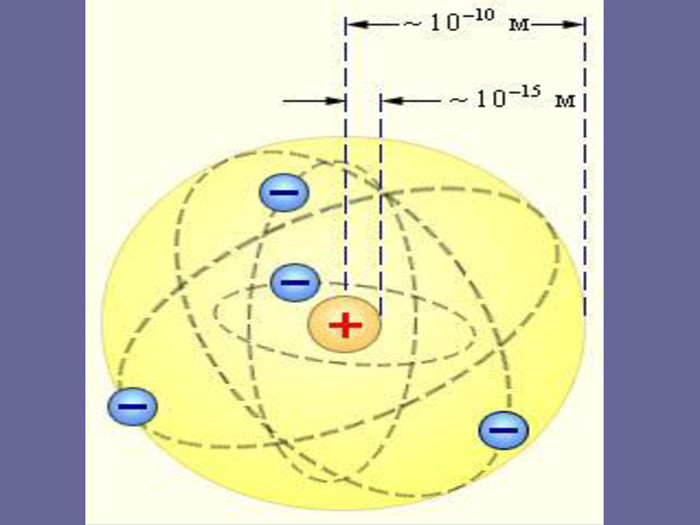
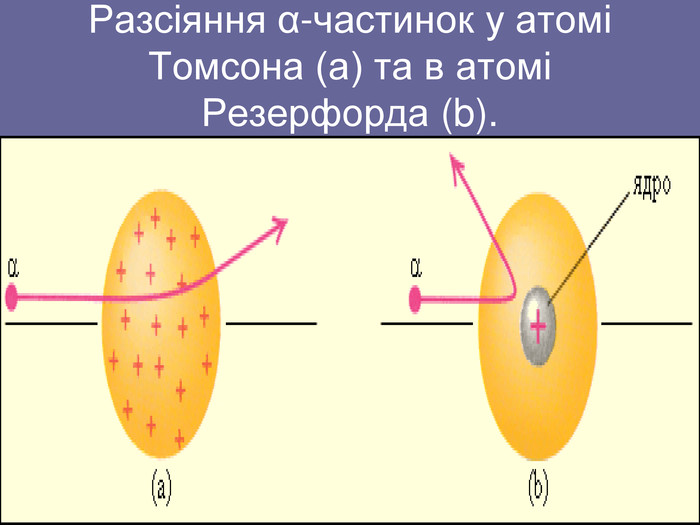
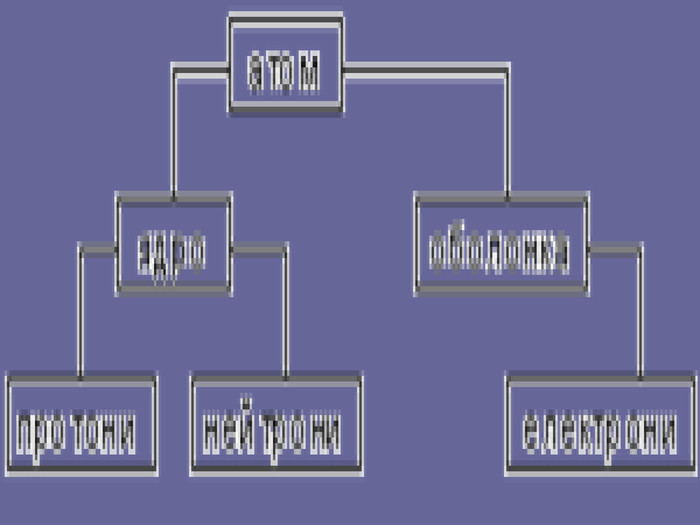
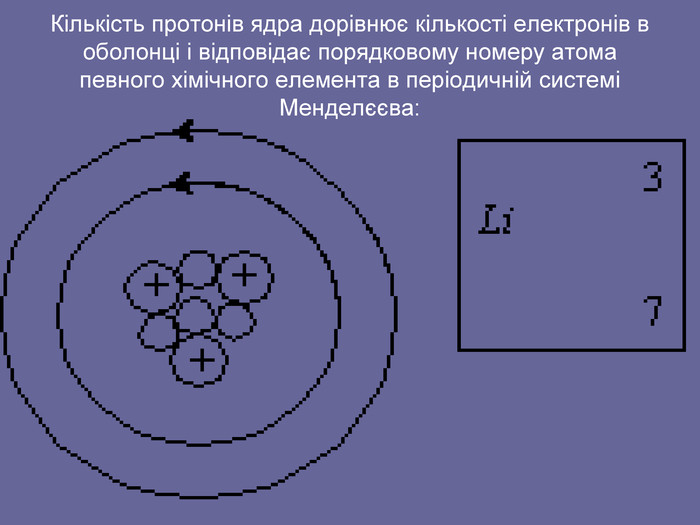
Ядерна («планетарна») модель атома: Атоми будь-якого елементи складаються з позитивно зарядженої частинки, що дістало назву ядра; До складу ядра входять позитивно заряджені частинки протони (пізніше було встановлено, що й нейтральні нейтрони); Навколо ядра рухаються електрони, що утворюють так звану електронну оболонку.
Номер слайду 16
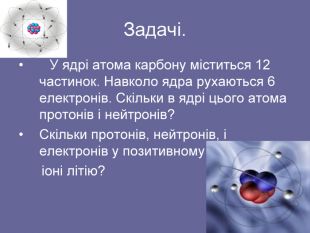
Підведення підсумків уроку. Чим відрізняються один від одного атоми різних хімічних елементів? Що є головною характеристикою певного хімічного елемента? Які частинки входять до складу ядра? Як утворюються позитивні і негативні іони? Чому маса атома Гідрогену незначно відрізняється від маси протона? Як відрізняються розміри атома Гідрогену від розмірів протона.
ppt
Додано
17 квітня 2020
Переглядів
1171
Оцінка розробки
Відгуки відсутні


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
Рекомендовані матеріали
Схожі матеріали