«Історія вивчення атома. Ядерна модель атома. Квантові постулати Н. Бора»
Методична розробка уроку фізики
«Історія вивчення атома.
Ядерна модель атома.
Квантові постулати Н. Бора»
Урок №
Мета уроку: дати учням уявлення про будову атома. Познайомити їх із планетарною моделлю атома за Резерфордом та пояснення квантовими постулатами Н. Бора труднощів планетарної моделі Резерфорда.
сформувати уявлення про будову атома, навчитись розглядати будову атомів у таблиці «Періодична система хімічних елементів Менделєєва», навчитись відрізняти один від одного атоми різних хімічних елементів.
виховувати вміння аналізувати, узагальнювати одержані знання, сприяти становленню особистості учня, його інтелектуальному і духовному розвитку, розвивати уяву, творче мислення; виховувати працелюбність та наполегливість.
Обладнання: презентація, підручники, таблиця «Періодична система хімічних елементів Менделєєва», картки –завдання.
Тип уроку: Урок вивчення нового матеріалу.
Базові поняття: атом, модель Томсона, планетарна модель атома модель, іон, постулати.
Структура уроку:
І. Організаційний етап
ІІ. Актуалізація опорних знань
ІІІ. Мотивація навчальної діяльності.
ІV. Вивчення нового матеріалу.
- Модель атома Томсона.
- Досліди Резерфорда.
- Ядерна модель атома Резерфорда.
- Постулати Н. Бора.
V. Узагальнення та систематизація знань
VІ. Домашнє завдання
VІІ. Підбиття підсумків уроку.
ХІД УРОКУ
І. Організаційний момент
ІІ. Актуалізація опорних знань
Від абстрактного мислення до наукового експерименту і від нього до практики – такий шлях розвитку науки.
Мирний атом 26 квітня 1986 р. з усією гостротою поставив питання про відповідальність учених, про такі поняття, як совість, людяність, про те, чи маємо ми право заради сьогоднішніх ілюзій ризикувати здоров'ям і життям майбутніх поколінь. Атом — головний об'єкт нашого уроку. Але, перш ніж перейти безпосередньо до вивчення теми, пригадаємо, що ж ми про знаємо про це поняття.
Фронтальне опитування — метод «Асоціативний кущ»

![]()
![]()
![]()
НЕЙТРАЛЬНИЙ ЕЛЕКТРОНИ
МАЛИЙ
ІV Вивчення нового матеріалу.
- Модель атома Томсона.
Вивчення атомного ядра невіддільне від вивчення елементарних частинок. Справа в тому, що в ядрах атомів частинок настільки мало, що властивості кожної з них не усереднюються, а відіграють важливу роль у формуванні властивостей ядра. Тому після відкриття електрона в науці виникла безліч теорій про будову атома.
До 1902 року було здійснено достатньо експериментів, які переконливо довели, що електрон є однією з основних складових частин будь-якої речовини.
Дж. Дж. Томсон показав на основі класичної електромагнітної теорії, що розміри електрона мають бути порядку 10 -15 м. Крім того, було відомо, що розміри атома становлять кілька ангстрем (1 ангстрем = 10 -10 м). На цій підставі Томсон 1903 року запропонував свою модель атома, відповідно до якої атоми являють собою однорідні кулі з позитивно зарядженої речовини, у
якій містяться електрони. Сумарний заряд електронів дорівнює позитивному зарядові атома. Тому атом у цілому електрично нейтральний.
Ця модель дістала назву «пудинг», оскільки електрони були вкраплені в позитивно заряджене середовище, немов ізюм в пудинг.
Відхилення електрона в атомі від положення рівноваги приводить до виникнення повертаючої сили. А отже, електрон, виведений яким-небудь способом із положення рівноваги, здійснює коливання й тому є джерелом електромагнітного випромінювання.
Модель атома здавалася привабливою з тієї точки зору, що передбачала наявність електронів в атомі. Однак вона проіснувала до 1911 року.
- Досліди Резерфорда. 1911році Е. Резерфорд запропонував своїм співробітникам експериментально перевірити переконливість моделі атома Томсона. Ідея досліду була проста. Якщо модель атома Томсона відповідає дійсності, то експериментатори, пропускаючи крізь дуже тонку металеву плівку вузькій пучок швидких α- частинок , не повинні виявити скільки-небудь помітного відхилення цих частинок.
Резерфорд установив, що кожна α-частинка потрапляючи на екран із сірчистого цинку, викликає спалах світла. Зазнавши розсіювання в золотій фользі, α-частинки вдарялися потім в екран і реєструвалися за допомогою мікроскопа.
Очікувалося, що пучок α-частинок під час проходження крізь тонку фольгу злегка розсіюється на невеликі кути. Це дійсно спостерігалося. Але несподівано з’ясувалося, що приблизно одна α-частинка з 20000, які падають на золоту фольгу завтовшки усього лише 4×10-5 см., повертається назад у бік джерела.
- Ядерна модель атома Резерфорда. Резерфордові знадобилося кілька років, щоб остаточно зрозуміти таке несподіване розсіювання α-частинок на великі кути. Він дійшов висновку, що позитивний заряд атома зосереджений у дуже малому об’ємі в центрі атома, а не розподілений по всьому атома, як у моделі Томсона.
Резерфорд запропонував ядерну («планетарну») модель атома:
- Атоми будь-якого елементи складаються з позитивно зарядженої частинки, що дістало назву ядра;
- До складу ядра входять позитивно заряджені частинки протони (пізніше було встановлено, що й нейтральні нейтрони);
- Навколо ядра рухаються електрони, що утворюють так звану електронну оболонку.
Поєднаємо знання фізики і хімії і з'ясуємо будову ядра атома:|
- Ядро складається з позитивно заряджених частинок(протонів— р) і нейтральних частинок (нейтронів— п).
- Порядковий номер в таблиці Менделєєва вказує на заряд ядра — кількість протонів та кількість електронів в атомі в нормальному стані.
- Нейтронів в атомі: N = А-Z.
Атом, який втратив (чи набув) один або кілька електронів, уже не буде нейтральним, а матиме позитивний (або негативний) заряд. Його називають позитивним (або негативним) іоном.
Попри всю переконливість планетарної моделі виникав цілий ряд нездоланних труднощів під час пояснення будови атома. Відповідно до класичної теорії, система, що складається з масивного позитивно зарядженого ядра й легких, негативно заряджених електронів, може бути стійкою тільки в тому випадку, коли електрони перебувають у русі. Таким чином, атом мав бути подібним до мініатюрної Сонячної системи, у якій роль Сонця відіграє ядро, а планет — електрон.
Аналогія була б досить повною (адже електричні й гравітаційні сили залежать від відстані, як 1/r2 ), якби не одне передбачення класичної теорії, відповідно до якого електричні заряди, що прискорено рухаються, повинні випромінювати енергію у вигляді електромагнітних хвиль. Тому електрони, рухаючись по «планетарних» орбітах, повинні були б під час випромінювання втрачати енергію руху й у результаті швидко наближатися до ядра. Розрахунки показували, що електрон в атомі Гідрогену має випромінювати всю свою енергію за малу частку секунди. Однак в атомі цього не відбувається.
З іншого боку, якби електрони рухалися навколо ядра подібно до планет навколо Сонця, то кожний атом був би єдиним у своєму роді, тому що, відповідно докласичної механіки, кожний електрон міг би рухатися за кожною з нескінченної кількості орбіт. І тому мала б спостерігатися нескінченна розмаїтість атомів того самого хімічного елемента.
Таким чином, в «атомних масштабах» суперечить досвіду не тільки класична електродинаміка, але й класична механіка —основа основ всієї класичної фізики.
- Постулати Н. Бора. Данський фізик Нільс Бор доповнив планетарну модель атома положеннями, які мали усунути недоліки цієї моделі.
Після декількох місяців роботи Бор 1913 року опублікував свою квантову теорію атома. Основу цієї теорії становлять постулати Бора:
1. Атомна система може перебувати тільки в певних (стаціонарних або квантових) станах, кожному з яких відповідає певна енергія En. У стаціонарному стані атом не випромінює.
2. Під час переходу атома з одного стаціонарного стану в інший відбувається випущення або поглинання кванта електромагнітної енергії. Енергія кванта дорівнює різниці енергій стаціонарних станів: .
Із другого постулату Бору випливає, що атом може випромінювати й поглинати світло тільки з певними значеннями частот, які визначаються формулою. Це так зване «правило частот».
Наслідки постулатів Бора
Постулати Бора довели, що джерелом світла є збуджений атом.
Світло генерується під час переходу атома з одного збудженого стану в інший. Частота генерованого світла пропорційна ΔE, світло випромінюється й поглинається у вигляді квантів.
Подібність атомів того самого хімічного елемента пояснюється в теорії Бора тим, що у всіх атомах даного елемента стаціонарні орбіти електронів ті самі.
Найбільший успіх теорія Бору мала стосовно атома Гідрогену, для якого виявилося можливим побудувати кількісну теорію. Однак уже для наступного за складністю атома — атома Гелію — домогтися кількісної узгодженості з дослідом не вдалося, не кажучи вже про складніші атоми.
Подальший розвиток фізики довів, що труднощі теорії Бора були пов’язані з її внутрішньою суперечливістю, тому що в ній поєднувалися закони класичної фізики й суперечні їм постулати Бора.
V. Узагальнення і систематизація знань.
Запитання до учнів (метод «Кубування»)
Запитання до учнів (метод «Мікрофон»)
- Чим відрізняються один від одного атоми різних хімічних елементів?
- Що є головною характеристикою певного хімічного елемента?
- Які частинки входять до складу ядра?
- Як утворюються позитивні і негативні іони?
- Чому маса атома Гідрогену незначно відрізняється від маси протона? Як відрізняються розміри атома Гідрогену від розмірів протона.
Фронтальне опитування — метод «Асоціативний кущ»
НЕЙТРОНИ ПРОТОНИ
![]()
![]() ФОТОН
ФОТОН
![]()
![]()
![]() РЕЗЕРФОРД
РЕЗЕРФОРД
СТАЦІОНАРНІ РІВНІ ПОЗИТИВНЕ ЯДРО
![]()
![]()
ПОГЛИНАННЯ ЕЛЕКТРОНИ
![]()
![]()
ПОСТУЛАТИ
![]() ВИПРОМІНЮВАННЯ ПЛАНІТАРНА МОДЕЛЬ
ВИПРОМІНЮВАННЯ ПЛАНІТАРНА МОДЕЛЬ
![]()
![]()
![]() Н. БОРА Е. РЕЗЕРФОРД
Н. БОРА Е. РЕЗЕРФОРД

![]()
 ІОН
ІОН
![]()
ДЖ. ТОМСОН
![]()
![]()
![]()
МОДЕЛЬ ПУДИНГА
![]()
![]()
НЕЙТРАЛЬНИЙ МАЛИЙ
ХІМ. ЕЛЕМЕНТ
ЕЛЕКТРОНИ
ПОЗИТИВНА РЕЧОВИНА
Задачі для розв’язання на уроці.
- У ядрі атома карбону міститься 12 частинок. Навколо ядра рухаються 6 електронів. Скільки в ядрі цього атома протонів і нейтронів?
- Скільки протонів, нейтронів, і електронів у позитивному іоні літію?
- На що перетвориться атом натрію, якщо «забрати» з його ядра один протон, не змінюючи при цьому кількість електронів?
- Що має більшу масу: атом Літію чи позитивний іон Літію? Атом Хлору чи негативний іон Хлору?
І варіант
- У ядрі атома хлора міститься 17 частинок. Навколо ядра рухаються 9 електронів. Скільки в ядрі цього атома протонів і нейтронів?
- Скільки протонів, нейтронів, і електронів у позитивному іоні фосфору?
-
Який склад атомів титану
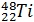 , ванадію
, ванадію 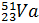 , хрому
, хрому 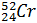 , барію
, барію 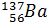 , мангану (марганцю)
, мангану (марганцю) 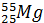 .
.
ІІ варіант
- На що перетвориться атом нітрогену, якщо «забрати» з його ядра один протон, не змінюючи при цьому кількість електронів.
- Скільки протонів, нейтронів, і електронів у негативному іоні аргону?
-
Який склад атомів урану
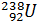 , плутонію
, плутонію 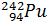 , тербію
, тербію 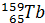 , радію
, радію 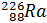 , актинію
, актинію 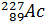 .
.
VІ. Домашнє завдання: § 57. Підручник «Фізика» 11 клас, Гончаренко, (дати відповіді на запитання).
Задача: знайти склад позитивних іонів No, Ir, Fe, Pb, Ra, Er, та негативних іонів Th, Lr, Ho, F, Lu, Cm, Cs.
VІІ. Підведення підсумків уроку.
Картки-завдання
Історія вивчення атома. Ядерна модель атома. Квантові постулати М. Бора.
- Чим відрізняться один від одного атоми різних хімічних елементів?
- Що є головною характеристикою певного хімічного елемента?
- Які частини входять до складу ядра?
- Як утворюються позитивні і негативні іони?
- Чому маса атома Гідрогену незначно відрізняється від маси протона? Як відрізняються розміри атома Гідрогену від розмірів протона?
Задачі
- У ядрі атома карбону міститься 12 частинок. Навколо ядра рухаються 6 електронів. Скільки в ядрі цього атома протонів і нейтронів?
- Скільки протонів, нейтронів, і електронів у позитивному іоні літію?
- На що перетвориться атом натрію, якщо «забрати» з його ядра один протон, не змінюючи при цьому кількість електронів?
- Що має більшу масу: атом Літію чи позитивний іон Літію? Атом Хлору чи негативний іон Хлору?
І варіант
- У ядрі атома хлора міститься 17 частинок. Навколо ядра рухаються 9 електронів. Скільки в ядрі цього атома протонів і нейтронів?
- Скільки протонів, нейтронів, і електронів у позитивному іоні фосфору?
-
Який склад атомів титану
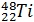 , ванадію
, ванадію 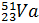 , хрому
, хрому 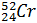 , барію
, барію 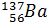 , мангану (марганцю)
, мангану (марганцю) 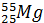 .
.
ІІ варіант
- На що перетвориться атом нітрогену, якщо «забрати» з його ядра один протон, не змінюючи при цьому кількість електронів.
- Скільки протонів, нейтронів, і електронів у негативному іоні аргону?
-
Який склад атомів урану
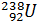 , плутонію
, плутонію 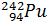 , тербію
, тербію 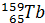 , радію
, радію 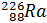 , актинію
, актинію 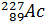 .
.

про публікацію авторської розробки
Додати розробку
