Календарно-тематичне планування уроків хімії 8 клас за новою програмою
|
№ |
Тема уроку |
Дата |
Примітка |
|
Поторення найважливіших питань курсу хімії 8 клас
|
|||
|
1. |
Первинний інструктаж з ОП.Інструкція № 4.7.Склад і властивості основних класів неорганічних сполук
|
|
|
|
2. |
Хімічний зв’язок і будова речовини |
|
|
|
3. |
Хімічний зв’язок і будова речовини
|
|
|
|
Тема 1.Розчини |
|||
|
4. |
Поняття про дисперсні системи.Колоїдні та істинні розчини.Суспензії,емульсії,аерозолрі
|
|
|
|
5. |
Будова молекули води,поняття про водневий зв’язок. Інструктаж з БЖД.Інструкція № 1.3. Лобораторний дослід № 1 «Виявлення йонів Гідрогену та гідроксид-іонів у розчинах»
|
|
|
|
6. |
Розчинність,її залежність від різних чинників.Насичені й ненасичені,концентровані й розведені розчини.Навчальний проект «Виготовлення розчинів для надання домедичної допомоги» |
|
|
|
7. |
Розчинність,її залежність від різних чинників.Насичені й ненасичені,концентровані й розведені розчини
|
|
|
|
8 . |
Теплові явища,що супроводжують розчинення речовин.Розчинення як фізико-хімічний процес.Кристалогідрати.Навчальний проект «Вирощування кристалів солей»
|
|
|
|
9 . |
Електролітична дисоціація.Електроліти й неелектроліти
|
|
|
|
10. |
Електролітична дисоціація кислот,основ,солей у водних розчинах. Навчальний проект «Електроліти в сучасних акумуляторах»
|
|
|
|
11. |
Ступінь електролітичної дисоціації.Сильні та слабкі електроліти
|
|
|
|
12. |
Поняття про рН розчину ( без математичних розрахунків).Значення рН для характеристики кислотного чи лужного середовища.Навчальний проект «Дослідження рН грунтів для своєї місцевості» Інструктаж з БЖД.Інструкція № 1.3 Лабораторний дослід № 1 «Установлення приблизного значення рН води,лужних і кислих розчинів ( натрій гідроксиду,хлоридної кислоти,харчової і косметичної продукції) за допомогою універсального індикатора».Лабораторний дослід № 2 « Дослідження рН харчової і косметичної продукції»
|
|
|
|
13. |
Тематична контрольна робота № 1 з теми «Розчини» |
|
|
|
14. |
Реакції обміну між розчинами електролітів,умови їх перебігу.Йонно-молекулярні рівняння хімічних реакцій. Інструктаж з БЖД.Інструкція № 1.3.Лабораторний дослід № 3 «Реакції обміну між електролітами у водних розчинах,що супроводжуються випаданням осаду».Лабораторний дослід № 4 «Реакції обміну між електролітами у водних розчинах,що супроводжуються виділенням газу».
|
|
|
|
15. |
Реакції обміну між розчинами електролітів,умови їх перебігу.Йонно-молекулярні рівняння хімічних реакцій. Інструктаж з БЖД.Інструкція № 1.3. Лабораторний дослід № 5«Реакції обміну між електролітами у водних розчинах,що супроводжуються утворенням води» |
|
|
|
16. |
Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Інструктаж з БЖД.Інструкція № 1.3.Лабораторний дослід № 6 «Виявлення йонів Гідрогену та гідроксид-іонів у розчинах» |
|
|
|
17. |
Якісні реакції на деякі іони.Застосування якісних реакцій. Інструктаж з БЖД.Інструкція № 1.3.Лабораторні досліди № 7,8,9 «Виявлення хлорид-, ,сульфат-, -,карбонат-іонів у розчині» |
|
|
|
18. |
Розв ’язування задач на приготування розчинів із кристалогідратів |
|
|
|
19. |
Розв ’язування задач на приготування розчинів із кристалогідратів
|
|
|
|
20. |
Інструктаж з БЖД.Інструкція № 7.Практична робота №1 «Реакції йонного обміну між електролітами у водних розчинах» |
|
|
|
21. |
Інструктаж з БЖД.Інструкція № 8.Практична робота № 2 «Розв ’язування експериментальних задач» |
|
|
|
22. |
Захист навчальних проектів |
|
|
|
23. |
Тематична контрольна робота №2 з теми «Розчини»
|
|
|
|
Тема 2.Хімічні реакції |
|||
|
24. |
Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій:реакції сполучення,розкладу,заміщення,обміну |
|
|
|
25. |
Ступінь окиснення.Визначення ступеня окиснення елемента за хімічною формулою сполуки |
|
|
|
26. |
Складання формули сполуки за відомими ступенями окиснення елементів |
|
|
|
27. |
Окисно-відновні реакції.Процеси окиснення,відновлення,окисники,відновники |
|
|
|
28. |
Складання рівнянь окисно-відновних реакцій |
|
|
|
29. |
Значення окисно-відновних процесів у житті людини,природі й техніці |
|
|
|
30. |
Контрольний зріз знань за І семестр |
|
|
|
31. |
Екзотермічні та ендотермічні реакції.Термохімічне рівняння. Навчальні проекти «Ендотермічні реакції на службі людини», «Екзотермічні реакції в життєдіяльності живих організмів» |
|
|
|
32. |
Оборотні й необоротні реакції. |
|
|
|
33. |
Швидкість хімічної реакції,залежність швидкості реакції від різних чинників. Інструктаж з БЖД.Інструкція № 1.3.Лабораторний дослід № 10 «Вплив концентрації і температури на швидкість реакції цинку з хлоридною кислотою» |
|
|
|
34. |
Інструктаж з БЖД.Інструкція № 9. Практична робота № 3 «Вплив різних чинників на швидкість хімічних реакцій» |
|
|
|
35. |
Узагальнення і систематизація знань |
|
|
|
36. |
Тематична контрольна робота № 3 з теми «Хімічні реакції» |
|
|
|
Тема 3.Початкові поняття про органічні сполуки |
|||
|
37. |
Особливості органічних сполук (порівняно з неорганічними).Елементи -органогени |
|
|
|
38. |
Метан як представник насичених вуглеводнів. Гомологія |
|
|
|
39. |
Гомологи метану ( перші десять) ,їхні молекулярні формули та назви. Фізичні властивості .Реакція заміщення для метану |
|
|
|
40. |
Етен ( етилен) і етин ( ацетилен) як представники ненасичених вуглеводнів. Молекулярні і структурні формули.Фізичні властивості. |
|
|
|
41. |
Реакція приєднання для етену й етину (галогенування,гідрування) |
|
|
|
42. |
Горіння вуглеводнів |
|
|
|
43. |
Поняття про полімери на прикладі поліетилену.Застосування поліетилену. Навчальний проект «Використання полімерів:еколого-економічний аспект» |
|
|
|
44. |
Поширення вуглеводнів у природі.Природний газ,нафта,кам’яне вугілля-природні джерела вуглеводнів.Перегонка нафти.Вуглеводнева сировина й охорона довкілля.Застосування вуглеводнів |
|
|
|
45. |
Захист навчальних проектів |
|
|
|
46. |
Поняття про спирти , карбонові кислоти,жири,вуглеводи |
|
|
|
47. |
Метанол,етанол,гліцерил:молекулярні і структурні формули,фізичні властивості |
|
|
|
48. |
Горіння етанолу.Якісна реакція на гліцерил. Інструктаж з БЖД.Інструкція № 1.3. Лабораторний дослід № 11 «Взаємодія гліцерилу з купрум (ІІ) гідроксидом» |
|
|
|
49. |
Отруйність метанолу й етанолу,згубна дія алкоголю на організм людини |
|
|
|
50. |
Тематична контрольна робота № 4 з теми «Початкові поняття про органічні сполуки» |
|
|
|
51. |
Етанова ( оцтова) кислота,її молекулярна і структурна формули,фізичні властивості. |
|
|
|
52. |
Хімічні властивості етанової кислоти :електролітична дисоціація,взаємодія з індикаторами металами,лугами,солями |
|
|
|
53. |
Хімічні властивості етанової кислоти :електролітична дисоціація,взаємодія з індикаторами металами,лугами,солями |
|
|
|
54. |
Інструктаж з БЖД.Інструкція № 10.Практична робота № 4 «Властивості етанової кислоти» |
|
|
|
55. |
Застосування етанової кислоти . Вищі карбонові кислоти:стеаринова,пальмітинова,олеїнова. Мило,його склад,мийна дія. |
|
|
|
56. |
Жири.Склад,фізичні властивості.Природні й гідрогенізовані жири .Біологічна роль жирів |
|
|
|
57. |
Вуглеводи:глюкоза,сахароза,крохмаль,целюлоза. Молекулярні формули,фізичні властивості, поширення і утворення у природі. |
|
|
|
58. |
Крохмаль і целюлоза –природні полімери.Якісні реакції на глюкозу і крохмаль. Інструктаж з БЖД.Інструкція № 1.3. Лабораторний дослід № 12,№ 13,№ 14 «Взаємодія глюкози з купрум (ІІ) гідроксидом», «Взаємодія крохмалю до води ( розчинність,утворення клейстеру», « Взаємодія крохмалю з йодом» |
|
|
|
59. |
Застосування вуглеводів,їхня біологічна роль. Захист проектів |
|
|
|
60. |
Поняття про амінокислоти.Білки як біологічні полімери.Денатурація білків.Біологічна роль амінокислот і білків |
|
|
|
61. |
Значення природних і синтетичних органічних сполук |
|
|
|
62. |
Інструктаж з БЖД.Інструкція № 11.Практична робота № 5 «Виявлення органічних сполук у харчових сполуках» |
|
|
|
63. |
Обчислення об’ємних відношень газів за хімічними рівняннями |
|
|
|
64. |
Узагальнення і систематизація знань |
|
|
|
65. |
Тематична контрольна робота № 5 з теми «Початкові поняття про органічні сполуки»
|
|
|
|
Тема 4.Узагальнення знань з хімії |
|||
|
66. |
Багатоманітність речовин та хімічних реакцій |
|
|
|
67. |
Взаємозв’язки між речовинами та їх взаємоперетворення |
|
|
|
68. |
Місце хімії серед наук про природу,її значення для розуміння наукової картини світу.Хімія та екологія |
|
|
|
69. |
Роль хімічної науки для забезпечення сталого розвитку людства |
|
|
|
70. |
Хімічна наука і виробництво в Україні .Видатні вчені-творці хімічної науки.Захист проектів |
|
|
|
|
|||
Тема уроку: Значення природних і синтетичних органічних сполук
Мета уроку: узагальнити знання учнів про органічні речовини природного походження; показати значення штучних і синтетичних органічних речовин, можливість їх одержання з природних органічних і неорганічних речовин; розкрити значення органічної хімії, причини різноманіття органічних речовин;виховувати пізнавальний інтерес до вивчення хімії
Тип уроку: застосування знань, умінь і навичок.
ХІД УРОКУ
І. Організація класу
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Заслуховування повідомлень учнів про біологічну роль і значення нуклеїнових кислот
2. Фронтальне опитування
1) Назвіть природні полімери, які ви знаєте з курсу хімії та біології. Де в природі трапляються ці полімери?
2) Які природні корисні копалини є джерелами органічних сполук? (Розглядаємо колекції «Нафта й продукти її переробки», «Кам’яне вугілля й продукти переробки», схему «Продукти переробки природного газу».)
3) У чому полягає причина різноманіття органічних сполук? (Розглядаємо схему «Класифікації органічних сполук».)
4) Які речовини називаються гомологами? Наведіть приклади гомологічних рядів.
5) Які речовини називаються ізомерами? Які види ізомерії поширені в органічній хімії? Наведіть приклади.
6) Чим відрізняються природні й хімічні органічні речовини? Природні: рослинного й тваринного походження.
Хімічні: штучні (отримані на основі природних) і синтетичні (немає аналогів у природі).
ІІІ. Застосування знань, умінь і навичок
Групова робота
Групи заздалегідь готують відповіді, а на уроці представляють підготовлені схеми, таблиці, презентації.
1. Розгляд схеми переробки природного газу
Склад і використання природних і супутнього нафтових газів
|
Склад |
Природний газ |
Супутній нафтовий газ |
|
Метан |
88-98 % |
31-72 % |
|
Етан |
0,2-4,4 % |
7,5-21 % |
|
Пропан |
0,07-1,7 % |
5,2-21,5 % |
|
Бутан |
0-0,8 % |
2,3-20,4 % |
|
Пентан і вище |
0-0,6 % |
0,3-19,8 % |
|
Сірководень, азот, інші речовини |
1,35-16,7 % |
0-10,7 % |
|
Застосування |
Паливо,сировина для органічного синтезу |
Газовий бензин (пентан, гексан), пропан-бутанова суміш, сухий лід (метан) — паливо, сировина для органічного синтезу |
Розглядаємо схему використання природного газу.
1) Як паливо. (Назвіть галузі промисловості, де природний газ використовується як паливо.)
2) Як сировина хімічних виробництв.
2. Розгляд схеми переробки нафти
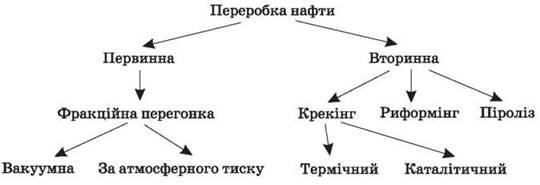
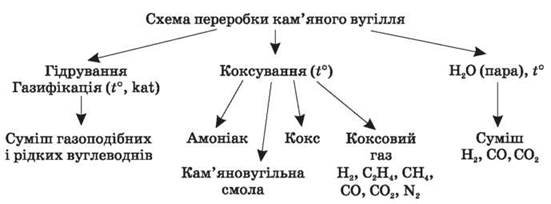
3. Схема переробки кам’яного вугілля
Переробка вугілля — суха перегонка — полягає в його хімічному розкладанні без доступу повітря. Розрізняють два види сухої перегонки: напівкоксування (500-550 °С) і коксування — промисловий метод переробки кам’яного вугілля, що полягає в нагріванні його без доступу повітря до 900-1050 °С.
Продукти первинної перегонки нафти та їх використання
|
Фракція |
Кількість атомів Карбону в молекулі |
Інтервал температур кипіння, °С |
Галузі застосування |
|
Газова |
C1 - С4 |
40 |
Паливо (опалення, газові плити) |
|
Бензин |
С5 - C10 |
40-180 |
Паливо (літаки, автомобілі та ін.), розчинники, сировина для одержання штучних вуглеводнів |
|
Лігроїн |
С8 - C14 |
150-250 |
Дизельне паливо, розчинники, продукти переробки для одержання бензину |
|
Гас |
C11 - C12 |
180-230 |
Паливо для реактивних і тракторних двигунів, розчинники |
|
Легкий газойль |
C13 - C17 |
230-305 |
Паливо для дизельних двигунів, масла |
|
Важкий газойль |
C18 - С25 |
305-400 |
|
|
Мазут (залишок перегонки) |
Суміш вищих вуглеводнів |
Понад 350 |
Паливо для парових казанів, сировина для виробництва мастильних матеріалів, парафін, вазелін, гудрон |
4. Штучні органічні речовини
(на прикладі ацетатного волокна, нітроцелюлози)
5. Синтетичні органічні речовини (на прикладі капрону)
6. Полімерні матеріали
IV. Підбиття підсумків уроку
V. Домашнє завдання


про публікацію авторської розробки
Додати розробку
