Кількісний склад розчину. Масова частка розчиненої речовини.
Тема: Кількісний склад розчину. Масова частка розчиненої речовини.
Мета: Ознайомити учнів з алгоритмом розв'язування задач із розрахунків масової частки розчиненої речовини у розчині, маси розчиненої речовини.
Тип уроку: засвоєння нових знань (навичок і вмінь)
Конспект уроку
Дата_____
Клас_____
Тема: Кількісний склад розчину. Масова частка розчиненої речовини.
Мета: Ознайомити учнів з алгоритмом розв’язування задач із розрахунків масової частки розчиненої речовини у розчині, маси розчиненої речовини.
Тип уроку: засвоєння нових знань (навичок і вмінь)
Перебіг уроку
І. Організаційний момент
І. Актуалізація опорних знань
Пригадайте формулу для обчислення масової частки елемента у складній речовині:
![]()
![]()
![]()
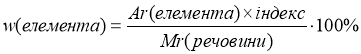
![]()
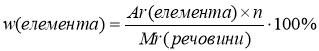
n – кількість атомів хімічного елемента (індекс); Ar(елемента) – відносна атомна маса елемента; Mr(речовини) – відносна молекулярна маса речовини (для речовин немолекулярної будови – відносна формульна маса). Масова частка (дубль – ве) є безрозмірною величиною або згідно наведених формул може вимірюватися у %.
Спробуйте по аналогії вивести формулу для обчислення масової частки розчиненої речовини у розчині:
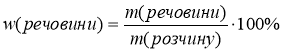
або у частках одиниці: 
m(речовини) – маса розчиненої речовини, вимірюється в г або кг; m(розчину) – маса розчину в г або кг.
Оскільки розчин складається з розчиненої речовини і води, то m(розчину) = m(речовини) + m(H2O)
ІІ. Мотивація навчальної діяльності
У своїй повсякденній діяльності людина постійно використовує розчини для побутових потреб, у промисловості, сільському господарстві, медицині і т.п. Тому важливо вміти правильно готувати розчини, знаючи їх кількісні характеристики – масову частку розчиненої речовини, масу розчиненої речовини . (Оголошення теми уроку)
ІІІ. Вивчення нового матеріалу
Для розрахунків будемо користуватися формулами:
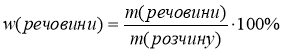 ;
; 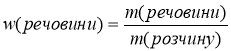
![]() ;
; ![]()
Формування вмінь і навичок
Розв`язування задач
![]() Задача 1. Обчисліть масову частку цукру в розчині, що складається з 200г води (склянка) та 50г цукру (5 чайних ложок з гіркою).
Задача 1. Обчисліть масову частку цукру в розчині, що складається з 200г води (склянка) та 50г цукру (5 чайних ложок з гіркою).
Дано: Розв`язання
m(H2O) = 200г![]() Запишемо формулу для розрахунку масової
Запишемо формулу для розрахунку масової
![]()
![]() m(цукру) = 50г частки цукру в розчині:
m(цукру) = 50г частки цукру в розчині:
![]() w(цукру)-?
w(цукру)-?
1) Обчислимо масу розчину : m(розчину) = m(цукру) + m(H2O)
m(розчину) = 50г + 200г = 250г;
2) Підставимо дані у формулу та обчислимо масову частку цукру:
![]()
Відповідь: w(цукру)=20%.
Задача 2. У медицині часто використовують фізіологічний розчин – водний розчин NaCl (кухонної солі) з постійною масовою часткою солі . Стерильний фізрозчин використовують для внутрішньом`язових та внутрішньовенних ін’єкцій, а також для інгаляцій. Обчисліть масову частку натрій хлориду у фізрозчині, якщо для його приготування в лабораторії беруть 9,1кг солі та 1000кг води.
![]() Дано: Розв`язання
Дано: Розв`язання
![]() m(NaCl) = 9,1кг Формула для обчислення:
m(NaCl) = 9,1кг Формула для обчислення:
![]()
![]()
![]() m(H2O) = 1000кг
m(H2O) = 1000кг 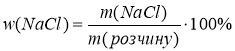
![]()
![]() w(NaCl) - ?
w(NaCl) - ?
![]() 1) m(розчину) = m(NaCl) + m(H2O)
1) m(розчину) = m(NaCl) + m(H2O)
m(розчину)=9,1кг + 1000кг=1009,1кг
2) 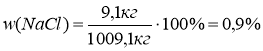
Відповідь: w(NaCl)=0,9%.
Задача 3. Щоб приготувати помадку для прикрашання тортів, тістечок готують цукровий сироп з додаванням кількох крапель лимонного соку. Обчисліть скільки цукру та води потрібно для приготування сиропу масою 400г, якщо масова частка цукру в ньому 0,625.
![]() Дано: Розв`язання
Дано: Розв`язання
![]() m(розч) = 400г Формули для обчислення:
m(розч) = 400г Формули для обчислення:
![]()
![]()
![]() w(цукру)=0,625
w(цукру)=0,625 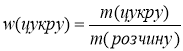 ;
;
![]()
![]()
![]() m(цукру) - ?
m(цукру) - ? ![]()
m(H2O)-? 1) m(цукру)=400г![]() 0,625=250г
0,625=250г
2) m(H2O)=m(розчину )- m(цукру)=400г – 250г=150г
Відповідь: m(цукру)=250г; m(H2O)=150г.
бчислюємо масу розчину: m(розчину) = m(цукру) + m(H2O)
ІV. Закріплення знань і вмінь
У задачі 3 ми визначили скільки цукру та води потрібно для приготування цукрового сиропу певної концентрації. Як практично це зробити?
Відповідь: цукор можна зважити на терезах або відміряти – 250г цукру містить велика склянка. Воду не важать, а відміряють об’єм, оскільки маса та об’єм води збігаються (густина води рівна 1г/мл чи 1кг/л). Відміряти воду можна за допомогою мірного циліндра , в домашніх умовах – неповна склянка. Цукор розчиняють у гарячій воді, додають кілька крапель лимонного соку та варять до загустіння.
Задача 4. Для знищення шкідників рослин використовують розчин залізного купоросу різної концентрації. Обчисліть яку масу купоросу та об’єм води потрібно взяти, щоб приготувати 12кг 5% - вого розчину.
![]() Дано: Розв`язання
Дано: Розв`язання
![]() m(роз-ну) = 12кг Формули для обчислення:
m(роз-ну) = 12кг Формули для обчислення:
![]()
![]()
![]()
![]()
![]() w(купоросу)=5%
w(купоросу)=5% 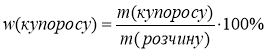 ;
;
![]()
![]()
![]() m(купоросу) - ?
m(купоросу) - ? ![]()
V(H2O)-? 1) m(купоросу)=![]() =0,6кг
=0,6кг
2) m(H2O)=m(розчину) – m(купоросу)=12кг – 0,6кг=11,4кг
V(H2O)=11,4л
Відповідь: m(купоросу) = 0,6кг; V(H2O)=11,4л.
Задача 5. До розчину залізного купоросу масою 500г з масовою часткою купоросу 20% долили 300мл води. Якою стала масова частка купоросу в одержаному розчині?
![]() Дано: Розв`язання
Дано: Розв`язання
![]() m(роз-ну) = 500г Формули для обчислення:
m(роз-ну) = 500г Формули для обчислення:
![]()
![]() w(купор.)=40%
w(купор.)=40% 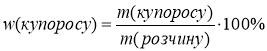 ;
;
![]()
![]()
![]()
![]() V2(H2O)=300мл
V2(H2O)=300мл ![]()
m (H2O)-? 1) m(купоросу)=![]()
m(купор.)-? 2) m(H2O)=m(розч)-m(купоросу)=500г – 200г =300г
w2(купор.)=? 3) Запитання: якщо додати воду до розчину, чи зміниться маса розчиненої речовини? Відповідь:маса речовини не зміниться, зміниться (збільшиться) маса розчину.Об`єм води можна замінити масою, враховуючи, що її густина рівна 1г/мл.
m2(розчину)= m(розчину)+ m2(H2O)=500г + 300г=800г
m2(купоросу)= m(купоросу.)=200г
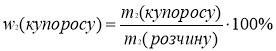
w2(купоросу)= ![]() =25%
=25%
Відповідь: m(купоросу) = 200г; m(H2O)=300г; w2(купоросу)=25%.
V. Домашнє завдання
1. Опрацювати §_____________;
2. Розв`язати задачу: Обчислити масу глюкози та води необхідні для виготовлення 500г розчину глюкози з масовою часткою 5%.


про публікацію авторської розробки
Додати розробку
