Кількість речовини. Моль. Число Авогадро
Урок №3
Тема: Кількість речовини. Моль. Число Авогадро
Мета: розкрити суть понять «кількість речовини», «моль», «число Авогадро», формувати вміння робити розрахунки із застосуванням цих понять.
Обладнання: роздатковий матеріал, колекція речовин кількістю 1моль
Тип уроку: вивчення нового матеріалу
Форми роботи: бесіда, робота біля дошки, індивідуальна робота
Хід уроку:
І. Організація класу
ІІ. Оголошення теми і мети уроку
ІІІ. Мотивація навчальної діяльності
Ви вже знаєте, що для проведення любої реакції необхідно взяти певні маси речовин. Наприклад, 14 г заліза взаємодіє з 8 г сірки.
Отже, на сьогоднішньому уроці нам необхідно розібратись, чому це так відбувається.
IV. Вивчення нового матеріалу
(Портрет Авогадро)
- З рівняння: Fe + S = FeS слідує, що 1 атом Феруму взаємодіє з 1 атомом Сульфуру.
Отже, в залізі масою 14 г міститься стільки атомів Феруму, скільки атомів Сульфуру у сірці масою 8 г.
Тому, в хімії вживають поняття «кількість речовини».
Формулюємо поняття «кількість речовини».
- Для вимірювання кількості речовини прийнято одиницю вимірювання «моль».
Формулюємо поняття поняття «моль».
- Число структурних частинок, що міститься в 1 моль любої речовини відоме і складає 6,02•1023. Це число названо на честь італійського вченого Амадео Авогадро – стала Авогадро: NA = 6,02•1023 моль-1.
- Даємо історичну довідку про А.Авогадро.
- Стала Авогадро і кількість речовини пов’язані між собою:
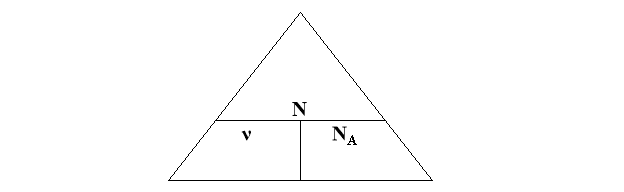
![]() ↔
↔ ![]()
- Наводимо приклад розв’язування задачі із застосуванням даних формул:
Обчислити кількість молекул, що містяться у воді кількістю речовини 0,05 моль.
Аналіз задачі: Що відомо? Що знайти? Як це зробити?
|
Дано: ν (Н2О) = 0,05 моль
|
Розв’язання: |
|
1. Яка кількість молекул води?
|
|
|
N(Н2О) − ? |
Відповідь: N(Н2О) = 3,01•1022 молекул |
V. Закріплення вивченого матеріалу
Розв’язування задач. Учням пропонується роздатковий матеріал із переліком задач. Один учень працює біля дошки, інші – в зошитах. Хто добре розібрався працює самостійно.
Задачі:
- Обчислити кількість речовини вуглекислого газу, що містить 3,01•1023 молекул.
- Обчислити кількість молекул ферум (ІІІ) оксиду кількістю речовини 0,2 моль.
- Обчислити кількість молекул та атомів, що містяться в кисні кількістю речовини 0,4 моль.
- Обчислити кількість речовини водню, що містить 3,01•1022 атомів Гідрогену.
VІ. Підведення підсумків уроку
VІІ. Домашнє завдання


про публікацію авторської розробки
Додати розробку
