Урок "Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: сполучення, розкладу, заміщення, обміну.
Допоможе реалізувати завдання:
- узагальнити й систематизувати знання про хімічні реакції;
- розвивати вміння й навички визначення типів хімічних реакцій за рівняння-ми;
- продовжити формування вміння складати рівняння хімічних реакцій, розміщення коефіцієнтів на основі закону збереження мас.
Дата _______________ Клас_______________
Тема: Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: сполучення, розкладу, заміщення, обміну.
Мета: узагальнити й систематизувати знання учнів про хімічні реакції;
- розвивати вміння й навички визначення типів хімічних реакцій за схемами рівнянь;
- продовжити формування вмінь складати рівняння хімічних реакцій, розміщу-вати коефіцієнти на основі закону збереження мас;
- розвивати спостережливість, логічне мислення, вміння порівнювати, аналізу-вати, встановлювати причинно - наслідкові зв’язки;
- створити умови для вільного висловлювання та аналітичної роботи;
- встановити взаємозалежність між навчальними дисциплінами, розкриваючи міжпредметні зв’язки;
- виховувати організованість, відповідальність.
Завдання:
- узагальнити й систематизувати знання про хімічні реакції;
- розвивати вміння й навички визначення типів хімічних реакцій за рівняння-ми;
- продовжити формування вміння складати рівняння хімічних реакцій, розміщення коефіцієнтів на основі закону збереження мас.
Тип уроку: комбінований урок засвоєння нових знань, узагальнення вмінь і навичок та застосування їх на практиці.
Форми роботи: розповідь учителя, фронтальна робота, індивідуальна.
Метод проведення: інтерактивний
Обладнання: ноутбук, інтерактивна дошка, мультимедійний проектор.
Засоби навчання: підручник, роздатковий матеріал, таблиці, карти, схема.
Структура уроку :
І. Організаційний етап. (2хв)
ІІ. Актуалізація опорних знань. (10хв)
ІІІ. Основна частина уроку. (20хв)
ІV. Заключна частина.(5хв)
V. Домашнє завдання. (3хв)
ХІД УРОКУ
І. Організаційний етап
Формула успішного урок

Саме ці якості потрібні нам для успішної співпраці.
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
2.1. Актуалізація та коригування опорних знань учнів
«Все тече, все змінюється », - стверджували давні філософи і повторюємо ми з вами в різних ситуаціях. І дійсно, все навколо нас і ми самі весь час змінюємося. Які ж зміни, що відбуваються, мають відношення до хімії?
1. Я пропоную вам зіграти в гру «Вірю – не вірю»
Я буду називати вам різні явища, які відбуваються навколо нас, а ви визначте: відносяться вони до хімічних чи ні?
1. Дощ на вулиці …………( ні )
2. Жовтіння листя …….( так)
3. Утворення іржі на поверхні цвяха ..( так)
4. Туман на дорозі …..( ні )
5. Скисання молока ….( так )
- Давайте проаналізуємо, що об’єднує явища, які ми визначили як хімічні. І чи буде правильне твердження : «хімічне явище – це є хімічна реакція»?
2. Метод «Мозковий штурм»
Учням пропонується швидко відповісти на запитання:
- Хімічна реакція – це перетворення речовин.
- Які ознаки хімічної реакції ви знаєте? (газ, осад, колір, теплота, світло)
- Як називають речовини, що вступають в реакцію?(реагенти)
- Як називаються речовини, що утворили після взаємодії?(продукти)
- Чи можна умовно будь-яку реакцію можна представити, як запис:
вихідні речовини → продукти реакції (так)
- Проста речовина –
- Складна речовина -
2.1. Мотивація пізнавальної діяльності учнів
Англійський учений Джозеф Прістлі в 1767 році зацікавився природою бульбашок, які виходять на поверхню під час бродіння пива. Над пивним чаном він помістив чашу з водою, яку потім спробував на смак, і виявив, що вона має освіжаючу дію. Прістлі відкрив ніщо інше, як вуглекислий газ, який і сьогодні використовується при виготовленні всіх газованих напоїв. Через п'ять років Прістлі опублікував роботу, в якій описав більш досконалий метод отримання вуглекислого газу шляхом реакції сірчаної кислоти з крейдою.
До якого типу можна віднести цю хімічну реакцію?
Щоб відповісти на це питання здійснимо класифікацію хімічних реакцій.
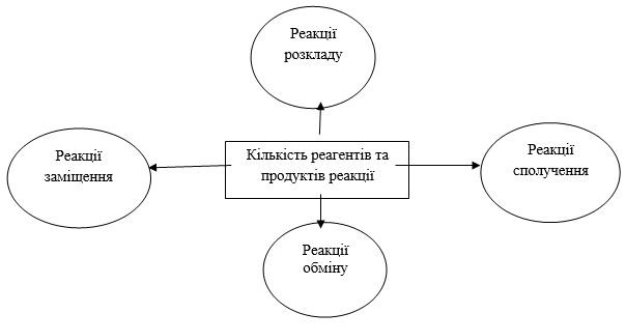
Відкрийте, будь ласка, зошити, запишіть число та тему над якою будемо працювати «Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. Реакції сполучення, розкладу, заміщення, обміну»
Мета нашого уроку:
- Ознайомитись з ознаками класифікації хімічних реакцій:
- Навчитись розрізняти реакції сполучення, розкладу, заміщення, обміну;
- Вміти наводити приклади вивчених типів хімічних реакцій.
ІІІ. Основна частина уроку
3.1. Вивчення нового матеріалу
Кожна хімічна реакція індивідуальна, оскільки в неї беруть участь конкретні хімічні речовини з притаманними їм властивостями . Разом з тим, різні хімічні реакції мають багато спільних ознак, що дає змогу класифікувати їх на підставі тієї чи іншої ознаки.
3.2. Робота з схемою
Прийом «Павучок». Будь-ласка запишіть у зошиті по середині словосполучення «хімічні реакції» та поставте 4 стрілочки.
Розглянемо перший тип:
- Сполучення – запишіть під першою стрілочкою
При горінні карбону в достатній присутності кисню утворюється – вуглекислий газ, при нестачі кисню утворюється інша речовина – чадний газ.
Запишемо ці реакцію.
С + О2 = СО2
2С + О2(нест.) = 2СО
В даних реакціях вступали прості речовини. Але можуть вступати й складні.
СаО + Н2О = Са(ОН)2
Другий тип:
У 7 класі ви ознайомились з реакціями за допомогою яких можна одержати кисень:
Розглянемо ці приклади, скажіть що спільного між цими реакціями?
- 2KClO3 = 2KCl + 3O2 ↑
- 2H2O2 = 2H2O + O2 ↑
- 2H2O = 2H2 ↑ + O2 ↑
Так, це реакція розкладу, тому запишіть будь-ласка під другою стрілочкою назву.
Для того щоб познайомитися з наступним типом, давайте пригадаємо реакції які відбуваються між кислотами та металами, що потрібно враховувати при написанні таких реакцій? (ряд активності металів).
Fе + 2НСІ= FеСІ2 + Н2
Zn + Н2SО4= ZnSО4+ Н2
Такі реакції називаються – реакціями заміщення. Запишіть назву під третьої стрілочкою.
Перш ніж перейти до останнього типу хімічних реакцій, прошу трохи відпочити і зробити фізкультхвилинку, але не просту:
Підводимося, піднімемо руки вгору, та порахуйте в реакції заліза з хлоридною кислотою загальну кількість атомів хлору, опускаємо та піднімаємо вгору 4 рази.
Руки опускаємо та порахуйте у реакції цинку з сульфатною кислотою загальну кількість атомів оксигену, витягуємо руки перед собою та робимо ножиці – 8 разів.
Описаний Прістлі більш досконалий метод отримання вуглекислого газу шляхом реакції сірчаної кислоти з крейдою має вигляд наступного рівняння:
![]()
![]() Н2SО4 + СаСО3 = СаSО4 + Н2СО3
Н2SО4 + СаСО3 = СаSО4 + Н2СО3
Н2О СО2
Дві складні речовини в результаті реакції обмінюються своїми складовими. Це реакція, як ми вже знаємо з попередньої теми – це реакція обміну.
Звернімося до нашої схеми павучка та доповнимо її.
3.3. Індивідуальна робота учнів з карткою
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
|
Схема хімічної реакції |
Реакція заміщення |
Реакція обміну |
|
НСІ + Мg = |
О |
К |
|
КОН + Н3РО4 = |
Н |
К |
|
Zn + НNО3 = |
С |
Р |
|
СuSО4 + Fe = |
И |
Б |
|
Nа2SО4 + ВаСІ2 = |
О |
Г |
|
АgNО3 + NаСІ = |
Н |
Е |
|
НСІ + Рb = |
Н |
У |
Назва елемента: ОКСИГЕН
ІІІ. Заключна частина уроку
Підбиття підсумків роботи на уроці. Рефлексія
«Вільний мікрофон» Учні порівнюють відповідність досягнень уроку з завданнями, поставленими учителем на початку уроку, відповідають на питання:
- Що було головним на уроці?
- Що було цікавим?
- Що дізнались нового?
- Де можна застосувати ці знання?
ІV. Домашнє завдання.
Відповідний § підручника, вчити поняття. Закінчити рівняння в картці.
Додаткове завдання. Наведіть не менше двох прикладів реакцій: а) сполучення; в) заміщення; б) розкладу; г) обміну.
Творче завдання: знайти інформації про згадування в літературі хімічних реакцій, за можливості записати їх рівняння та класифікувати.
Індивідуальна робота учня з карткою
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
|
Схема хімічної реакції |
Реакція заміщення |
Реакція обміну |
|
НСІ + Мg = |
О |
К |
|
КОН + Н3РО4 = |
Н |
К |
|
Zn + НNО3 = |
С |
Р |
|
СuSО4 + Fe = |
И |
Б |
|
Nа2SО4 + ВаСІ2 = |
О |
Г |
|
АgNО3 + NаСІ = |
Н |
Е |
|
НСІ + Рb = |
Н |
У |
Назва елемента:
Індивідуальна робота учня з карткою
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
|
Схема хімічної реакції |
Реакція заміщення |
Реакція обміну |
|
НСІ + Мg = |
О |
К |
|
КОН + Н3РО4 = |
Н |
К |
|
Zn + НNО3 = |
С |
Р |
|
СuSО4 + Fe = |
И |
Б |
|
Nа2SО4 + ВаСІ2 = |
О |
Г |
|
АgNО3 + NаСІ = |
Н |
Е |
|
НСІ + Рb = |
Н |
У |
Назва елемента:
Індивідуальна робота учня з карткою
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
|
Схема хімічної реакції |
Реакція заміщення |
Реакція обміну |
|
НСІ + Мg = |
О |
К |
|
КОН + Н3РО4 = |
Н |
К |
|
Zn + НNО3 = |
С |
Р |
|
СuSО4 + Fe = |
И |
Б |
|
Nа2SО4 + ВаСІ2 = |
О |
Г |
|
АgNО3 + NаСІ = |
Н |
Е |
|
НСІ + Рb = |
Н |
У |
Назва елемента:
Індивідуальна робота учня з карткою
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
|
Схема хімічної реакції |
Реакція заміщення |
Реакція обміну |
|
НСІ + Мg = |
О |
К |
|
КОН + Н3РО4 = |
Н |
К |
|
Zn + НNО3 = |
С |
Р |
|
СuSО4 + Fe = |
И |
Б |
|
Nа2SО4 + ВаСІ2 = |
О |
Г |
|
АgNО3 + NаСІ = |
Н |
Е |
|
НСІ + Рb = |
Н |
У |
Назва елемента:
Індивідуальна робота учня з карткою
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
|
Схема хімічної реакції |
Реакція заміщення |
Реакція обміну |
|
НСІ + Мg = |
О |
К |
|
КОН + Н3РО4 = |
Н |
К |
|
Zn + НNО3 = |
С |
Р |
|
СuSО4 + Fe = |
И |
Б |
|
Nа2SО4 + ВаСІ2 = |
О |
Г |
|
АgNО3 + NаСІ = |
Н |
Е |
|
НСІ + Рb = |
Н |
У |
Назва елемента:
Індивідуальна робота учня з карткою
До якого типу реакцій можна віднести реакції, що подані схемами, послідовно з'єднуючи букви, що є відповідями ви отримаєте назву хімічного елемента.
|
Схема хімічної реакції |
Реакція заміщення |
Реакція обміну |
|
НСІ + Мg = |
О |
К |
|
КОН + Н3РО4 = |
Н |
К |
|
Zn + НNО3 = |
С |
Р |
|
СuSО4 + Fe = |
И |
Б |
|
Nа2SО4 + ВаСІ2 = |
О |
Г |
|
АgNО3 + NаСІ = |
Н |
Е |
|
НСІ + Рb = |
Н |
У |
Назва елемента:


про публікацію авторської розробки
Додати розробку
