Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій реакції сполучення, розкладу, заміщення, обміну.
План-конспект уроку хімії
Дата _______ 9 клас
Тема: Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій: реакції сполучення, розкладу, заміщення, обміну. Цілі:
Формування ключових компетентностей: спілкування державною мовою, математична компетентність, основні компетентності у природничих науках і технологіях, уміння вчитися впродовж життя.
Формування предметних компетентностей:
розпочати формування предметної компетентності в темі «Хімічні реакції», актуалізувати уявлення учнів про хімічні реакції та вже вивчені типи реакцій, сприяти свідомій орієнтації учнів у типах хімічних реакцій - сполучення, розкладу, розвивати хімічну мову, виховувати інтерес до хімії.
Очікувані результати:учень знає і розуміє суть понять: хімічна реакція, реакція сполучення, розкладу, заміщення, обміну; розрізняє та класифікує реакції за ознакою кількості речовин, що вступають у реакцію й утворюються внаслідок реакції, та їхнього складу; дотримується правил роботи з хімічними речовинами; висловлює судження про значення хімічних реакцій та знань про них .
Тип уроку: урок засвоєння нових знань
Обладнання і матеріали: мультимедійний проектор, комп’ютер, інтерактивна дошка, презентація на Google Диску, Інтернет, сервіс Learningapps.org.
Хід уроку:
І. Організаційний момент.
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності учнів.
Відомі сотні тисяч різноманітних речовин. Щоб розібратися в їх багатоманітності, вчені розподілили ці речовини по групам. Давайте згадаємо як поділяють речовини.
- Гра «Чому вони разом?»
- Na, C, H2, Fe (прості речовини)
- CaO, KOH, H2SO4, BaCO3 (складні речовини)
- FeO, P2O5, Al2O3, CO2 (оксиди)
- HCl, HNO3, H2SO4, H3PO4 (кислоти)
- NaOH, Ca(OH)2, Al(OH)3, Zn(OH)2 (основи)
- BaSO4, NaCl, CaCO3, Mg(NO3)2 (солі)
Діти, ви звернули увагу який за вікном дощ (туман, будь-яке фізичне явище)? Яке це явище? Фізичне чи хімічне? Наведіть приклади хімічних явищ. Пригадаємо: Хімічна реакція- це явище….?
Кожен день ми з вами зустрічаємося із різними природними процесами та явищами, якісь із них є хімічними, інші фізичними, а інші біологічними, а чи знаєте ви між ними різницю ми з вами зараз перевіримо.
- Вікторина "Так чи ні"
1. Подих людини – це хімічне явище.
2. Дощ на вулиці – це фізичне явище.
3. Газ, осад, слабкий електроліт, вода утворюється тоді, коли реагуючі речовини прореагували до кінця.
4. Утворення іржі на поверхні цвяха – це фізичне явище.
5. Хімічні реакції можна зустріти тільки в хімічних лабораторіях.
6. Смаження м'яса і перетравлення його в шлунку – це фізичний процес.
7. Фарбування волосся фарбою – процес хімічний.
8. Фотосинтез – це явище лише фізичне і ніяк не пов'язане з хімічними реакціями.
9. Дихання – це хімічний процес.
Які ознаки хімічних реакцій? (зміна забарвлення, виділення газу, виділення світла і тепла, випадання осаду, поява запаху).
Що таке реагенти або вихідні речовини та продукти реакції? (Реагенти або вихідні речовини – це речовини, що вступають в хімічну реакцію, продукти – це речовини, що утворюються внаслідок реакції)
Стародавня легенда розповідає, що цариця Клеопатра, яка була відома не тільки своєю красою, а ще й освіченою, виграла оригінальне парі, з'ївши дорогоцінний «сніданок», який коштував 100 000 сестерцій.
Ось як це описано в книзі Генрі Хаггарда «Клеопатра»: «…Вона вийняла з вуха одну з тих величезних перлин і опустила перлину в оцет. Запанувала тиша, вражені гості, завмерши спостерігали, як незрівнянна перлина повільно розчиняється у міцному оцті. Від неї не залишилось і сліду, і тоді Клеопатра підняла келих, покрутила його і випила весь до останньої краплі».
Проблемне запитання.
Що сталося з перлиною? До якого типу можна віднести цю хімічну реакцію?
Щоб відповісти на ці питання здійснимо класифікацію хімічних реакцій.
ІІІ. Повідомлення теми та цілей уроку.
ІV. Вивчення нового матеріалу.
Кожна хімічна реакція індивідуальна,оскільки в неї беруть участь конкретні хімічні речовини з притаманними їм властивостями . Разом з тим,різні хімічні реакції мають багато спільних ознак, що дає змогу класифікувати їх на підставі тієї чи іншої ознаки.
- Класифікація хімічних реакцій
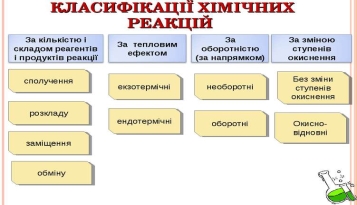
- Типи реакцій за кількістю і складом реагентів та продуктів реакцій:
- реакції сполучення,
- розкладу,
- заміщення,
- обміну.
V. Узагальнення й систематизація знань.
- Інтерактивна вправа "Перевірте себе"



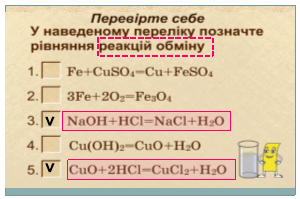
- Інтерактивні вправи :
https://learningapps.org/1274073
https://learningapps.org/4667981
VІ. Підсумок уроку.
Повернемось до нашої легенди про Клеопатру.
Проблемне запитання.
Що трапилось з перлиною?
Очікувана відповідь: перлина складається з кальцій карбонату - вона розчинилася у кислоті: СаСО3 + 2HCl →CaCl2 + H2O + CO2↑ - реакція обміну, некаталітична, екзотермічна, необоротна.
VІІ. Домашнє завдання
- Опрацювати параграф 18 підручника (с. 92-95)
- Виконати вправи №73,74 (письмово).

про публікацію авторської розробки
Додати розробку
