Класифікація хімічних реакцій за різними ознаками. Реакції сполучення, розкладу, заміщення, обміну.
Тема: Класифікація хімічних реакцій за різними ознаками. Реакції сполучення, розкладу, заміщення, обміну.
Мета: повторити класифікацію хімічних реакцій за ознакою зміни числа речовин,
що вступають у реакцію і утворюються після реакції; узагальнити ознаки, за якими класифікують реакції та їх типи, на основі експерименту ознайомити з тепловими явищами, що відбуваються під час реакцій.
Формувати знання учнів про хімічні рівняння на прикладах класифікації
рівнянь реакцій за різними ознаками, розвивати вміння та навички визначення типів хімічних реакцій за рівняннями.
Виховувати в учнів самостійність, мислення, кмітливість.
Тип уроку: вивчення нового матеріалу.
Обладнання: мультимедійна дошка, проектор, презентація у форматі PowerPoint,
підручники, зошити, роздатковий матеріал, періодична система Д. І. Менделєєва, електрохімічний ряд напруг металів, «Хімічна квітка» та її частини, ілюстративний матеріал, відеофрагмент мультфільму «Великі біблійні герої. Мойсей».
Хімія 9 клас
Тема: Класифікація хімічних реакцій за різними ознаками. Реакції сполучення, розкладу, заміщення, обміну.
Мета: повторити класифікацію хімічних реакцій за ознакою зміни числа речовин,
що вступають у реакцію і утворюються після реакції; узагальнити ознаки, за якими класифікують реакції та їх типи, на основі експерименту ознайомити з тепловими явищами, що відбуваються під час реакцій.
Формувати знання учнів про хімічні рівняння на прикладах класифікації
рівнянь реакцій за різними ознаками, розвивати вміння та навички визначення типів хімічних реакцій за рівняннями.
Виховувати в учнів самостійність, мислення, кмітливість.
Тип уроку: вивчення нового матеріалу.
Обладнання: мультимедійна дошка, проектор, презентація у форматі PowerPoint,
підручники, зошити, роздатковий матеріал, періодична система Д. І. Менделєєва, електрохімічний ряд напруг металів, «Хімічна квітка» та її частини, ілюстративний матеріал, відеофрагмент мультфільму «Великі біблійні герої. Мойсей».
Хід уроку:
І. Організаційний момент
Доброго дня, дорогі діти!
Сьогодні разом в тіснім колі
Цікавих справ буде доволі
Реакції ми будем вчити
І як їх швидко розрізнити.
ІІ. Мотивація навчальної діяльності
На нашому сьогоднішньому уроці мені хотілося б детальніше розглянути один із ключових моментів у вивченні нашої дисципліни, без якого поняття самої науки стає розмитим. Знання хімії неможливе без знання хімічних процесів, які відбуваються у природі, і вміння правильно скласти, записати та класифікувати хімічні реакції. Сьогодні ми з вами навчимося класифікувати величезну кількість хімічних реакцій за різноманітними ознаками.
Люди пізнавали природу з давніх часів. Ці знання накопичувалися й передавалися з покоління в покоління. Людина, вивчаючи властивості речовин, намагалася їх змінити. При цьому вона змішувала, піддавала обробці вогнем, подрібнювала й розчиняла у воді різні речовини, тобто проводила хімічні експерименти. Перебіг хімічного експерименту, як ви вже знаєте, можна стисло записати у вигляді рівняння реакції, де вказано її реагенти та продукти. Існують і такі реакції, які супроводжуються виділенням або поглинанням енергії, відбуваються у присутності каталізатора та ін. сьогодні на уроці ми класифікуватимемо реакції за різними ознаками. (Слайд 1), (Слайд 2)
Проблемне питання «Коктейль Клеопатри»
В історичних довідках згадують парі єгипетської цариці Клеопатри та Марка Антонія. В тодішні часи розваг було не так багато, тож і вигадували всілякі несусвітні речі. Якось від нічого робити, цариця запропонувала Марку Антонію закластися, що вона вип’є на вечерю вино вартістю в 10 мільйонів сестерцій. На ті часи, цілий статок, а винні колекції тоді ще не набули поширення. Що стояло на кону між коханцями, наразі ніхто не знає. Але зваживши всі «за» і «проти», особливо пропозиції тодішнього ринку вин, римський консул згодився. Він явно розраховував виграти і навряд чи мова йшла про якісь грошову ставку. Швидше за все, на кону стояло якесь незвичне прохання.
Але Клеопатра, яка ввійшла в історію як дуже мудра і хитра жінка, і тут обдурила наївного Антонія. Тільки-но почався їхній бенкет, цариці піднесли кубок з винним оцтом. Вельможна єгиптянка демонстративно вийняла з вуха сережку з великою чорною перлиною, яка, власне, і коштувала 10 мільйонів сестерцій, і вкинула в бокал. Наприкінці вечері вона випила його одним залпом і Марк Антоній мусив визнати свій програш.
А яка це хімічна реакція була основою такого ризикованого, на перший погляд, учинку цариці, ви дізнаєтесь наприкінці нашого уроку.
ІІІ. Актуалізація опорних знань учнів
Перш ніж ми приступимо до вивчення нового матеріалу, давайте згадаємо, які особливості супроводжують перебіг деяких хімічних процесів. Для цього ми виконаємо завдання 1, у якому вам необхідно буде закінчити рівняння реакцій і вказати особливості їх перебігу. (Слайд 3)
Завдання 1
- ВаСО3 = … + … ;
- С + О2 = …;
- СаО + Н2О = …;
- Zn + Н2SО4 =… + … . (аналіз виконаного завдання)
Завдання 2
Запишіть рівняння реакції горіння метану СН4. Назвіть ознаки перебігу цього хімічного процесу. (Слайд 4) (аналіз виконаного завдання)
ІV. Вивчення нового матеріалу
 Як ви помітили з попереднього завдання, жодна із представлених хімічних реакцій несхожа на іншу, кожна має свої особливості, які відрізняють її від інших реакцій.
Як ви помітили з попереднього завдання, жодна із представлених хімічних реакцій несхожа на іншу, кожна має свої особливості, які відрізняють її від інших реакцій.
Метод «Навчаючи - вчусь»
Дидактична гра «Хімічна квітка»
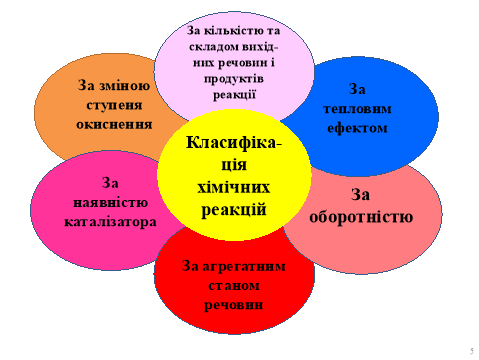
Існує декілька класифікацій, які враховують різні ознаки хімічних реакцій. (Слайд 5)
Розглянемо основні з них.
Робота з таблицею
|
Ознака класифікації хімічних реакцій |
Типи реакцій |
|
За кількістю та складом вихідних речовин і продуктів реакції
|
Розкладу |
|
Сполучення |
|
|
Обміну |
|
|
Заміщення |
|
|
За тепловим ефектом |
Екзотермічні (виділення теплоти) |
|
Ендотермічні (поглинання теплоти) |
|
|
За оборотністю
|
Оборотні |
|
Необоротні |
|
|
За зміною ступеня окиснення |
Окисно – відновні (ступінь окиснення елементів змінюється) |
|
Кислотно - основна (ступінь окиснення елементів не змінюється) |
|
|
За наявністю каталізатора |
Каталітичні |
|
Некаталітичні |
|
|
За агрегатним станом речовин |
Гомогенні (речовини в одному агрегатному стані) |
|
Гетерогенні (речовини в різних агрегатних станах) |
Робота з підручником.
Розглянемо, паралельно, таблицю 5 в підручнику на стор. 81.
Сьогодні ми більш детально розглянемо лише один тип класифікації : кількість і склад вихідних речовин і продуктів реакції. (Слайд 6)
Існує чотири основні типи таких реакцій. Перший із них – реакції сполучення. Це такі реакції, під час яких із двох і більше простих речовин утворюється одна складна речовина. Схематично ці процеси можна записати в такий спосіб:
А + В = АВ
Розглянемо реакції сполучення виконавши дане завдання.
Другий тип – реакції розкладу. Вони давно знайомі вам, як і попередні реакції сполучення. У результаті реакцій розкладу з однієї складної речовини утворюються декілька простих або складних. (Слайд 7)
Схематично ці процеси можна записати так:
АВ = А + В
Написати рівняння розкладу даних речовин:
Сu(ОН)2 = СuО + Н2О; СаСО3 = СаО + СО2;
2КNО3 = 2КNО2 + О2; КМnО4 = К2МnО4 + МnО2 + О2.
Наступний тип – реакції заміщення. Це такі реакції, у результаті яких атоми простої речовини заміщують атоми якого-небудь елемента в складній речовині. (Слайд 8)
Схематично ці процеси можна записати так:
А + ВС = АС + В
Прикладом таких процесів є реакції, що характеризують властивості металів.
Закінчити можливі рівняння реакцій:
2АІ + Fe2О3 = АІ2О3 + 2Fe; Zn + 2НСІ = ZnСІ2 + Н2↑;
Zn + NaСІ ≠; Fe + СuSО4 = FeSО4 + Сu; 2Na + 2Н2О = 2NaОН + Н2↑.
І останній тип реакцій за цією класифікацією – реакції обміну. Це реакції, під час яких дві складні речовини обмінюються своїми частинами. (Слайд 9)
Схематично ці процеси можна записати так:
АВ + СD = АD + СВ
а) реакції нейтралізації:
NаОН + НNО3 = NaNО3 + Н2О;
б) реакції між лугами та солями:
СuSО4 + 2КОН = Сu(ОН)2↓ + К2SО4
V. Закріплення нового матеріалу
Ми розглянули усі чотири типи реакцій за даною характеристикою.
Тому ми виконаємо завдання за підручником І варіант – завдання 1, ІІ варіант – завдання 2, ІІІ варіант – завдання 3. (Слайд 10)
Валеохвилинка. Перегляд мультфільму.(24,31)
А зараз давайте трішки відпочинемо та прослухаємо історію із Біблії. (Слайд 11)
Одного разу, як розповідає Біблія пророк Мойсей пас овець і побачив, «що терновий кущ горить вогнем, але не згоряє».

Серед синайських пісків росте чагарник диптам, який у тих місцях називають «кущем Мойсея». 1960р. польські вчені виростили цю рослину в заповіднику, й одного спекотного літнього дня вона дійсно «спалахнула» блакитнувато-червоним полум’ям, сама залишаючись при цьому неушкодженою. Дослідження показали, що чагарник диптам виділяє леткі ефірні олії. У тиху безвітряну погоду концентрація цих легкозаймистих олій у повітрі навколо куща різко підвищується й під дією прямого сонячного світла вони спалахують і швидко згоряють із виділенням енергії, в основному, у вигляді світла. Сам кущ при цьому залишається цілим та неушкодженим.
Скажіть до якого типу реакції ми можемо віднести дану? (екзотермічна)
Давайте пригадаємо як правильно розчиняти кислоти у воді. (Слайд 12)
Демонстрація: Розчинення концентрованої кислоти у воді. (екзотермічна)
Зараз вашій увазі пропоную переглянути відео ролики хімічних реакцій. У вас на партах є картки з ознаками, користуючись даними картками потрібно дати характеристику переглянутим реакціям.
Перегляд відео-фрагментів з подальшим коментуванням реакцій. (Слайд 13-15)
VІ. Підсумок уроку.
Таким чином, на сьогоднішньому уроці ми з вами дізналися про різноманітність хімічних процесів, які нас оточують, навчилися визначати типи хімічних реакцій за рівнянням хімічного процесу.
Проблемне запитання. (Слайд 16)
Тож давайте повернемося до стародавнього Єгипту на бенкет до Клеопатри.
Цей історичний факт свідчить про те, що Клеопатра була мудрою не лише життєвим досвідом, а й дещо знала про властивості перлів. Хімічно ці дорогоцінні скарби моря є не чим іншим, як карбонатом кальцію. Він взаємодіє з оцтовою кислотою і утворює нейтральний розчин, який цілком безпечно можна вживати.
А тепер мені хотілося б почути вашу відповідь на дані запитання. (Слайд 17)
- Що нового дізналися?
- Що сподобалося?
- Які виникли труднощі?
VІІ. Домашнє завдання. (Слайд 18)
- Опрацювати § 13.
- Опрацювати конспект.
- Виконати завдання 5 стор. 85.
Дякую за увагу! До побачення.
1
-
Дякую


про публікацію авторської розробки
Додати розробку
