Олімпідні завдання з хімії
Олімпіадні завдання з хімії для ІІ тапу Всеукраїнської олімпіади допоможуть учням підготуватися до олімпіади,визначитися з труднощями.які можуть виникнути при підготовці до олімпіади,навчитися розвязувати різнорівневі завдання,при цьому розвивається кмітливість,логічне мислення,інтерес до вивчення хімії.Хімія-наука експериментальна,тому в цих завданнях включені і практичні завдання,які потребують навичок хімічного експерименту.Хімічний експеримент є невідємною частиною уроку хімії.Тому вчителю слід доцільно включити до структури уроку експериментальні завдання.За практичний тур на олімпіадах з хіміх учні можуть набрати чималу кількість дуже гарних балів,чим можуть випередити своїх суперників.Хімію вивчай охоче,і в халепу ти не вскочиш.Знатимеш про неї все,,вона користь принесе...Тож гарної вам підготовки і перемоги на хімічній олімпіаді.
 Завдання ІІ етапу
Завдання ІІ етапу
Всеукраїнської олімпіади з хімії
2016-2017 н. р.
7 клас
І. У завданнях 1-10 необхідно вибрати одну правильну відповідь. Оцінюється в 1 бал
|
1. |
Різниці між тілами живої і неживої природи немає на рівні: а) молекул; б) речовини; в) клітин; г) атомів. |
|
|
2. |
Якщо атом приєднує електрон він перетворюється: |
|
|
|
а) інший атом; б) позитивно заряджений йон; в) інший хімічний елемент; г) негативно заряджений йон. |
|
|
3. |
У періодичній системі всі хімічні елементи розміщені за: |
|
|
|
а) зростанням атомної маси; б) зростанням заряду ядер атомів; в) зростанням металічних властивостей хімічних елементів; г) зростанням валентності. |
|
|
4. |
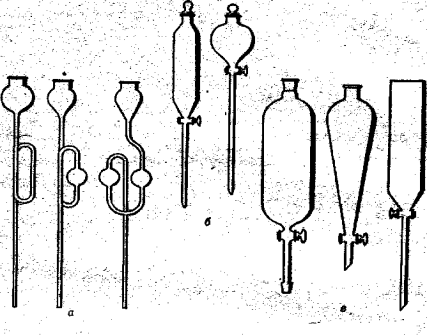
На малюнку зображено: а) лійки; б) лійки лабораторні; в) ділильні лійки; г) склянні трубки.
|
|
|
5. |
Виберіть рядок де зазначені чисті речовини: |
|
|
|
а) граніт, кухонна сіль, річкова вода; б) повітря, ртуть, чай; в) кисень, дистильована вода; сірка; г) залізобетон, парафін, кока-кола. |
|
|
6. |
Укажіть, заряд ядра атома Феруму: |
|
|
|
а) |
+56; б) +16; в) +32; г) -56. |
|
7. |
Укажіть елемент за вказаною адресою: 2 період, ІІІ група, головна підгрупа: |
|
|
|
а) |
Бор; б) Берилій; в) Алюміній; г) Магній.
|
|
8. |
Маса атома Нітрогену в порівнянні з масою атома Феруму: |
|
|
|
а) |
менша у 2 рази; б) однакова; в) менша у 4 рази; г) більша у 4 рази. |
|
9.
|
Скільки простих речовин записано формулами: Na2CO3, H2, NH3, O2, O3, K . а) 2 ; б) 3 ; в) 4 ; г) 5. Визначте формулу сполуки, в якій значення валентності Хлору є найвищим: а) HCl ; б) Cl2O3 ; в) AlCl3 ; г) Cl2O7 . |
|
|
10. |
||
ІІ. Завдання 11-15 мають на меті становлення відповідності, розташування формул у тому чи іншому порядку, для чого необхідно заповнити таблицю, вписати в неї відповідні букви або цифри. Правильна відповідь на кожне запитання – 2 бали.
|
11. |
Установіть послідовність дій при розділення суміші цукру, олії, води, піску: |
||||||||||||||||||||||||
|
а) фільтрування; б) відстоювання; в) випарювання; г) перегонка; д) кристалізація. |
|
|
|
|
|
||||||||||||||||||||
|
12. |
Установіть відповідність між поняттям та його визначенням: |
||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||
|
1. |
індекс |
|
а) |
позначення атома, молекули, йона або речовини за допомогою символів хімічних елементів та індексів |
|
|
1. |
|
|
|
|||||||||||||||
|
|
|
|
|||||||||||||||||||||||
|
2. |
коефіцієнт |
|
б) |
здатність атома сполучатися з певною кількістю таких самих або інших атомів |
|
|
2. |
|
|
|
|||||||||||||||
|
|
|
|
|||||||||||||||||||||||
|
3. |
валентність |
|
в) |
цифра, що вказує кількість атомів у молекулі |
|
|
3. |
|
|
|
|||||||||||||||
|
|
|
|
|||||||||||||||||||||||
|
4. |
хімічна формула |
|
г) |
число, яке показує кількість молекул або окремих атомів даної речовини |
|
|
4. |
|
|
|
|||||||||||||||
|
13. |
Установіть відповідність з одного боку між атомом хімічного елемента і простою речовиною та з другого характеристиками, які їм відповідають: |
||||||||||||||||||||||||
|
|
а) |
атом хімічного елемента |
б) |
проста речовина |
|||||||||||||||||||||
|
|
1 |
Символ |
6 |
Температура кипіння |
|||||||||||||||||||||
|
2 |
Агрегатний стан |
7 |
Валентність |
||||||||||||||||||||||
|
3 |
Атомна маса |
8 |
Колір |
||||||||||||||||||||||
|
4 |
Молекулярна маса |
9 |
Заряд ядра |
||||||||||||||||||||||
|
5 |
Густина |
10 |
Блиск |
||||||||||||||||||||||
|
а |
|
|
|
|
|
|
б |
|
|
|
|
|
14. Установіть відповідність між назвами хімічних елементів і назвами простих речовин:
|
Назва простої речовини неметалу |
Назва і символ хімічного елемента |
||
|
1) Азот |
а) Сульфур (S) |
1 |
|
|
2) Вуглець |
б) Нітроген (N) |
2 |
|
|
3) Водень |
в) Оксиген (O) |
3 |
|
|
4) Сірка |
г) Карбон (C) |
4 |
|
|
5) Кисень |
д) Гідроген (H) |
5 |
|
15. Установіть відповідність між відносною молекулярною масою та хімічною формулою:
|
Хімічна формула |
Відносна молекулярна маса |
|
|
|
1) CH4 |
а) 98 |
|
|
|
2) H2SO4 |
б) 32 |
|
|
|
3) Mg(OH)2 |
в) 58 |
|
|
|
|
г) 16 |
|
|
ІV. Завдання 21-25 із відкритою відповіддю і передбачають записи розв’язання розрахункових та експериментальних задач, розрахунків, міркувань.
|
16. |
Розрахуйте масову частку Натрію у сполуці Na2O. ( 3бали)
|
||
|
17. |
Перетворіть схеми на рівняння реакцій : (4 бали) а) Na + H2 → NaH б) Al + Cl2 → AlCl3 в) P + O2 → P2O5 г) KClO3 → KCl + O2 |
||
|
18. |
Що легше : два атоми Оксигену чи три атоми Нітрогену? Зробіть необхідні обчислення. (5 балів) |
||
|
19. |
Масова частка елементу Х в речовині складу ХСО3 становить 40%.
|
||
|
20. |
Маса молекули фосфору дорівнює 205,84 ∙10-24г. Із скількох атомів фосфору вона складається? Яку валентність може проявляти елемент Фосфор? Чи міститься цей елемент у живій природі? Наведіть приклади.(10 балів) |
||
|
|
|
||

про публікацію авторської розробки
Додати розробку