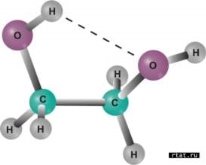
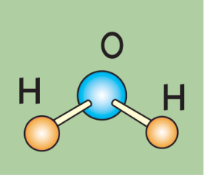
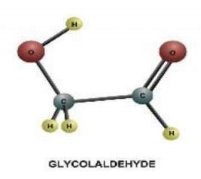
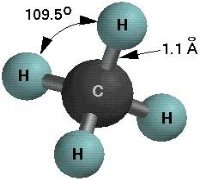
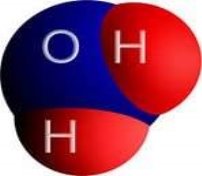
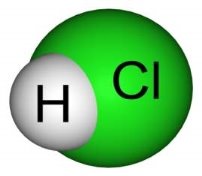
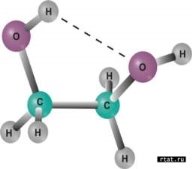
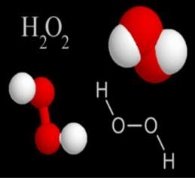
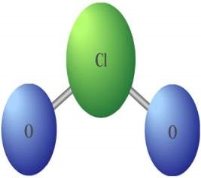
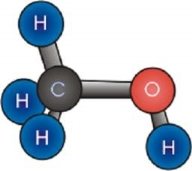
Дидактичні матеріали з хімії
Зміст
| Вступ | |
| Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі. Короткі відомості з історії хімії…………….. | 5 |
| Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом……………. | 5 |
| Тема 1 Початкові хімічні поняття | |
| Фізичні тіла. Матеріали. Речовини. Молекули. Атоми. Як вивчають речовини. Спостереження й експеримент у хімії………… | 9 |
| Фiзичні властивості речовин. Чисті речовини і суміші (однорідні, неоднорідні). Способи розділення сумішей…………..…..…………. | 10 |
| Атом, його склад. Хімічні елементи, їхні назви і символи. Періодична система хімічних елементів Д.І. Менделєєва. Структура періодичної системи………………………………………. | 15 |
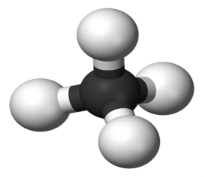
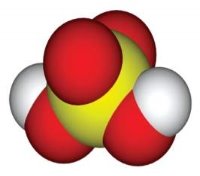
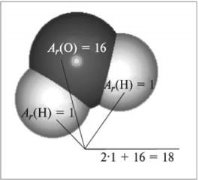
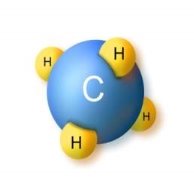
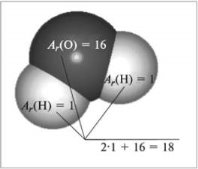
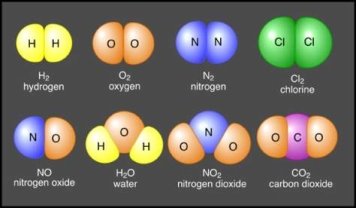
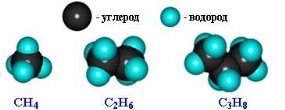
| Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів.Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин……………………………………………... | 16 |
| Метали й неметали. Металічні та неметалічні елементи, їх розміщення в періодичній системі………………………………….… | 21 |
| Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук. Зв'язок між розміщенням елемента у періодичній системі та його валентністю. | 24 |


Дидактичні матеріали
(за новим Державним стандартом базової і повної загальної середньої освіти)

Зміст
|
Вступ |
|
|
Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі. Короткі відомості з історії хімії…………….. |
5
|
|
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом……………. |
5 |
|
Тема 1 Початкові хімічні поняття |
|
|
Фізичні тіла. Матеріали. Речовини. Молекули. Атоми. Як вивчають речовини. Спостереження й експеримент у хімії………… |
9
|
|
Фiзичні властивості речовин. Чисті речовини і суміші (однорідні, неоднорідні). Способи розділення сумішей…………..…..…………. |
10
|
|
Атом, його склад. Хімічні елементи, їхні назви і символи. Періодична система хімічних елементів Д.І. Менделєєва. Структура періодичної системи………………………………………. |
15
|
|
Маса атома. Атомна одиниця маси. Відносні атомні маси хімічних елементів.Хімічні формули речовин. Прості та складні речовини. Багатоманітність речовин……………………………………………... |
16
|
|
Метали й неметали. Металічні та неметалічні елементи, їх розміщення в періодичній системі………………………………….… |
21
|
|
Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук. Зв'язок між розміщенням елемента у періодичній системі та його валентністю. |
24
|
|
Відносна молекулярна маса, її обчислення за хімічною формулою. |
25
|
|
Масова частка елемента в складній речовині………………………. |
28
|
|
Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин……………………… |
28
|
|
Самостійна робота з теми «Початкові хімічні поняття»……………. |
32 |
|
Тема 2 Кисень |
|
|
Повітря, його склад…………………………………………………….. |
34 |
|
Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню……. |
34 |
|
Закон збереження маси речовин під час хімічних реакцій. Схема хімічної реакції. Хімічні рівняння…………………………………… |
35
|
|
Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню…………… |
36
|
|
Хімічні властивості кисню: взаємодія з простими речовинами (вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення… |
37
|
|
Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання)………………………………………………………………… |
38
|
|
Взаємодія кисню зі складними речовинами (повне окиснення метану, гідроген сульфіду, глюкози)…………………………………. |
39
|
|
Умови виникнення та припинення горіння. Маркування небезпечних речовин…………………………………………………. |
40
|
|
Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування та біологічна роль кисню……………………………… |
41
|
|
Самостійна робота з теми «Кисень»………………………………….. |
42 |
|
Тема 3 Вода |
|
|
Вода, склад її молекули, поширеність у природі, фізичні властивості. Вода – розчинник ………………………………………. |
45
|
|
Розчин і його компоненти: розчинник, розчинена речовина……… |
45
|
|
Кількісний склад розчину. Масова частка розчиненої речовини. Виготовлення розчину……………………………………………….. |
46
|
|
Взаємодія води з оксидами. Поняття про гідрати оксидів: кислоти й основи. Поняття про індикатори…………………………………… |
47
|
|
Значення води і водних розчинів у природі та житті людини. Кислотні дощі. Проблема чистої води. Охорона водойм від забруднення. Очищення води на водоочисних станціях та в домашніх умовах………………………………………………………. |
49
|
|
Література……………………………………………………………… |
50 |
Вступ
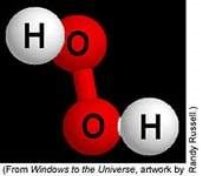
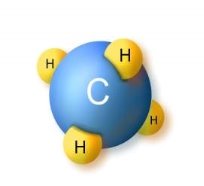
Хімія — природнича наука. Речовини та їх перетворення у навколишньому світі. Короткі відомості з історії хімії.
Тестові завдання
1. Що вивчає хімія?
а) поширеність і міграцію хімічних елементів на Землі;
б) фізичні тіла та їх властивості;
в) речовини та їх перетворення;
г) хімічний склад і структуру сполук, які містяться в живих організмах.
2. Що вивчає хімія?
а) поведінку атомів і молекул в різних умовах;
б) перетворення різних елементів;
в) речовини і закони їхніх перетворень;
г) перетворення одного фізичного тіла на інше.
3. Яке з тверджень є неправильним:
а) хімія є експериментальною наукою;
б) хімія є галуззю природознавства;
в) хімія є технічною наукою;
г) хімія є точною наукою.
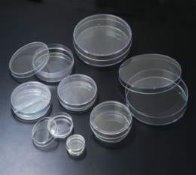
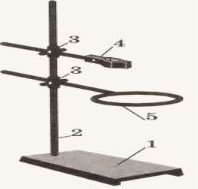
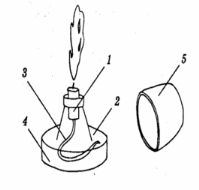
Правила поведінки учнів у хімічному кабінеті. Ознайомлення з обладнанням кабінету хімії та лабораторним посудом.
Фотозавдання
|
1.Назвіть обладнання кабінету хімії, яке зображене на малюнках. У яких випадках використовують дане обладнання? |
||
|
|
|
|
|
А |
Б |
В |
|
2.Назвіть хімічний посуд, який зображений. В яких цілях його використовують? |
||
|
|
|
|
|
А |
Б |
В |
|
3.Назвіть хімічний посуд, який зображений. В яких цілях його використовують? |
||
|
|
|
|
|
А |
Б |
В |
|
4.Назвіть хімічний посуд, який зображений. В яких цілях його використовують? |
||
|
|
|
|
|
А |
Б |
В |
|
5.У яких випадках пробірка закріплена відповідно до правил техніки безпеки. Поясніть свій вибір. |
|
|
|
|
|
А |
Б |
|
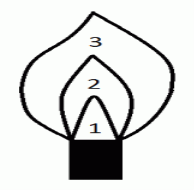
6.Позначте сладові частини полум`я, штатива та спиртівки позначені на малюнках. |
||
|
|
|
|
|
А |
Б |
В |
Тема 1 Початкові хімічні поняття
Фізичні тіла. Матеріали. Речовини. Молекули. Атоми.
Як вивчають речовини. Спостереження й експеримент у хімії.
Тестові завдання
1. Яке з тверджень є неправильним:
а) молекула – нейтральна частинка;
б) молекула – найменша частинка речовини;
в) молекула – елементарна частинка;
г)молекула відбиває хімічні властивості речовини.
2. Яке з тверджень є правильним:
а) атом – найменша частинка речовини;
б) атом – найменша частинка хімічного елемента;
в) атом – найменша частинка молекули;
г) атом – найменша частинка маси.
3. Встановіть відповідність між тілами та хімічними речовинами, якими вони утворені:
1. цвях а) деревина;
2. свічка б) скло;
3. стілець в) залізо;
4. ваза г) парафін.
Фотозавдання
|
1.Виберіть правильне закінчення твердження – «До речовин не належить …». |
||
|
|
|
|
|
А |
Б |
В |
|
2.Назвіть прилади, які використовують для спостереження. |
||
|
|
|
|
|
А |
Б |
В |
Фiзичні властивості речовин. Чисті речовини і суміші
(однорідні, неоднорідні). Способи розділення сумішей.
Тестові завдання
1. У якому ряду містяться лише чисті речовини?
а) кисень, повітря, вуглекислий газ;
б) дистильована вода, водень, цукор;
в) мінеральна вода, мідь, кухонна сіль;
г) граніт, азот, питна сода.
2. Позначити відповіді – «ч», якщо йдеться про чисту речовину; «с» - якщо йдеться про суміш:
а) мідний дріт; г) фосфор;
б) ґрунт; ґ) морська вода;
в) дистильована вода; д) повітря.
3. Позначте чисті речовини і суміші:
а) морська вода; д) срібло;
б) водень; е) латунь;
в) мідь; є) мармур;
г) повітря; ж) сірка.
ґ) глюкоза; з) ґрунт
4. Як розділити суміш:
а) пісок і тирса; г) рослинна олія + вода + сіль;
б) залізо і сода; ґ ) залізний порошок + вода + пісок;
в) сіль + вода + крейда; д) тирса + вода + спирт.
5. Як розділити такі суміші:
а) пісок і розтерте деревне вугілля; в) порошку крейди та кухонну сіль;
б) пісок і кухонну сіль; г) цукру й деревного вугілля
Фотозавдання
|
1.Вкажіть агрегатний стан води на кожному малюнку. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Вкажіть агрегатний стан води на кожному малюнку. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В
|
|
4.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
5.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
6.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
7.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
8.Вкажіть агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
9.Назвіть речовини зображені на малюнках? Визначте агрегатний стан речовин. Опишіть фізичні властивості цих сполук. |
||
|
|
|
|
|
А |
Б |
В |
|
10.Визначте чисті речовини та суміші. Свою думку обґрунтуйте. |
||
|
|
|
|
|
А |
Б |
В |
|
11.Визначте чисті речовини та суміші. Свою думку обґрунтуйте. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
12.Назвіть запропоновані способи розділення сумішей. Поясніть суть кожного з них. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
13.Назвіть запропоновані способи розділення сумішей. Поясніть суть кожного з них. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
14.Визначте чисті речовини та суміші на поданих малюнках. Свою думку обґрунтуйте. |
||
|
|
|
|
|
А |
Б |
В |
|
15.Визначте чисті речовини та суміші на поданих малюнках. Свою думку обґрунтуйте. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
|
16.Визначте чисті речовини та суміші на поданих малюнках. Свою думку обґрунтуйте. |
|||||
|
|
|
|
|||
|
А |
Б |
В |
|||
Атом, його склад. Хімічні елементи, їхні назви і символи.
Періодична система хімічних елементів Д.І. Менделєєва.
Структура періодичної системи.
Тестові завдання
1. Напшіть назви наступних хімічних елементів:
H, N, F, O, Na, Mg, Al, P, Cl, Ca, Fe, Zn, Cu.
2. Установіть відповідність між символом хімічного елемента та його назвою:
1. О а) Карбон;
2. С б) Флуор;
3. Са в) Кальцій;
4. F г) Оксиген.
3. Що таке «атом»?
а) це найдрібніша частинка речовини, що зберігає її властивості;
б) найдрібніша частинка речовини, що має позитивний заряд;
в) хімічно неподільна електронейтральна частинка речовини;
г) найдрібніша частинка речовини, що має негативний заряд.
4. З чого складається атом?
а) з протонів і нейтронів; в) з протонів і електронів;
б) з ядра і електронної оболонки; г) з нейтронів і електронів.
5. З чого складається ядро?
а) з протонів і електронів; в) з протонів, нейтронів і електронів;
б) з протонів і нейтронів; г) з нейтронів і електронів.
6. Скільки електронів має атом Оксигену?
а) 8 б) 16 в)15 г) 7
7. Скільки нейтронів має ядро атома Фосфору?
а) 15 в) 31
б) 30 г) 16
8. Яка з частинок має позитивний заряд?
а) нейтрон в) протон
б) електрон г) атом
9. Яка з частинок має негативний заряд?
а) протон в) електрон
б) катіон г) нейтрон
10. У III періоді, IV групі, головній підгрупі знаходиться хімічний елемент:
а) Ga; в) Si;
б) Sc; г) Al.
11. Заповнити таблицю:
|
Назва елементу |
Символ елементу |
Відносна атомна маса |
Номер періоду |
Номер групи |
Порядковий номер |
|
Натрій |
|
|
|
|
|
|
|
|
27 |
|
|
|
|
|
|
|
|
|
45 |
Маса атома. Атомна одиниця маси.
Відносні атомні маси хімічних елементів.
Хімічні формули речовин. Прості та складні речовини.
Багатоманітність речовин.
Тестові завдання
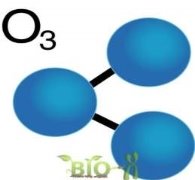
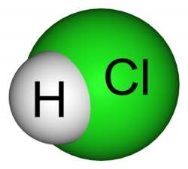
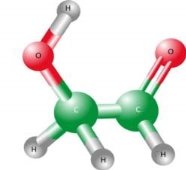
1. Виберіть формули простих речовин: а) H2, б)HCl, в)O3, г)N2, д)N2O
а) а,в в) а, в, г
б) в,г г) б,д
2. У якому ряду є лише складні речовини?
а) Cu, H2O, HCl, H2SO4;
б) H2, Cl2, O2, O3, Al;
в) H2O, CaO, Cu, H3PO4;
г) HCl, H2O, H2SO4, NaOH.
3. З поданих нижче речовин випишіть окремо формули простих та складних:
а) Fe, H2O, CO2, H2, Al, CaC2, NaCl, N2;
б) MgO , Zn, SO2, Br2, N2O5, P, PH3.
4. Що означають вирази?
3Al, 8O3, 6CO2, 4N2, C, 6F2, SiO2, 2H, 2H2.
5. Позначити відповіді – «п», якщо записана хімічна формула простої речовини; «с» - якщо складної:
а) N2; г) Mg;
б) HNO3; ґ) PH3;
в) FeS2; д) PH3.
6. Напишіть формули речовин, до складу яких входять:
а) три атоми Калію,один атом Фосфору. чотири атоми Оксигену;
б) два атоми Натрію,один атом Силіцію,три атоми Оксигену;
в) чотири атоми Гідрогену,два атоми Фосфору,сім атомів Оксигену.
7. Вкажіть відносну атомну масу Натрію:
а) 11; в) 22;
б) 23; г) 3.
8. Опишіть якісний і кількісний склад молекули за хімічною формулою:
а) Al2O3; в) H3PO4;
б) H2SO4; г) C6H12O6.
9. Для позначення трьох молекул води використовують запис:
а) Н2О; б) 3Н2+О; в) 3Н2; г) 3Н2О.
10. Для позначення шести атомів Гідрогену використовують запис:
а) 3Н2; б) 2Н3; в) 6Н2; г) 6Н.
11. Установіть відповідність:
1. три молекули водню а) 3Н;
2. три вільні атоми Гідрогену б) NH3;
3. три атоми Гідрогену, що входять в) 3H2;
до складу речовини.
12. Установіть відповідність для запису 5СН4:
1. 4; а) коефіцієнт;
2. 20; б) загальне число атомів Гідрогену;
3. 5; в) число атомів Карбону в одній молекулі;
г) індекс.
Фотозавдання
|
1.Вкажіть кількісний і якісний склад запропонованих формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
2.Вкажіть кількісний і якісний склад запропонованих формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
3.Вкажіть загальну кількість різних атомів у запропонованих молекулах речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
4.Вкажіть загальну кількість різних атомів у запропонованих молекулах речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
5.Вкажіть загальну кількість різних атомів у запропонованих молекулах речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
6.Складіть формули речовин за малюнками. Опишіть якісний і кількісний склад молекул. |
||
|
|
|
|
|
А |
Б |
В |
|
7.Складіть формули речовин за малюнками. Опишіть якісний і кількісний склад молекул. |
||
|
|
|
|
|
А |
Б |
В |
|
8.Вкажіть літери, де зображені формули: а)простих речовин; б)складних речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
9. Вкажіть літери, де зображені формули: а) простих речовин; б)складних речовин: |
||
|
|
|
|
|
А |
Б |
В |
Метали й неметали.
Металічні та неметалічні елементи, їх розміщення в періодичній системі.
Тестові завдання
1. Виберіть рядок, у якому перелічені символи атомів металічних елементів:
а) Na, P, S, Cu, Al, H; в) C2, Br, P, S, Al, Mg;
б) Na, Ca, Al, Zn, Fe, K; г) H, K, Ca, Ba, Se, Si.
2. Виберіть рядок, у якому перелічені символи атомів неметалічних елементів:
а) Li, Na, Ca, Si, C, H; в) Si, C, H, Cl2, P, O;
б) Cr, Mn, Fe, O, C, H; г) Zn, Al, Cl, P, S, Na.
3. Позначте характерні риси металів:
а) пластичність; в) рідкий агрегатний стан;
б) золотистий колір; г) не проводять теплоту.
4. Виберіть підгрупу хімічних елементів, до яких не входять металічні елементи:
А) ІІІА; б) VБ; в) VІІІА; г) VІІБ.
Фотозавдання
|
1.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||||
|
|
|
|
||
|
А |
Б |
В |
||
|
3.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||||
|
|
|
|
||
|
А |
Б |
В |
||
|
4.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
5.Метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
6.Вкажіть метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
7.Вкажіть метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
|
8.Вкажіть метали чи неметали зображено на малюнках? Опишіть їх фізичні властивості. |
||
|
|
|
|
|
А |
Б |
В |
Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук. Зв'язок між розміщенням елемента
у періодичній системі та його валентністю.
Тестові завдання
1.Визначте і запишіть валентність хімічних елементів над символами, де їх валентність невідома (позначена за Х):
I х II х х II х х II х I х х х х II х х х х
FeBr3, Mg3N2, Mn2O7, SnO2, CuS, Cu2S, Cl2O7, Na2S, CH4, SnO
2.Складіть формули бінарних сполук за визначеною над символами хімічних елементів валентністю:
III II II III I IV II III II I II I I II II IV
Cr S, HS, Al І, C S, P O, MnCl, CaH, NaI, CaS, Si O
3.Обчисліть валентності елементів у їх сполуках з Оксигеном:
а) CO; г) NO2;
б) N2O; ґ) SO2;
в) WO3; д) B2O3.
4. Визначте ряд, в якому всі хімічні елементи мають сталу валентність:
а) Na, Cu, Zn, O, H; в) K, H, Ba, O, Al;
б) K, O, Fe, H, Cl; г) Ca, Zn, Si, P, O.
5. Визначте ряд, в якому всі хімічні елементи можуть мати валентність ІІ:
а) Mg, C, Cl, O, Al; в) Ba, Cu, Ca, O, C;
б) Cu, H, C, O, Fe; г) Al, O, Zn, Na, P.
6.Виправте помилки у формулах:
А1О, Р2О4, ZnО2, NаС12, CsF2, AgBr3, НI, SiН3.
7.Установіть відповідність між вказаною валентністю та сполуками:
1. N (I) a) NH3;
2. N (III) б) NO2;
3. N (IV) в) NO;
г) N2O.
8. Установіть відповідність між вказаною валентністю елемента та сполуками:
1. S (II) а) SO3;
2. S (IV) б) H2S;
3. S (VI) в) SO2;
9. Вкажіть сполуку у якій валентність елемента, сполученого з Оксигеном, найвища:
а) Н2О; б) СаО; в) РbO2; г) CrO3; ґ) Br2O7
10. В якій із сполук валентність елемента, сполученого з Гідрогеном, найнижча:
а) Н2О; б) NH3; в) НI; г) SiH4
11. Визначіть відповідність елемента в сполуках з Оксигеном та його валентності:
1. CrO3 а) І
2. K2O б) ІІ
3. SO2 в) ІІІ
4. MgO г) ІV
д) VI
Відносна молекулярна маса, її обчислення за хімічною формулою.
Тестові завдання
1. Чому дорівнює відносна молекулярна маса натрій сульфату Na2SO4?
а) 71; в) 376;
б) 142; г) 94.
2. Обчисліть відносну молекулярну масу наступних речовин:
H2SO4, CaF2, SiO2, H2CO3.
3. Позначте значення Mr (СаСО3):
а) 204; в) 200;
б) 100; г) 120.
4. Позначте значення Mr (K2SO4):
а) 167; в) 87;
б) 174; г) 204.
5. У якому ряду речовини розміщені в порядку зростання їх відносних молекулярних мас?
а) O2, H2O, H2S, H2; в) H2O, H2S, H2, O2;
б) O2, H2S, H2, H2O; г) H2, H2O, O2, H2S.
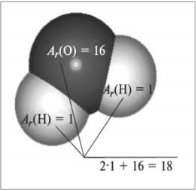
Фотозавдання
|
1.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
|
2.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
|
3.Беручи до уваги перший малюнок з розрахунками, обчисліть відносні молекулярні маси формул речовин Б і В: |
||
|
|
|
|
|
А |
Б |
В |
|
4.Обчисліть відносні молекулярні маси запропонованих формул речовин. |
|
|
|
|
|
А |
Б |
|
5.Обчисліть відносні молекулярні маси наступних формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
|
6.Обчисліть відносні молекулярні маси наступних формул речовин: |
||
|
|
|
|
|
А |
Б |
В |
Масова частка елемента в складній речовині.
Тестові завдання
1. Знайдіть помилку при обчисленні відносних молекулярних мас та масових часток елементів у речовинах:
а) Mr(ZnS) = 99 в) Mr(Ca3P2) = 182
ω(Zn) = 67 % ω(Са) = 68 %
ω(S) = 33 % ω(Р) = 32 %
б) Mr(Al4C3 ) = 141 г) Mr(CH4 ) = 16
ω(Al) = 75 % ω(С) = 70 %
ω(С) = 25 % ω(Н) = 30 %
2. Обчисліть масову частку Оксигену у речовині K2ClO3.
3. Обчисліть масову частку Нітрогену в речовині NaNO2.
Фізичні та хімічні явища. Хімічні реакції та явища, що їх супроводжують. Хімічні властивості речовин.
Тестові завдання
1. Позначити відповіді – «ф», якщо йдеться про фізичне явище; «х», якщо йдеться про хімічне явище:
а) випаровування води; г) танення криги;
б) обвуглення скалки; ґ) скисання молока;
в) іржавіння цвяха; д) горіння вугілля.
2. Вибрати хімічні явища:
1)іржавіння заліза; 2)плавлення парафіну; 3)випаровування води; 4)горіння сірки; 5)фотосинтез; 6)утворення сніжинок:
а) 1, 2, 4 в) 4, 5, 6
б) 1, 4 г) 1, 4, 5
3. Вкажіть властивість, що не є ознакою хімічної реакції:
а) зміна забарвлення; в) виділення температури;
б) зміна агрегатного стану; г) виділення газу.
4. Встановіть відповідність між явищем та ознакою, якою супроводжується таке хімічне перетворення:
1. горіння бензину а) виділення тепла;
2. гасіння вапна б) виділення бульбашок газу;
3. взаємодія питної соди та оцту в) виділення світла і тепла.
Фотозавдання
|
1.Із запропонованих природних явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
4.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
5.Із запропонованих явищ оберіть фізичні та хімічні. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
6.Які ознаки хімічних явищ продемонстровано на малюнках? |
||
|
|
|
|
|
А |
Б |
В |
|
7.Які ознаки хімічних явищ продемонстровано на малюнках? |
||
|
|
|
|
|
А |
Б |
В |
Самостійна робота з теми «Початкові хімічні поняття»
Варіант І
1. Прості речовини — це...
2. Відносна атомна маса Сульфуру:
а) 16; б) 32; в) 8.
3. Про кисень як просту речовину йдеться в реченні:
а) кисень входить до складу повітря;
б) крейда — складна речовина, що містить Оксиген.
4. У III періоді, V групі, головній підгрупі знаходиться хімічний елемент:
а) Y; б) In; в) P.
5. Із запропонованого переліку виберіть формули простих речовин:
Fe(OH)3, Au, N2, H2S, F2, HCl, P2O5, S8, PbS, C, ZnO, Mg.
6. Установіть відповідність:
1. Li а) Силіцій
2. S б) Літій
3. Al в) Сульфур
4. Si г) Алюміній
7. Установіть відповідність:
1. Три молекули азоту а) 3N
2. Три вільні атоми Нітрогену б) NH3
3. Атом Нітрогену, що входить до складу речовини в) 3N2
8. Опишіть якісний і кількісний склад молекули за хімічною формулою:
а) N2O5; б) Ca(OH)2.
9. Обчисліть валентності елементів у їх сполуках з Оксигеном:
а) Ag2O; в) CrO3; д) CO2;
б) Cl2O7; г) CaО; е) As2O5.
10. Складіть формули сполук за валентністю:
Al O, K O, Са О.
Варіант ІІ
1. Атом — це...
2. Відносна атомна маса Флуору:
а) 18; б) 19; в) 9.
3. Про Арсен як хімічний елемент ідеться в реченні:
а) арсен за звичайних умов — рідкий метал;
б) до складу арсен(ііі) оксиду входить арсен.
4. У II періоді, V групі, головній підгрупі знаходиться хімічний елемент:
а) Cd; б) N; в) Sr.
5. Із запропонованого переліку виберіть формули простих речовин:
AgCl, Cl2, LiOH, C2H6, Ca, O2, Al2O3, H2SO4, Ag, Ag2O, Cu, FeS2.
6. Установіть відповідність:
1. Na а) Калій
2. N б) Натрій
3. H в) Гідроген
4. K г) Нітроген
7. Установіть відповідність:
1. Два вільні атоми Оксигену а) 2O2
2. Два атоми Оксигену в складі складної речовини б) CO2
3. Дві молекули кисню в) 2O
8. Опишіть якісний і кількісний склад молекули за хімічною формулою:
а) Fe2O3; б) HNO3.
9. Обчисліть валентності елементів у їх сполуках з Оксигеном:
а) CuО; в) SO3; д) P2O5;
б) NO; г) PbO2; е) K2O.
10. Складіть формули сполук за валентністю:
Ag O, Zn O, Nа O.
Тема 2 Кисень
Повітря, його склад.
Тестові завдання
1. Чому дорівнює об’ємна частка кисню в повітрі?
а) 23% в) 78%
б) 21% г) 0,04%
2. Чому дорівнює відносна молекулярна маса повітря?
а) 28; в) 29;
б) 32; г) 44.
3. Із запропонованих тверджень виберіть лише правильні чотири:
а) атмосферне повітря необхідне для дихання;
б) повітря – це суміш газів;
в) у складі повітря найбільше міститься кисню;
г) тепле повітря опускається вниз;
ґ) тепле повітря піднімається вгору;
д) повітря добре проводить тепло;
е) від нагрівання повітря розширюється.
Оксиген. Поширеність Оксигену в природі. Кисень, склад його молекули, поширеність у природі. Фізичні властивості кисню.
Тестові завдання
1. Укажіть правильно зазначені фізичні властивості кисню:
а) синій газ, без запаху, без смаку, легший за повітря;
б) безбарвний газ, без запаху, без смаку, важчий за повітря;
в) за звичайних умов синя рідина з приємним запахом.
2. Позначте фізичні властивості кисню за звичайних умов:
а) кристали синього кольору;
б) добре розчиняється у воді;
в) газ без запаху і смаку;
г) на кисень припадає трохи більше 1/5 об’єму повітря.
3. У чому полягає біологічна роль кисню?
а) у здатності підтримувати горіння;
б) у здатності підтримувати дихання;
в) у здатності підтримувати дихання і вступати в реакції горіння;
г) у здатності підтримувати дихання і вступати в реакції окиснення.
4. Обчисліть масову частку Оксигену в ортофосфатній кислоті H3PO4 і вкажіть правильну відповідь:
а) 16% в) 65%
б) 32% г) 33%
Закон збереження маси речовин під час хімічних реакцій.
Схема хімічної реакції. Хімічні рівняння.
Тестові завдання
1. Розставте коефіцієнти у схемі рівняння реакції і вкажіть їх суму:
MnO2 + H2SO4 = MnSO4 + O2 + H2O
а) 10 б) 9 в)5 г) 6
2. Розставте коефіцієнти у схемах і вкажіть їх суму:
а) K + O2 = K2O; д) Na2O + H2O = NaOH;
б) Na + Cl2 = NaCl; е) Na + H2 = NH3;
в) KClO3 = KCl + O2; є) Al2O3 + Fe = Fe2O3 + Al;
г) Li+ H2O = LiOH + H2; ж) Pb(NO3)2=PbO + NO2+O2;
ґ) Al + H2SO4 = Al2(SO4)3 + H2; з) SiO2 + HF = SiF4 + H2O.
3. Розставте коефіцієнти у запропонованих схемах та вкажіть суму коефіцієнтів у вихідних речовинах:
а) РЬ + О2 = РЬО; в) Аg + S = Аg2S; б) Н2 + F2 = НF; г) Lі + О2 = Li2О.
4. Складіть і прочитайте хімічні рівняння таких реакцій:
а) взаємодіїї карбону й водню з утворенням метану (СН4); б) взаємодії водню з хлором з утворенням гідроген (І) хлориду (HCl).
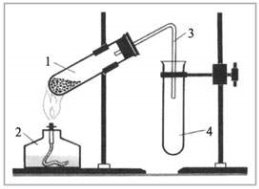
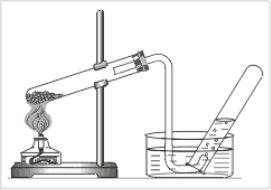
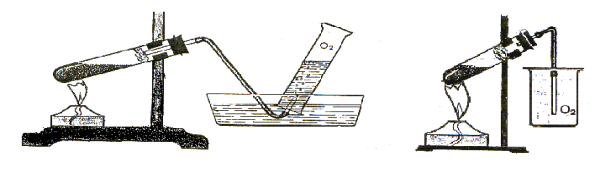
Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню.
Доведення наявності кисню.
Тестові завдання
1. Як називаються речовини, які прискорюють хімічні реакції, але не входять до складу їх продуктів?
а) ензими; в) інгібітори;
б) ферменти; г) каталізатори.
2. В одній колбі - кисень, а в іншій - повітря. Як дізнатися, у якій колбі кисень?
а) за допомогою лакмусового папірця; в) за запахом;
б) за кольором; г) за спалахуванням тліючої скіпки.
3. Установіть послідовність одержання кисню з калій перманганату:
а) заповнення пробірки калій перманганатом;
б) кріплення приладу для збирання газів у штативі;
в) під’єднання газовідвідної трубки до приладу;
г) збирання кисню витісненням води.
Фотозавдання
б) на малюнку А підпишіть складові частини приладу для збирання газів; в) на малюнку Б позначте та підпишіть складові частини приладу для збирання газів. |
|
|
|
|
|
А |
Б |
|
2.Яким методом збирають кисень на поданих малюнках? Поясніть суть кожного методу. |
|
|
|
А Б |
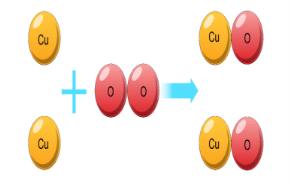
Хімічні властивості кисню: взаємодія з простими речовинами
(вуглець, водень, сірка, магній, залізо, мідь). Реакція сполучення.
- До складу оксидів входять два елементи, один з яких – Оксиген.
- Реакції горіння це окиснення, яке супроводжується виділенням теплоти
- Щоб відбулося горіння речовини потрібно її охолодити.
- Під час іржавіння заліза речовина повинна про взаємодіями з киснем.
Тестові завдання
1. Скласти рівняння реакцій за схемами:
а) В + O2 = В2О3; в) Рb + О2 = РЬО; ґ) Lі + О2 = Li2О;
б) K + O2 = K2O; г) Fe + O2 = FeO; д) Fe + O2 = Fe2O3
2. Дописати рівняння реакцій за схемами:
а) Zn + O2 = г) Fe + О2 =
б) C + O2 = ґ) P + O2 =
в) S+ О2 = д) Al + O2 =
Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання).
Тестові завдання
1. Які реакції називаються реакціями окиснення?
а) реакції горіння; в) реакції обміну;
б) взаємодія з киснем; г) реакції сполучення.
2. Які реакції називаються реакціями горіння?
а) реакції окиснення, що супроводжуються виділенням тепла і світла;
б) реакції розкладу;
в) реакції обміну;
г) реакції окиснення, що відбуваються при наявності каталізаторів.
3. Оберіть більш повне визначення поняття «оксиди»:
а) складні речовини, що містять Оксиген;
б) бінарні сполуки, що містять Оксиген;
в) бінарні сполуки;
г) складні речовини.
4. Що спільного, а що відмінного у процесах горіння та окиснення.
|
Риси |
Горіння |
Повільне окиснення |
|
Спільне |
|
|
|
Відмінне |
|
|
5. Скласти формули речовин за їх назвами:
а) калій оксид; г) карбон (ІІ) оксид; б) фосфор (V) оксид; ґ) ферум (ІІІ) оксид; в) алюміній оксид. д) нітроген (IV) оксид.
6. Заповнити таблицю:
|
Елемент |
Формула оксиду |
Назва оксиду |
|
Na |
|
|
|
C (IV) |
|
|
|
Ba |
|
|
|
Fe (III) |
|
|
|
Cl(VII) |
|
|
7. Виберіть із списку речовин формули оксидів. Розташуйте ці оксиди в ряд у міру зростання їх відносної молекулярної маси.
|
№ варіанту |
Речовини |
|
I |
H3PO4, Cu(OH)2, Na2O, HNO3, P2O5, Al2(SO4)3, KOH, SO3 |
|
II |
Fe(OH)3, CaO, SO2, H2SiO3, MgCl2, NaOH, K2O, NH3 |
|
III |
BaO, Fe(OH)2, CO2, HCl, Zn(NO3)2, Ba(OH)2, HNO3, Al2O3 |
|
IV |
Al(OH)3, MgO, Cl2O7, H2SO4, CaCl2, KOH, Na2O, H2SO3 |
|
V |
ZnO, HBr, P2O5, Cu(OH)2, Ca3(PO4)2, Ba(OH)2, SO2, H2SO4 |
8. Встановіть відповідність: Назви оксидів:
1. Сu2O; а) сульфур (VІ) оксид;
2. SO2. б) купрум (І) оксид;
в) купрум (ІІ) оксид.
Взаємодія кисню зі складними речовинами
(повне окиснення метану, гідроген сульфіду, глюкози).
Тестові завдання
1. Скласти рівняння реакцій за схемами:
а) С2Н6 + О2 = СО2 + Н2О; г) PH3 + O2 = P2O5 + H2O; б) NH3 + O2 = N2 + H2O; ґ) СS2 + О2 = СО2 + SО2; в) NН3 + О2 = NО + Н2О; д) С7Н12 + О2 = СО2 + Н2О.
2. Дописати схеми реакцій за участю кисню і перетворити їх на хімічні рівняння:
а) ZnS + O2 = г) SO2 + … = SO3
б) C2H2 + O2 = ґ) Н2S + … = … + Н2О;
в) C12H22O11 + O 2= д) РН3 + … = Р2 О5 + …;
Умови виникнення та припинення горіння.
Маркування небезпечних речовин.
Тестові завдання
1. Закінчіть речення:
а) Я знаю, що умовами виникнення горіння є:____________________. б) Я знаю, що для припинення горіння необхідно:________________. в) Я знаю, що вибух супроводжується:__________________________. г) Я знаю, що небезпечні речовини маркують:___________________.
2. Позначте умови горіння:
а) потрібно залити речовину водою;
б) наявність кисню;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина повинна бути газоподібною.
3. Позначте умови припинення горіння:
а) потрібно речовину засипати піском;
б) нагрівання речовин до температури самозаймання;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина може перебувати в будь-якому агрегатному стані.
4. Розташуйте речовини у порядку зростання їх температури займання:
а) деревина; б) папір; в) азот; д) бензин.
5. Заповніть таблицю:
|
Ознака |
горіння |
повільного окиснення |
|
Спільна |
|
|
|
Відмінна |
|
|
|
|
|
|
|
|
|
|
Фотозавдання
|
1.Опишіть методи, які використовують для припинення горіння |
||
|
|
|
|
|
А |
Б |
В |
|
2. На що вказують знаки маркування небезпечних речовин? |
||
|
|
|
|
|
А |
Б |
В |
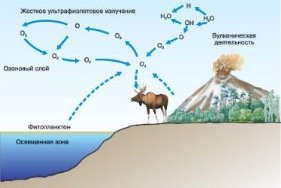
Колообіг Оксигену в природі. Озон. Проблема чистого повітря. Застосування та біологічна роль кисню.
Тестові завдання
1. Встановіть послідовність у зростанні об’ємних часток газів, компонентів повітря:
а) аргон; в) кисень;
б) вуглекислий газ; г) азот.
2. Позначте слова пропущені у фразі «… Оксиген входить до складу всіх життєво важливих органічних речовин: білків, жирів, вуглеводів»:
а) складна речовина; в) хімічний елемент;
б) алотропна модифікація; г) проста речовина.
3. Встановіть відповідність:
Застосування кисню: Властивості кисню:
- кисневі маски а) процес супроводжується
великою кількістю теплоти;
2. гниття б) повільне окиснення;
в) забезпечує дихання.
Самостійна робота з теми «Кисень»
Варіант І
І рівень
Завдання з вибором однієї правильної відповіді
1. Позначте символ хімічного елемента Оксигену:
а) О; б) О3; в) О2; г) О5.
2. Позначте, де у виразі йдеться про просту речовину, а не про елемент:
а) Оксиген входить до складу води;
б) кисень входить до складу земної кори;
в) Оксиген сприяє колообігу інших елементів;
г) Оксиген входить до складу вуглекислого газу.
3. Позначте фізичні властивості кисню за звичайних умов:
а) газ без запаху і смаку; в) добре розчиняється у воді;
б) кристали синього кольору; г) кисню в повітрі близько 21%.
4. Позначте оксид, у якого найбільша відносна молекулярна маса:
а) СО; б) SO2; в) N2O; г) Na2O.
5. Позначте умови горіння:
а) потрібно засипати речовину піском;
б) наявність кисню;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина повинна бути твердою.
6. Позначте агрегатний стан та колір продукту реакції горіння магнію в кисні:
а) газ без кольору; в) тверда речовина жовтого кольору;
б) речовина білого кольору; г) блакитна рідина.
ІІ рівень
Завдання на встановлення відповідності. До кожного рядка, позначеного цифрою, доберіть відповідник, позначений буквою.
7. Встановіть відповідність:
Формули оксидів: Назви оксидів:
- Р2О5; а) фосфор (ІІІ) оксид;
- СаО. б) фосфор (V) оксид;
в) кальцій оксид.
8. Встановіть відповідність:
Застосування кисню: Властивості кисню:
- кисневі маски; а) процес супроводжується
великою кількістю теплоти;
2. гниття. б) повільне окиснення.
в) забезпечує дихання
Завдання на встановлення послідовності.
9. Встановіть послідовність у зростанні об’ємних часток газів, компонентів повітря:
а) аргон; в) кисень;
б) вуглекислий газ; г) азот.
ІІІ рівень
10. Допишіть схеми реакцій за участю кисню, під час яких утворюється оксиди, і перетворіть їх на хімічні рівняння:
t0 t0
а) В + … = В2О3; в) Н2S + … = … + Н2О;
t0 t0
б) РН3 + … = Р2 О5 + …; г) Li + … = Li2 O.
11. Складіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
H2O → O2→CO → X.
IV рівень
12.Розв’яжіть задачу.
Складіть найпростішу формулу речовини за нижченаведеними масовими частками елементів: Карбон – 27,27%, Оксиген – 72,73%.
Варіант ІІ
І рівень
Завдання з вибором однієї правильної відповіді
1. Позначте формулу простої речовини, яка підтримує горіння:
а) О; б) СО2; в) О2; г) Н2О.
2. Позначте валентність Оксигену:
а) І; б) ІІ; в) -2; г) 2.
3. Позначте слова пропущені у фразі «… Оксиген входить до складу всіх життєво важливих органічних речовин: білків, жирів, вуглеводів»:
а) складна речовина; в) хімічний елемент;
б) алотропна модифікація; г) проста речовина.
4. Позначте фізичні властивості кисню за звичайних умов:
а) кристали синього кольору; в) газ без запаху і смаку;
б) добре розчиняється у воді; г) на кисень припадає трохи більше 1/5 об’єму повітря.
5. Позначте оксид, у якого найбільша відносна молекулярна масса:
а) СО; б) SO2; в) N2O; г) К2О.
6. Позначте умови припинення горіння:
а) потрібно речовину засипати піском;
б) нагрівання речовин до температури самозаймання;
в) спрямувати на речовину струмінь вуглекислого газу;
г) речовина може перебувати в будь-якому агрегатному стані.
ІІ рівень
Завдання на встановлення відповідності. До кожного рядка, позначеного цифрою, доберіть відповідник, позначений буквою.
7. Встановіть відповідність: Назви оксидів:
1. Сu2O; а) сульфур (VІ) оксид;
2. SO2. б) купрум (І) оксид;
в) купрум (ІІ) оксид.
8. Встановіть відповідність:
Речовина: Властивості:
1. кисень а) безбарвний газ, має запах;
2. сірчистий газ б) твердий, притягується магнітом;
в) безбарвний газ, без запаху;
Завдання на встановлення послідовності
9. Встановіть послідовність у зростанні масових часток газів, компонентів повітря:
а) аргон; в) азот;
б) вуглекислий газ; г) кисень.
ІІІ рівень
10. Допишіть рівняння хімічних реакцій згідно зі схемами, дайте назви продуктів реакцій:
а) Fe + О2 = в) C + O2 =
б) S+ О2 = г) KNO3=
11. Напишіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
КСІО3 →О2 → Fe3O4
IV рівень
12.Розв’яжіть задачу.
Складіть найпростішу формулу речовини, якщо масова частка елементів: Нітроген – 63,64%, Оксисен – 36,36%.
Тема 3 Вода
Вода, склад її молекули, поширеність у природі, фізичні властивості.
Вода – розчинник.
Тестові завдання
1. Який розчинник є найпоширенішим?
а) вода; в) бензин;
б) спирт; г) кислота.
2. Які з цих речовин розчиняються у воді:
а) AlPO4; б) NaOH; в)AgNO3; г) CuS;
ґ) NaCl; д) PbCl2; е) AgCl; є) Ca(OH)2.
3. Розчин складається з двох рідин (спирту та води). Розчинником у ньому буде:
а) вода; в) компонент, якого міститься в системі більше;
б) спирт; г) компонент, вміст якого в системі менше.
4. Вкажіть неправильне тлумачення поняття „розчинність”:
а) усі речовини розчиняються у воді однаково;
б) розчинність багатьох речовин у воді не безмежна;
в) розчинність – це характеристика здатності однієї речовини розчинятися в іншій.
Розчин і його компоненти: розчинник, розчинена речовина.
Хімічний диктант
1.Однорідні системи, які складаються з двох чи більше речовин, називаються …
2.Розчин складається із розчинника та …
3.Здатність речовини розчинятися в тому чи іншому розчиннику називається..
4.Розчинність більшості солей збільшується із….. температури.
Тестові завдання
1.Виберіть твердження, що характеризує розчин:
а) речовина у рідкому агрегатному стані;
б) однорідна суміш речовин;
в) хімічна сполука;
г) гетерогенна система, що складається з кількох речовин.
2. У водному розчині купрум (ІІ) сульфату останній є:
а) розчинником і розчиненою речовиною;в) розчинником;
б) нерозчинною речовиною; г) розчиненою речовиною.
Фотозавдання
|
1.Позначте речовини, які розчиняються у воді. |
||
|
|
|
|
|
А |
Б |
В |
|
2.Позначте речовини, які розчиняються у воді. |
||
|
|
|
|
|
А |
Б |
В |
Кількісний склад розчину.
Масова частка розчиненої речовини. Виготовлення розчину.
Тестові завдання
1. Заповніть вільні клітинки у таблиці, розв’язавши задачу, використовуючи наступні дані:
|
Ум зад. Варіант |
т (реч.) г |
т (Н2О) г |
т (р-ну) г |
W (р.р.) % |
V(р-ну) мл |
ρ (р-ну) г/мл |
|
1. |
|
|
300 |
30 |
|
1,13 |
|
2. |
20 |
180 |
|
|
|
1,07 |
|
3. |
|
|
|
25 |
500 |
1,1 |
|
4. |
30 |
270 |
|
|
|
1,14 |
|
5. |
160 |
|
|
40 |
381 |
|
|
6. |
32 |
|
|
40 |
|
1,2 |
|
7. |
|
200 |
|
10 |
|
1,02 |
|
8. |
|
|
|
30 |
600 |
1,02 |
|
9. |
50 |
|
250 |
|
238 |
|
|
10. |
60 |
240 |
|
|
|
1,12 |
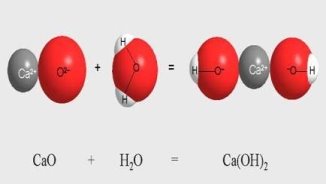
Взаємодія води з оксидами.
Поняття про гідрати оксидів: кислоти й основи. Поняття про індикатори.
Тестові завдання
1. Розставте коефіцієнти в схемах реакцій та вкажіть реакції в результаті яких: 1) утворюється основа; 2) утворюється кислота
а) P2O5 + H2O = H3PO4; ґ) Li2О + Н2О = LiOH;
б) ВаО + Н2О = Ва(ОН)2; д) Р2О5 + Н2О = НРО3;
в) Р2О5 + Н2О = Н3РО4; е) Na2O + Н2О = NaOH;
г) Сl2O7 + Н2О = НСlО4 є) N2O5 + Н2О = HNО3.
2. Яким індикатором неможливо виявити кисле середовище розчину?
а) лакмус; в) фенолфталеїн;
б) універсальний індикатор; г) метилоранж.
3. Яке забарвлення має лакмус у кислому середовищі?
а) червоне; в) жовте;
б) синє; г) фіолетове.
4. Яке забарвлення має фенолфталеїн у лужному середовищі?
а) червоне; в) малинове;
б) жовте; г) безбарвне.
5. Яке забарвлення має універсальний індикатор у кислому середовищі?
а) червоне; в) жовте;
б) синє; г) фіолетове.
6. Вибери ряд із формулами лугів:
а) NaOH, Ca(OH)2, Cu(OH)2, KOH;
б) NaOH, Sr(OH)2, Ba(OH)2, NH4OH;
в) Ca(OH)2, Cu(OH)2, Zn(OH)2, Ba(OH)2;
г)Fe(OH)3, Al(OH)3, Cr(OH)3, NH4OH.
7. Яка з формул є зайвою в ряду: NH4OH, Ca(OH)2, NaOH, Sr(OH)2, Cu(OH)2? Чому?
а) NH4OH; в) Ca(OH)2;
б) NaOH; г) Cu(OH)2.
8. У якому ряду є лише формули кислот? Чому?
а) NaCl, HCl, HNO3, KOH; в) CuS, NaOH, CuCl2, Ca(OH)2;
б) HCl, H2S, HBr, HNO3; г) NaOH, KOH, Ca(OH)2, Al(OH)3.
9. Які речовини реагують між собою? (позначити «+»). Написати відповідні реакції.
|
|
MgO |
BaO |
SO3 |
CO2 |
NaOH |
|
H2O |
|
|
|
|
|
|
|
HNO3 |
Li2O |
P2O5 |
Mg(OH)2 |
CaO |
|
H2O |
|
|
|
|
|
Фотозавдання
|
1.Беручи до уваги перше рівняння реакції, складіть рівняння реакції до другого малюнка. |
|
|
|
|
|
А |
Б |
|
2.Вкажіть назву індикатора, який використовують у кожному з випадків. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
3.Вкажіть назву індикатора, який використовують у кожному з випадків. Поясніть свій вибір. |
||
|
|
|
|
|
А |
Б |
В |
|
4.Чому відбулася зміна кольору лакмусового папірця на малюнках А і В? Про що свідчить зміна забарвлення індикатора в кожному з випадків? |
||
|
|
|
|
|
А |
Б |
В |
Значення води і водних розчинів у природі та житті людини.
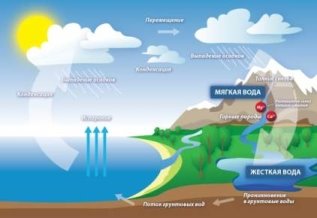
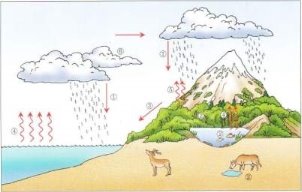
Кислотні дощі. Проблема чистої води. Охорона водойм від забруднення.
Очищення води на водоочисних станціях та в домашніх умовах.
Фотозавдання
|
1.Кругообіг яких речовин зображено на малюнках? Опишіть його. |
|
|
|
|
|
А |
Б |
|
2.Опишіть кругообіг речовин у природі. |
|
|
|
|
|
А |
Б |
Література
- Базелюк І.І. та ін. Довідкові матеріали з хімії. – Київ; Ірпінь:DNA «Перун»,1998.
- Баланюк Т., Максимов І. Зошит для практичних робіт з хімії, 8 клас. Навч. посібники, 2008.
- Буринська Н.М.Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Перун, 2008.
- Гладюк М. М. Дидактичний матеріал з хімії. 8 клас. — Тернопіль, 1999.
- Дубовик О.А., Зубарук Т.Ю., Сергуніна Р.О. Зошит для практичних робіт та тематичного оцінювання з хімії, 7 клас. К.: ЛВК, 2007.
- Дубовик О.А., Зубарук Т.Ю., Сергуніна Р.О. Зошит для практичних робіт та тематичного оцінювання з з хімії, 8 клас. К.: ЛВК, 2008.
- Задорожний К.М. Хімія: Дидактичні матеріали до курсу. 7 клас [Текст] / К.М. Задорожний. – Х.: Видавнича група «Основа», 2007. – 112 с. – (Бібліотека журналу «Хімія». Вип. 6 (54)).
- Максимов І., Баланюк Т., Берлізова О. Зошит для практичних робіт з хімії, 7 клас. К.: Навч. посібники, 2007.
- Максимов І.О., Філоненко І.О. Хімія. Визначення, закони, формули. Довідник для учнів 7-11 класів та вступників до вузів. К.: ЛВК, 2007.
- Попель П.П., Крикля Л.С. Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Академія, 2008.
- Савчин М. М. Уроки хімії у 8 класі. — Львів, 1999. Тематичне оцінювання. Хімія. Різнорівневі завдання. — Х.: Торсінг, 2005
- Старовойтова І. Ю.Усі уроки хімії. 8 клас / І. Ю. Старовойтова, О. В. Люсай. – Х.: Вид. група «Основа», 2008. – 222, [2] с. – (Серія «12-річна школа»).
- Титаренко Н.В. Тести з неорганічної хімії. – К.: Перун, 1998.
- Хімія в побуті / За ред. Коваленка І.Р. – К., 1994.
- Хімія: Довідник для абітурієнтів та школярів загальноосвітніх навчальних закладів: навчально-методичний посібник. – Літера ЛТД, 2010. – 464 с.
- Хімія - завдання та відповіді зовнішнього незалежного оцінювання 2008 року
- Хімія - завдання та відповіді зовнішнього назалежного оцінювання 2007 року
- Хомченко Г. П. Збірник задач з хімії для вступників до вищих навчальних закладів / Г. П. Хомченко, І. Г.Хомченко; Пер. з рос. – К.: Арій, 2008. – 320 с.
- Хомченко Г. П. Посібник з хімії для вступників до вищих навчальних закладів. 2-ге вид. вмправл. / Пер. з рос. – К.: Арій, 2008. – 480 с.: іл.
- Царьова Н. Хімія 8: Збірник рівневих завдань. — Тернопіль, 2004.
- Ярошенко О.Г. Хімія. Підручник для 8 класу загальноосвітніх навчальних закладів. – К.: Освіта, 2008.
Інтернет-сайти:
- mon.gov.ua;
- www.elnik.kiev.ua;
- library.tup.km.ua;
- http://chemists.at.ua;
- http://school.xvatit.com;
- http://osvita.ua
![]()
1


про публікацію авторської розробки
Додати розробку