Колігативні властивості розчинів
1
Військовий інститут танкових військ
Національного технічного університету
“Харківський політехнічний інститут”
Факультет радіаційного, хімічного, біологічного
захисту та екологічної безпеки
КУРСОВА РОБОТА
Тема роботи: Колігативні властивості розчинів
Виконав: ст. солдат Олександр Науменко
Керівник: Пр. ЗСУ Оксана Тичина
Харків – 2020
РЕФЕРАТ
Курсова робота: 30 с., рис. - 6, табл. – 2, 10 літературних джерел.
Об’єкт дослідження – колігативні властивості розчинів.
Мета роботи – провести аналіз літературних джерел із вказаної теми.
В даній роботі проведений аналіз теоретичного матеріалу, щодо становлення і досягнення найважливішої області фізичної хімії – колігативних властивостей розчинів. Розглянута загальна характеристика і фізико-хімічні кріоскопії та ебуліоскопії, їх застосування в науці та виробництві.
КРІОСКОПІЯ, ЕБУЛІОСКОПІЯ, КРІОСКОПІЧНА КОНСТАНТА, ЕБУЛІОСКОПІЧНА КОНСТАНТА, МЕТОД СИВОЛОБОВА
ЗМІСТ
ВСТУП 3
1 КРІОСКОПІЯ: СУТЬ ЯВИЩА, КІЛЬКІСНІ ЗАКОНОМІРНОСТІ 4
1.1 Суть явища 4
1.2 Кількісні закономірності 9
1.3 Застосування кріоскопії 15
2 ЕБУЛІОСКОПІЯ: СУТЬ ЯВИЩА, КІЛЬКІСНІ ЗАКОНОМІРНОСТІ 21
2.1 Суть явища 21
2.2 Кількісні закономірності 23
2.3 Застосування ебуліоскопії 26
ВИСНОВКИ 29
ПЕРЕЛІК ПОСИЛАНЬ 30
ВСТУП
Колігативні властивості розчинів (дифузія, осмос, кріоскопія, ебуліоскопія тощо) обумовлюють найважливіші аспекти життєдіяльності організму. Осмотичний тиск обумовлює розподіл води й поживних речовин між різними органами й тканинами організму. Механізм осмосу залежить від природи мембран. За рахунок вибіркової проникності мембран відбувається перенесення поживних речовин і виведення продуктів метаболізму. Вивчення осмотичних явищ показало, що в середині клітини осмотичний тиск більший, ніж у позаклітинній рідині.
Речовини, водні розчини або розплави яких проводять електричний струм, називаються електролітами (солі, кислоти, луги – речовини з іонним і ковалентним полярним зв’язком).
Речовини, водні розчини або розплави яких не проводять електричний стум, називаються неелектролітами (цукор, спирт, ацетон – речовини з ковалентним неполярним зв’язком).
Фізико-хімічні властивості розведених розчинів неелектролітів: тиск насиченої пари над розчином, температури кипіння, кристалізації та замерзання, осмотичний тиск – змінюються пропорційно концентрації розчинів.
Методи осмометрії, кріометріі та ебуліометріі використовуються для дослідження біологічних рідин, визначення їх осмоляльності, середньої молекулярної маси білка та молекулярних мас інших фізіологічно активних сполук.
Метою даної курсової роботи є літературний огляд кріоскопії та ебуліоскопії, описання їх фізико-хімічних параметрів та застосування в науці та виробництві.
1 КРІОСКОПІЯ: СУТЬ ЯВИЩА, КІЛЬКІСНІ ЗАКОНОМІРНОСТІ
- Суть явища
Розчин - однофазна, гомогенна, багатокомпонентна система змінного хімічного складу. Практично усі рідини, що є в природі, являють собою розчини.
Розчин може бути твердим, рідким або газоподібним. Найбільше практичне значення мають рідкі розчини, особливо водні. Один з компонентів розчину називають розчинником, інші - розчиненими речовинами. Звичайно розчинником вважають компонент, який міститься в надлишку порівняно з іншими компонентами. Якщо один з компонентів рідина, то саме його називають розчинником. Приклади розчинів наведені в таблиці 1.1.
Таблиця 1.1 – Приклади розчинів та розчинників
|
Стан розчину |
Стан розчинника |
Стан розчиненої речовини |
Приклад |
|
Газ Рідкий Рідкий Рідкий Твердий Твердий Твердий |
Газ Рідкий Рідкий Рідкий Твердий Твердий Твердий |
Газ Газ Рідкий Твердий Газ Рідкий Твердий |
Повітря О2 у воді Спирт у воді Сіль у воді Н2 в паладії Hg у сріблі Ag в Au |
У розчинах речовини можуть перебувати в різних ступенях дисперсності. Величина частинок є дуже важливою ознакою, яка обумовлює багато фізико-хімічних властивостей розчинів. За величиною частинок розчини поділяють на:
а) істинні розчини (розмір частинок менше 10–9 м), які можуть бути іонними або молекулярними залежно від того, дисоціює розчинена речовина на іони чи залишається у стані молекул;
б) колоїдні розчини (розмір частинок від 10–7 – 10–9 м), які є гетерогенними, мають поверхню розподілу між фазами – розчиненою речовиною (дисперсною фазою) і розчинником (дисперсійним середовищем).
Розчини високомолекулярних сполук (ВМС), мають властивості як істинних, так і колоїдних розчинів (розмір частинок більше 10–9 м).
В області будови розчинів існує дві теорії: фізична й хімічна. Відповідно до фізичної теорії розчинник (вода) розглядається як індиферентне середовище, в якому рівномірно розподіляються молекули розчиненої речовини. При цьому ніякої взаємодії між розчинником і розчиненою речовиною не відбувається, що характерно для ідеальних розчинів, які нескінченно розведені. Ця теорія відносила розчини до механічних сумішей.
У реальних розчинах між розчиненою речовиною й розчинником має місце взаємодія, про що свідчать теплові ефекти й зміни (звичайне зменшення) об'єму. Це мало відображення в хімічній теорії (сольватної теорії) розчинів, розробленої Д. І. Менделєєвим (1887 рік). Відповідно до цієї теорії в процесі розчинення істотну роль відіграють як хімічні процеси, пов'язані із взаємодією розчиненої речовини з розчинником, так і фізичні, пов'язані з дифузією й рівномірним розподілом однієї речовини в середовищі іншої. У результаті взаємодії розчинника з розчиненою речовиною утворюються нестійкі сполуки, які називають сольватами (якщо розчинником є вода, то сполуки називають гідратами), що знаходяться в стані рівноваги. Розпад речовини на гідратовані іони пов'язаний з явищем іонізації (народженням іонів). Розглянемо схему механізму розчинення твердих речовин на прикладі розчинення хлориду натрію у воді.
Хлорид натрію утворений іонним зв'язком. При його розчиненні диполі води орієнтуються навколо молекул солі в такий спосіб: негативні полюси диполів води повертаються убік позитивного центра молекули NaCl, а позитивні полюси − убік негативного центра молекули й притягують їх до себе. За рахунок цього хімічний зв'язок слабшає між іонами в молекулі, а потім розривається − утворюються позитивно й негативно заряджені іони. З останніми молекули води вступають в іон-дипольну взаємодію, утворюючи гідратовані іони (гідрати). Таким чином, розчинення − це сукупність двох процесів: сольватації (гідратації) і іонізації.
З погляду термодинаміки процес розчинення твердих речовин у воді може бути представлений рівнянням:
ΔHрозч. = ΔUкр.р. + ΔHгідр. , (1.1)
де ΔHрозч. - молярна ентальпія розчинення;
ΔUкр.р. - енергія кристалічної решітки;
ΔHгідр. - ентальпія гідратації.
Залежно від співвідношення величин ΔUкр.р. і ΔHгідр. процес розчинення може бути ендотермічним або екзотермічним. Руйнування структури розчиненої речовини, який супроводжується розривом хімічних зв'язків, вимагає витрат енергії. Утворення сольватованих (гідратованих) іонів супроводжується виділенням енергії. Загальний енергетичний ефект залежить від співвідношення виділеної й поглинутої енергії. Якщо витрати енергії на руйнування розчиненої речовини(ΔUкр.р.) більші за енергію, що виділилася при гідратації (ΔHгідр.), то процес протікає ендотермічно. Якщо навпаки (ΔUкр.р. < ΔHгідр. ), то процес протікає екзотермічно [1].
Розчинність − це процес, що відбувається за рахунок дифузії молекул або іонів із області з більшою концентрацією в область із меншою концентрацією, у результаті чого речовина рівномірно розподіляється в повному обсязі розчину.
Розчинність − двонаправлений процес: тверда речовина переходить у розчин, а розчинена речовина — у тверду фазу. Отже, одночасно відбувається й розчинення, і кристалізація. Ці процеси із часом протікають із однаковими швидкостями − наступає динамічна рівновага. При цьому концентрація розчиненої речовини при незмінних умовах залишається постійною. Такий стан називається станом насичення, а розчин − насиченим.
Колігативні властивості (від лат. colligo — зв'язувати, з'єднувати)- властивості розчинів, які залежать від кількості частинок розчинених речовин і не залежать від їх природи.
До колігативних властивостей відносяться:
- осмотичний тиск,
- зниження тиску насиченої пари розчинника над розчином,
- зниження температури замерзання розчинів в порівнянні з чистим розчинником,
- підвищенням температури кипіння розчинів в порівнянні з чистим розчинником.
Слід мати на увазі, що при одній і тій же концентрації розчинів електроліту і неелектроліту, загальне число часток в розчині електроліту буде більше з урахуванням процесу дисоціації. Основні параметри стану розчину - температура, тиск і концентрація. Концентрація може бути виражена різними способами:
1. Молярна концентрація Сі (моль/л або моль/м3) - кількість розчиненої речовини в 1 л або 1 м3 розчину. Часто використовують скорочену форму запису М = моль/л, наприклад 1М КС1 - одномолярний (1 моль/л) розчин хлориду калію;
2. Моляльність mі (моль/кг) - кількість розчиненої речовини в 1 кг розчинника;
3. Молярна частка розчиненої речовини хі - відношення кількості цієї речовини nі до сумарної кількості всіх речовин, що входять до складу розчину включаючи розчинник:
![]() . (1.2)
. (1.2)
Завжди ![]() = 1.
= 1.
4. Масова частка розчиненої речовини ωі, - відношення маси
розчиненої речовини, до маси розчину mp:
ωi = ![]() , (1.3)
, (1.3)
- Кількісні закономірності
Кріоскопія це метод визначення деяких властивостей компонентів розчину, в основі якого лежить вимірювання температур замерзання розчинника та розведеного розчину.
Рауль виявив, що за умови сталої температури тиск насиченої пари розчинника над розчином нелеткої речовини є меншим, ніж над чистим розчинником. За законом Рауля відносне зниження тиску насиченої пари розчинника над розведеним розчином нелеткої речовини, яка не дисоціює та не асоціює у розчині, дорівнює молярній частці розчиненої речовини N2:
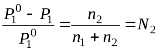 , (1.4)
, (1.4)
де ![]() – тиск насиченої пари над чистим розчинником;
– тиск насиченої пари над чистим розчинником;
P1– тиск насиченої пари розчинника над розчином;
n1– кількість молів розчинника у розчині;
n2– кількість молів розчиненої речовини.
Наслідком закону Рауля є те, що температура початку кристалізації розчину нелеткої речовини завжди нижча, ніж температура кристалізації чистого розчинника.
На рис. 1.1 зображено діаграму стану води. Лінія АО (крива сублімації)– це температурна залежність тиску насиченої пари води над льодом, лінія ОР0 (крива випаровування) – температурна залежність тиску насиченої водяної пари над рідкою водою, лінія ОВ (лінія плавлення) – залежність температури кристалізації води від зовнішнього тиску. На діаграмі також наведено температурну залежність тиску насиченої пари води над розчином нелеткої речовини (лінія АР) [3].
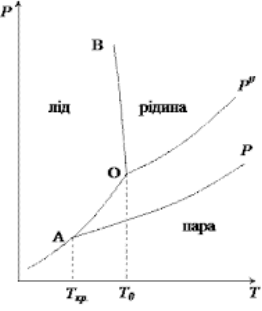
Рис. 1.1 – Графік зниження температури кристалізації розчину
Кристалізація рідини починається тоді, коли тиск насиченої пари над рідкою та кристалічною фазами стає однаковим. Отже, вода кристалізується при температурі Т0, за якої перетинаються лінії сублімації та випаровування води, а розведений водний розчин нелеткої речовини починає кристалізуватися при температурі Ткр, коли в ньому з’являються перші кристали льоду (точка А).
Температура початку кристалізації розчину залежіть від його концентрації. Зниження цієї температури відносно температури замерзання чистого розчинника, тобто ∆Ткр=Т0-Ткр, прямо пропорційне моляльній концентрації розчиненої речовини у розчині:
∆Ткр = К∙m, (1.5)
де m – моляльна концентрація розчину, моль/кг;
K – кріоскопічна стала, яка дорівнює різниці між температурами замерзання розчинника та одномоляльного розчину нелеткої речовини з властивостями ідеального, Ккг/моль.
Кріоскопічна стала – величина, що характеризує певний розчинник і залежить тільки від його властивостей. Для води кріоскопічна стала складає 1,86 Ккг/моль.
Якщо визначити зниження температури кристалізації розчину з відомою концентрацією розчиненої речовини, яка не дисоціює та не асоціює у розчині, то можна розрахувати молярну масу розчиненої речовини за формулою [2]:
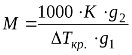 , (1.6)
, (1.6)
де K – кріоскопічна стала розчинника;
g1– маса розчинника, г;
g2– маса розчиненої речовини, г;
∆Ткр – зниження температури кристалізації розчину, К.
Визначена кріоскопічним методом за формулою (1.6) молярна маса електроліту не відповідатиме дійсній, оскільки розпад молекул на іони призводить до збільшення моляльної концентрації частинок у розчині і, відповідно, до збільшення ∆Ткр та зменшення значення молярної маси.
Якщо розчинена речовина є електролітом, то кріоскопічна формула (1.5) набуває вигляду:
∆Ткр.ел. = i∙K∙m, (1.7)
де і – ізотонічний коефіцієнт, який показує, у скільки разів кількість частинок у розчині електроліту більша за кількість частинок у розчині неелектроліту такої самої концентрації. Розраховують ізотонічний коефіцієнт за формулою:
i = 1+α(n−1), (1.8)
де α– ступінь дисоціації (частка молекул, які продисоціювали на іони);
n – кількість іонів, що утворюються внаслідок дисоціації однієї молекули електроліту.
Для бінарного електроліту (n=2) згідно з формулою (1.8) i = 1+α. З порівняння формул (1.6) – (1.7) випливає, що для такого електроліту:
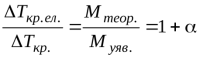 , (1.9)
, (1.9)
звідки:
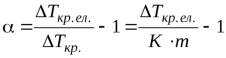 , (1.10)
, (1.10)
або:
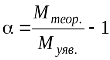 , (1.11)
, (1.11)
де Муяв. – розрахована за рівнянням (1.6) уявна (експериментальна) молярна маса електроліту в розчині.
У випадку асоціації розчиненої речовини у розчині експериментальна молярна маса буде більша за теоретичну в β разів, де β – кількість молекул мономеру, що беруть участь в утворенні асоціату.
При охолодженні розчину температура його знижується, він може охолодитись нижче температури замерзання – стати переохолодженим (рис. 1.2) [6].
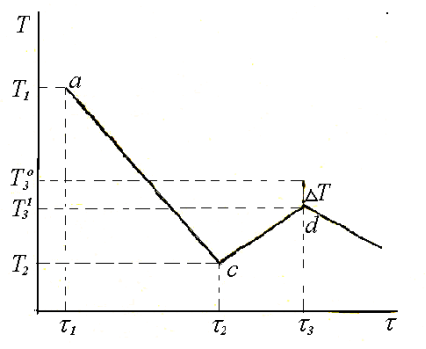
Рис. 1.2 - Термографічна крива охолодження розчину
В момент часу τ1 розчин мав температуру Т1. З часом розчин охолоджується за прямою ас. У точці с розчин настільки переохолоджується, що починає замерзати і утворюються кристали розчинника (води). Виділення льоду підвищує температуру розчину за рахунок теплоти кристалізації і в точці d часу 3 розчин буде мати температуру замерзання розчину ![]() (рис. 1.2).
(рис. 1.2).
Різниця між величинами ![]() (температура замерзання розчинника) і
(температура замерзання розчинника) і ![]() (температура замерзання розчину) визначає величину Т.
(температура замерзання розчину) визначає величину Т.
Прилад для кріоскопічних вимірювань, зображений на рис. 1.3, складається з таких частин. Пробірка 1 закріплена на коркові в металевому посуді 2, який відіграє роль повітряної сорочки. Стакан 3, в який поміщають охолоджуючу суміш, закривається кришкою 4 з двома отворами, в один з яких вставляють корок для пробірки 1, а в другий – мішалку 5 [4].
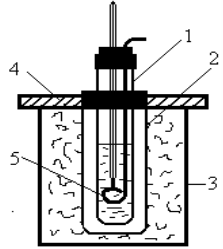
Рис. 1.3 – Кріоскоп
- Застосування кріоскопії
Для визначення зниження температури кристалізації розчинів застосовують кріоскопічний метод, використовують термометр Бекмана, за допомогою якого можна вимірювати різницю температур у межах 5 градусів з точністю до 0,01 градуса. На відміну від звичайних термометрів термометр Бекмана вимірює не абсолютну, а відносну температуру. Він має у верхній частині додатковий резервуар із ртуттю, що дозволяє змінювати об’єм ртуті в капілярі та використовувати термометр для роботи в різних інтервалах температур. Термометр перед роботою повинен бути налаштований таким чином, щоб відносна температура замерзання води відповідала приблизно середині шкали.
Особливістю цього термометра є велика довжина шкали (приблизно 5 см на 1 К) і наявність у верхній частині термометра запасного резервуара з ртуттю, який дає можливість змінювати кількість ртуті в робочій частині термометра. Велика довжина шкали дозволяє робити від- ліки з необхідною для вимірів точністю, а запасний резервуар дає можливість встанов- лювати термометр на різні температурні інтервали.
Шкала термометра розділена на 5 К, кожний градус ділиться на десяті долі, а кожна десята доля в свою чергу ділиться на соті долі; тисячні долі можуть бути приблизно розраховані за допомогою лупи.
Термометр для кріоскопічних вимірів налагоджується так, щоб при температурі замерзання рівень ртуті знаходився між третім і п’ятим градусами. Перед наладкою термометра перевіряють його покази при умовах, необхідних для роботи. Якщо рівень ртуті в капілярі не буде встановлюватися між 3 К і 5 К, термометр необхідно налагодити. Це робиться наступним чином: затискують рукою нижній резервуар ртуті, тобто нагрівають його і з’єднують із стовпчиком ртуті в верхньому резервуарі. Якщо в нижньому резервуарі був надлишок ртуті, тобто ртуть піднімалась у попередньому досліді вище п’ятого градусу, то після з’єднання обох резервуарів необхідно частину ртуті перевести в верхній резервуар. Для цього термометр повертають верхнім резервуаром вниз. Якщо ртуть у попередньому досліді опускалась нижче нуля, тобто в нижньому резервуарі ртуті недостатньо, то частину ртуті необхідно перелити з верхнього в нижній резервуар (рис. 1.4). Для цього з’єднують верхній і нижній резервуар, і нижній резервуар охолоджують в суміші льоду і води. Після того, як ртуть перейде в деякій кількості в потрібному напрямку, розривають стовпчик ртуті в капілярі. Нижній резервуар затискають у долоні і легким постукуванням однієї руки по другій розривають стовпчик ртуті. У випадку, коли ртуть не зупиняється в потрібному інтервалі температур, налагодження повторюють [6].

Рис. 1.4 - Термометр Бекмана:
R — резервуар;
B — вигин капіляру.
Налагоджений термометр залишають у стакані з льодом і приступають до наступної операції.
Розчинник наливають у пробірку в такій кількості, щоб після занурення в нього термометра Бекмана рівень рідини був на 2–3 см вищий верхньої частини нижнього резервуару, а нижня частина резервуару не повинна доходити до дна на 1–2 см. У більшості випадків заливають 25–40 мл розчинника.
Потім готують охолоджену суміш із води, льоду і солі з температурою на 3–4 К нижче температури замерзання розчинника. Заповнюють охолоджуючою сумішшю стакан 3, проводять наближене визначення to замерзання розчинника. Для цього пробірку з розчинником і вставленим в неї термометром поміщають безпосередньо в охолоджуючу суміш. Перемішуючи рідину, спостерігають за показами термометра. Внаслідок переохолодження температура опускається нижче точки замерзання; коли починається кристалізація в результаті виділення теплоти кристалізації, температура розчину починає підвищуватися. По термометру відраховують максимальну температуру, яка й приймається за наближену температуру замерзання. Наближеною вона являється тому, що дослід проводиться в умовах, які не виключають нерівномірностей охолодження.
У широку пробірку циліндром наливають 30 мл холодної дистильованої води та закривають її пробкою, в якій закріплено термометр Бекмана і мішалку. Пробірку поміщають у кріостат. Перемішуючи воду, стежать за температурою. Температура води при охолодженні спочатку може спадати до значень, суттєво нижчих за її температуру замерзання. Це явище називається переохолодженням. Коли вода починає кристалізуватися, ртутний стовпчик термометра швидко піднімається до температури замерзання, яка деякий час, поки не закінчиться процес кристалізації води, залишається сталою.
Пробірку виймають з кріостата, підігрівають замерзлу воду рукою доти, доки ртутний стовпчик в капілярі не почне підніматися, і повторюють дослід. Розбіжність між Т0двох дослідів не повинна перевищувати 0,02 градуса.
Одержують мензурку з невідомою речовиною і зважують її на аналітичних терезах. Знову розморожують воду, всипають в неї речовину, яка міститься у мензурці, та перемішують розчин до повного розчинення речовини. Зважують порожню мензурку і за різницею обчислюють масу розчиненої речовини. Двічі визначають температуру початку кристалізації розчину Ткр. так, як це описано раніше для води. Внаслідок кристалізації розчинника температура системи поступово знижується, оскільки зростає концентрація розчиненої речовини. Тому температурою кристалізації розчину слід вважати найвищу температуру, яку спостерігають після переохолодження [5].
Розраховують зниження температури кристалізації розчину та за формулою (1.5) визначають експериментальну молярну масу розчиненої речовини.
Спочатку записують дані експерименту:
- масу води;
- масу мензурки з речовиною;
- маса порожньої мензурки;
- маса розчиненої речовини.
Розрахунок зниження температури кристалізації розчину проводять за формулою:
∆Ткр. = Т0(сер.) – Ткр.(сер.) = К. (1.12)
Обчислення експериментальної молярної маси неелектроліту роблять за рівнянням (1.6).
Явище кріоскопії активно використовується при заморожуванні продуктів харчування. Сучасні технології заморожування плодів і овочів спрямовані на створення таких умов низькотемпературного оброблення й зберігання, при яких споживні властивості цих продуктів будуть максимально наближеними до свіжих і не змінюватися протягом тривалого терміну холодильного зберігання. Фізичною сутністю процесу заморожування як способу консервування рослинної сировини є фазове перетворення води плодів і овочів із рідкого стану в кристалічний. Саме кристалізацією рідкої фракції зумовлена здатність швидкозаморожених плодів і овочів до тривалого зберігання, оскільки перетворення води у лід перешкоджає живленню мікроорганізмів, створюючи несприятливі осмотичні умови, різко уповільнює швидкість протікання хімічних і біохімічних процесів, які впливають на зміну кольору, втрату аромату, появу небажаних смакових відтінків, зменшення вмісту вітамінів тощо.
Біохімічні процеси, хоча й з надзвичайно низькою швидкістю, протікають навіть при дуже низьких температурах. Саме тому дослідження процесу кристалоутворення є доцільним. Особливості утворення кристалів льоду під час заморожування чистої води, розчинів, рослинних і тваринних тканин висвітлені у наукових працях Г. Б. Чижова, Н. А. Головкіна, О. А. Цуранова. Вода, яка входить до складу харчових продуктів, зазнає значних змін під час заморожування. Плоди й овочі відрізняються досить високим вмістом вологи (у плодах – 82–90, овочах – 74–93 %). Також має значення характер зв’язку води з іншими речовинами. Вільна волога бере участь у хімічних і біохімічних реакціях, а при температурі 0 ºС перетворюється на лід. Зв’язана має змінені фізичні властивості внаслідок її взаємодії з неводними компонентами (колоїдними та розчиненими речовинами) і поділяється на колоїдно-зв`язану та осмотично-поглинену. Вміст і форми зв’язку вологи залежать від виду, ступеня стиглості, анатомічної частини, типу тканин, терміну та умов зберігання плодів і овочів. Ось чому отримання якісної швидкозамороженої плодоовочевої продукції може бути гарантованим лише при визначенні особливостей кристалоутворення.
З погляду фазового перетворення вологи процес заморожування є сукупністю трьох послідовних етапів:
1 – охолодження продукту до кріоскопічної температури на поверхні продукту;
2 – власне заморожування;
3 – доморожування продукту до температури, передбаченої технологічним процесом.
Температура початку кристалізації води продукту (кріоскопічна) є надзвичайно важливим параметром розрахунку режимів зберігання та заморожування. Температури, близькі до кріоскопічних, уможливлюють продовження терміну зберігання плодів і овочів без фазових змін вологи, а швидке проходження зони кристалізації під час заморожування сприяє утворенню дрібних кристалів льоду, що позитивно впливає на збереження структури рослинної сировини після її дефростації.
Процес кристалоутворення води, яка містить розчинені органічні й мінеральні речовини та входить до складу плодів і овочів, починається при температурах нижче 0 ºС після її переохолодження. Для регулювання цього процесу застосовують кріопротектори. За останні тридцять років досліджено понад 100 хімічних сполук кріопротекторів, серед яких є органічні речовини, неорганічні солі та полімери. Головним механізмом захисної дії є їхня здатність зменшувати кількість вологи, яка кристалізується під час заморожування. Оброблення плодів і овочів речовинами, які виявляють кріозахисну дію, супроводжується зниженням кріоскопічної температури. При цьому процес заморожування може відбуватися без утворення центрів кристалізації, проходячи через процес переохолодження розчину до його склування, що позитивно впливає на збереження структури рослинної сировини.
Кріоскопічна температура розчинів залежить від їхньої концентрації, ступеня дисоціації розчинних речовин, властивостей розчинника та не є постійною величиною під час заморожування.
У науковій літературі останніх двадцяти років містяться суперечливі дані кріоскопічної температури різних видів плодів і овочів, що зумовлено суттєвим впливом на цей показник морфологічних, сортових ознак, агрокліматичних умов вирощування. За даними А. Г. Мазуренка зі співавторами, кріоскопічна температура ягід і овочів перебуває в діапазоні від’ємних температур 0.8–1.2 та 0.4– 0.9 ºС відповідно. У той же час Н. А. Головкін стверджує, що кріоскопічна температура вишні наближається до –3.5 ºС, деяких сортів винограду з високим вмістом цукрів, кислот, солей заліза – до –5 ºС [7].
Я. Постольські зазначає, що кріоскопічна температура основних видів овочів коливається в межах –2.83÷– 0.83, плодів – в діапазоні –2.67÷– 0.89 ºС. При цьому початкова температура кристалоутворення всередині клітини на 0.4 ºС вище температури кристалізації тканинних соків у міжклітинниках. За даними різних наукових джерел, кріоскопічною є від’ємна температура, ºС: для салату – 0.5; томатів – 1.0; цибулі, гороху – 1.3; бобів – 1.8; яблук, груш, сливи, картоплі – 2.4; апельсинів, лимонів, винограду – 3.0; бананів – 4.0; смородини – 1÷1.6; обліпихи – 1÷1.4.
Заморожування можна розглядати як процес просування льодового фронту від поверхні до центру продукту. Я. Постольські стверджує, що ефект заморожування досягається у діапазоні температур –20÷–40 ºС. За Е. Алмаши оптимальна температура заморожування рослинної сировини з урахуванням її особливостей –35÷–50 ºС.
Заключний етап процесу – доморожування продукту до температури, передбаченої нормативними документами. За ДСТУ 2074–92 "Продукти переробки овочів і фруктів. Терміни та визначення" температура всередині швидкозаморожених овочевих і фруктових продуктів не повинна перевищувати –18 °С. Відповідно такою ж вона має бути під час зберігання й реалізації, оскільки коливання та порушення рекомендованих температур призводить до активації біохімічних процесів, рекристалізації кристалів льоду у тканинах плодів і зниження споживних властивостей продукту.
2 ЕБУЛІОСКОПІЯ: СУТЬ ЯВИЩА, КІЛЬКІСНІ ЗАКОНОМІРНОСТІ
2.1 Суть явища
Ебуліоскопія (лат. ebullire — закипати + грец. scopia — дослідження, огляд) — метод дослідження властивостей розчинів, що базується на визначенні підвищення температури початку кипіння розчину порівняно з Tкип чистого розчинника.
Як уже зазначалося, більшість хімічних реакцій у промисловості та наукових дослідженнях проводять саме в розчинах. Після цього синтезовані речовини виділяють з розчинів перегонкою або кристалізацією, тому вивчення процесів кипіння і кристалізації розчинів має важливе практичне значення.
Розглянемо, як змінюються температури кипіння і замерзання двокомпонентних рідких розчинів нелетких речовин у летких розчинниках. Температури кипіння і замерзання рідини пов'язані з тиском насиченої пари цієї рідини.
Тиск насиченої пари над кожною рідиною за певної температури є сталою величиною, але якщо в цій рідині розчинити якусь речовину, тиск її насиченої пари зміниться. В разі, коли розчинена речовина є нелеткою, тиск насиченої пари рідини зменшується. Це можна пояснити тим, що після розчинення в рідині нелеткої речовини концентрація розчинника в рідкій фазі зменшується. Згідно з принципом Ле Шательє рівновага між парою і розчином зміщується так, щоб послабити це зменшення; для цього частина молекул розчинника переходить з пари в рідину. Зменшення тиску насиченої пари рідини можна також пояснити, розглянувши зміну швидкості випаровування і конденсації. Справді, внаслідок розчинення нелеткої речовини в рідині частину поверхні рідини займуть молекули цієї речовини, які за рахунок перебігу процесу сольватації зв'яжуть частину молекул розчинника. Це зумовить зменшення швидкості випаровування розчинника. Швидкість конденсації стане більшою за швидкість випаровування, частина молекул розчинника перейде з парової фази в рідку. Число молекул в одиниці об'єму пари і відповідно тиск насиченої пари зменшаться, встановиться нова рівновага з меншими швидкостями процесів випаровування і конденсації [9].
2.2 Кількісні закономірності
Природно, що тиск насиченої пари розчинника над розчином Р пропорційний його концентрації в розчині. Найзручніше концентрацію розчинника виражати його молярною часткою N(S):
P = P0∙N∙(S), (1.13)
Тиск насиченої пари над розчином нелеткої речовини дорівнює її тиску над чистим розчинником, помноженому на молярну частку розчинника в розчині.
Часто важливо знати не сам тиск насиченої пари, а різницю між тисками насиченої пари над розчинником і над розчином. Різницю РО-Р називають зниженням тиску насиченої пари над розчином. Величина РО-Р залежить від концентрації розчиненої речовини. Справді:
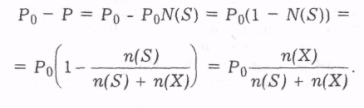 (1.14)
(1.14)
Відносне зниження тиску насиченої пари розчинника над розчином нелеткої речовини дорівнює молярній частці розчиненої речовини.
Залежність тиску насиченої пари над розчином від його концентрації установив французький учений Ф. М. Рауль, тому пов'язані між собою рівняння та відповідні формулювання називають першим законом Рауля.
Слід зазначити, що зниження тиску насиченої пари над розчином залежить тільки від числа частинок (молів) розчиненої речовини і не залежить від її властивостей (маси частинок, їхніх розмірів, хімічної природи та ін.).
Прямим наслідком зниження тиску насиченої пари над розчинами є зростання температур їх кипіння і зниження температур кристалізації.
Як уже зазначалося, рідина починає кипіти, коли тиск її насиченої пари досягає зовнішнього (атмосферного) тиску. Залежність тиску насиченої пари над розчинником виражає крива ОА. Аналогічна крива для розчину нелеткої речовини в рідині (крива DE) згідно з першим законом Рауля лежить нижче від кривої ОА, Температура кипіння рідкого розчинника (вихідної рідини) за атмосферного тиску відповідає Т°кт. За цієї температури розчин не кипітиме, бо тиск його насиченої пари нижчий від атмосферного. Щоб тиск насиченої пари над розчином досягнув атмосферного, розчин треба підігріти до температури Ткип (рис. 1.5).
Різницю (Ткип - Т°кип) = ∆Ткип називають підвищенням температури кипіння розчину. Якщо взяти розчин з вищою концентрацією розчиненої речовини, то тиск його насиченої пари буде ще нижчим, а температура кипіння відповідно зросте на ще більшу величину. Зниження тиску насиченої пари розчину визначається молярною часткою розчиненої речовини, тому й підвищення температури кипіння ∆Ткип розчину пропорційне числу молів розчиненої речовини в певній кількості розчинника [9]:
∆Ткип = E∙b(X), (1.15)
де b(Х) — моляльна концентрація розчиненої речовини, тобто число її молів в 1 кг розчинника.
Фізичний зміст коефіцієнта пропорційності Е можна з'ясувати, прийнявши змінну величину b(Х) за одиницю, тобто 1 моль/кг.
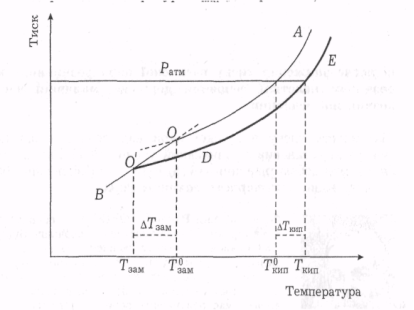
Рис. 1.5 – Залежність тиску насиченої пари від температури
За цієї умови АТкип = Е, тобто Е - це підвищення температури кипіння одномоляльного розчину. Ф. М. Рауль довів, що розчини різних речовин з однаковою моляльною концентрацією в одному й тому самому розчиннику мають однакові значення ∆Ткип. Отже, ∆Ткип (і, відповідно, значення Е) не залежить від природи розчиненої речовини. Проте розчинам однієї й тієї самої речовини в різних розчинниках з однаковою моляльною концентрацією розчиненої речовини b(Х) відповідають різні значення ∆Ткип.
Отже, можна дійти висновку, що константа Е залежить від природи розчинника і тому її називають ебуліоскопічною сталою розчинника. Наприклад, для води, бензолу й оцтової кислоти значення ебуліоскопічної сталої відповідно дорівнюють 0,516, 2,57 і 3,10 К∙кг/моль.
2.3 Застосування ебуліоскопії
За фізичним значенням ебуліоскопічна стала Е дорівнює підвищенню Tкип одномоляльного розчину за умови, що розчин має властивості ідеального. В таблиці 1.2 наведені ебуліоскопічні сталі деяких розчинників.
Таблиця 1.2 - Ебуліоскопічні сталі деяких розчинників
|
Розчинник |
Tкип, К |
Ебуліоскопічна стала, Е |
|
Вода |
373 |
0,516 |
|
Етанол |
351,4 |
1,20 |
|
Оцтова кислота |
391,5 |
3,07 |
|
Хлороформ |
334,2 |
3,88 |
|
Бензол |
353,2 |
2,57 |
|
Фенол |
455,1 |
3,6 |
|
Сірковуглець |
319,3 |
2,29 |
Для розчинів електролітів вираховують ізотонічний коефіцієнт (і):
∆Tкип = і∙Е∙m, (1.16)
Ебуліоскопічний метод визначення молекулярної маси розчиненої речовини базується на рівнянні (1.19) [8]:
M = E∙g∙1000 / G∙∆Tкип., (1.17)
де g — маса розчиненої речовини (г);
G — маса розчинника (г).
При цьому Tкип вимірюють за допомогою термометра Бекмана. Спочатку знаходять Tкип чистого розчинника, потім у нього вносять наважку речовини, вимірюють Tкип одержаного розчину і розраховують ∆Tкип. Проте Е. застосовується не так часто, як кріоскопія, через експериментальні ускладнення при точному визначенні ∆Tкип (зміною концентрації розчинів внаслідок випаровування розчинника тощо).
Визначення молекулярної маси речовини також проводять ебуліоскопічним методом (метод визначення молекулярної маси по Сиволобову). Для цього треба зібрати прилад, схема якого приведена на рис. 1.6.
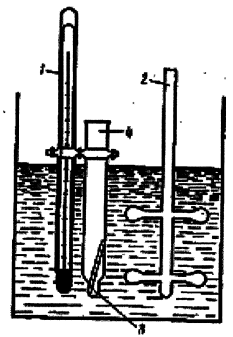
Рис.1.6 - Схема приладу визначення температури кипіння по Сиволобову
Трубку з внутрішнім діаметром 4-5 мм розрізати на частини довжиною 18-20 см. Кожну трубку витягнути посередині до діаметра 2-3 мм і розрізати у вузькому місці на рівні частини, для того, щоб одержати трубки довжиною 6-8 см. Витягнуті кінці цих трубок запаяти. У трубку 4 налити приблизно 0,5 мл досліджуваної рідини і ввести в неї дуже тонкий капіляр 3 із запаяним кінцем, зверненим нагору. Пробірку 4 закріпити за допомогою гумового кільця на термометрі 1 так, щоб досліджувана рідина знаходилася на рівні ртутної кульки. Термометр із пробіркою занурити в гліцеринову баню з мішалкою 2, закріплену на азбестовій сітці у штативі і рівномірно нагріти доти, доки з капіляра 3 не почнуть виділятися пухирці. Ця температура відповідає температурі кипіння досліджуваної рідини [10].
Дослід проводити двічі і взяти середнє значення температури кипіння (розбіжності рівнобіжних дослідів не повинні перевищувати 0,5°С).
Визначення ∆Tкип водно-спиртових розчинів застосовують для кількісного визначення спирту в цих сумішах. У фармації методом ебуліоскопії визначають молекулярну масу біологічно активних та лікарських речовин, розраховують активність розчиненої речовини, ізотонічний коефіцієнт, ступінь електролітичної дисоціації слабкого електроліту.
ВИСНОВКИ
1 Розглянута загальна характеристика і фізико-хімічні параметри кріоскопії та ебуліоскопії, їх застосування в науці та виробництві.
2 Знайдено, що кріоскопія - це метод визначення деяких властивостей компонентів розчину, в основі якого лежить вимірювання температур замерзання розчинника та розведеного розчину.
3 Показано, що для визначення зниження температури кристалізації розчинів, молекулярної маси речовин, ізотонічного коефіцієнту розчинів застосовують кріоскопічний та ебуліоскопічний методи.
4 Відзначено, що ебуліоскопія - метод дослідження властивостей розчинів, що базується на визначенні підвищення температури початку кипіння розчину порівняно з Tкип чистого розчинника.
ПЕРЕЛІК ПОСИЛАНЬ
1 Лебідь В.І. Фізична хімія. -Харків: Фоліо, 2005.- 476 с.
2 Білий О.В. Фізична хімія. - Київ: ЦУЛ, 2002. -364с.
3 Яцимирський В.К. Фізична хімія процесів: Навч. посібник. – К.: НМК ВО, 1992.- 112с.
4 Яцимирський В.К. Фізична хімія рівноважних систем: Навч. посібник.- К.: ВЦ “Київський університет”, 1999.- 112с.
5 Еткінс П. Фізична хімія.- Москва: Світ, 1980.- Т.2.- 585с.
6 Фізична хімія. Теоретичне і практичне керівництво / Під ред. акад. Б.Н. Нікольського.- 2-е вид., перероб.і доп.- Л.: Хімія, 1978.- 880с.
7 Мороз А.С., Ковальова А.Г.. Фізична хімія.- Львів: “Світ”, 1994.- 350с.
8 Кнорре Д.Г. Фізична хімія. –Москва: “Вища школа”, 1990.- 450 с.
9. Усков І.А. Фізична хімія. –Київ: “Вища школа”, 1988.- 250 с.
10 Кірєєв В.А. Скорочений курс фізичної хімії.- Москва: “Вища школа”, 1978. - 350 с.

про публікацію авторської розробки
Додати розробку
