Конспект лекцій з предмета "Хімія"
Запорізький електротехнічний коледж
Національного університету «Запорізька політехніка»
ЗАТВЕРДЖЕНО
Протокол засідання ПЦК
природничо-математичних
дисциплін від ______ 2020р. № _
Голова ПЦК ______ Ю.В. Хоменко
ХІМІЯ
Конспект лекцій 1
для всіх спеціальностей коледжу
Викладач О.А.Поліщук
2020
Конспект лекцій з предмета «Хімія» для студентів денного відділення всіх спе-ціальностей коледжу розглянуто на засіданні методичної ради коледжу. Рекомен-довано для використання у навчальному процесі.
Секретар методичної ради В.В. Кузьменкова
ПЕРЕДМОВА
Конспект лекцій з предмета «Хімія» частина 1 для студентів денного відділення всіх спеціальностей коледжу розроблено відповідно навчальної програми «Хімія» для вищих навчальних закладів І – ІІ рівнів акредитації, затвердженої Міністерством освіти і науки України у 2010 році. Конспект лекцій складається з 6 лекцій. Після кожної лекції є контрольні запитання для кращого розуміння вивченого матеріалу.
Матеріал викладений у доступній формі, що дасть змогу студентам самостійно доопрацювати матеріал. За допомогою цього навчального посібника студенти зможуть закріпити та поглибити знання, які отримали на заняттях. Використання конспекту лекцій, надасть змогу студентам оволодіти знаннями з хімії та сформувати бережне ставлення до природи.
ЗМІСТ
Розділ ІV Органічні сполуки
Лекція 11
Теорія хімічної будови О.М.Бутлерова. Багатоманітність органічних сполук, їх 5 класифікація. Вуглеводні: алкани, алкени, алкіни, арени
Лекція 12
Оксигеновмісні органічні сполуки: спирти, феноли 16
Лекція 13
Оксигеновмісні органічні сполуки: альдегіди, карбонові кислоти 21
Лекція 14
Естери. Жири. Мило 25
Лекція 15
Вуглеводи 28
Лекція 16
Азотовмісні органічні сполуки. Нітросполуки. Аміни. Амінокислоти. Білки 32
Список літератури 35
Розділ ІV Органічні сполуки
Лекція 11
Теорія хімічної будови О.М.Бутлерова. Багатоманітність органічних сполук, їх класифікація. Вуглеводні: алкани, алкени, алкіни, арени
11.1 Органічні сполуки
Сполуки, що утворені Карбоном, називаються органічними сполуками. Нині відо-мо понад 10 млн органічних сполук. Неорганічних речовин відомо лише близько 200 тис.
Атоми Карбону здатні сполучатися між собою, утворюючи молекули різноманітної форми: лінійні, розгалужені. короткі, довгі, ланцюги, кільця.
В органічних сполуках крім Карбону містяться атоми Нітрогену, Оксигену, Гідро-гену, галогенів, Сульфуру, Фосфору та ін. В таблиці 11.1 Наведені відмінні власти-вості органічних і неорганічних сполук.
Таблиця 11.1 – Відмінні властивості неорганічних і органічних сполук
|
Неорганічні речовини |
Органічні сполуки |
|
Валентність більшості елементів у неорга-нічних сполуках змінна (Сульфур, Фос-фор, Нітроген мають різну валентність). |
Якісний склад обмежений, кількісний значно багатший |
|
У неорганічних сполуках найрізноманіт-ніші види хімічних зв’язків – іонний, ко-валентний, металічний, водневий. |
Елементи органічних сполук виявляють значно менше валентних станів. Карбон, Гідроген, Оксиген мають сталі валентнос-ті. |
|
Неорганічні речовини в основному туго -плавкі, стійкі до нагрівання |
Переважно утворюють ковалентні зв’язки, ноді іонні. Кристалічні ґратки молекулярні. Легко- плавкі, часто мають запах. |
|
Використовують в основному водні роз-чини (при хімічних реакціях) |
Згорають з утворенням води і вуглекис-лого газу. Здебільшого не розчинні у воді. |
|
Реагуючи, утворюють осад, гази, зміню-ють забарвлення. |
Реагують між собою повільно. |
Спільні ознаки:
- утворення і реакції органічних речовин відбуваються за тими самими законами, що й неорганічних речовин;
- серед органічних сполук є розчинні у воді, електроліти (солі органічних кислот), є термостійкі;
- органічні та неорганічні речовини об’єднує і те, що вони можуть взаємно пере-творюватися.
Сполуки, що мають однакову молекулярну формулу, але різну будову та різні властивості, називаються ізомерами.
11. 2 Теорія хімічної будови О.М.Бутлерова
О.М.Бутлеров сформулював основні ідеї теорії будови органічних речовин у вигляді таких положень.
1) Атоми в молекулі розміщуються не безладно, а в певному порядку згідно з їхньою валентністю. Кожна речовина має властиву лише їй послідовність сполучення атомів в молекулі, тобто хімічну будову, що відображається структурною формулою.
2) Властивості органічних речовин визначається не тільки тим, які атоми і скільки їх входить до складу молекул, а й порядком сполучення атомів в молекулі (ізомерія).
3) Властивості органічних речовин визначаються складом, хімічною, електронною та просторовою будовою їхніх молекул. Отже, щоб охарактеризувати речовину згідно із сучасною теорією будови, треба вказати ї якісний і кількісний склад, порядок спо-лучення атомів в молекулі, форму і розмір молекули, розподіл електронів у молекулах.
4) Атоми і групи атомів в молекулах взаємно впливають одне на одне. Так, наприклад, гідроксогруп входить до складу як основи, так і кислоти, але властивості цих речовин різні.
11.3 Насичені вуглеводні (алкани, парафіни)
Вуглеводні – найпростіші органічні сполуки. Вони складаються з двох хімічних елементів – Карбону і Гідрогену. Залежно від характеру зв’язків між атомами у вугле-водневому ланцюзі їх поділяють на насичені, ненасичені і ароматичні.
Вуглеводні, в молекулах яких атоми Карбону зв’язані між собою простим зв’яз-ком, а інші їх валентності, насичені атомами водню, називають насиченими.
Алкани – насичені вуглеводні з відкритим ланцюгом. Вони утворюють гомологіч-ний ряд із загальною формулою: СnH2n+2.
Гомологічним рядом називається послідовність подібних за своєю будовою та хі-мічними властивостями речовин, що відрізняються одна від одної за складом молекул на одну або кілька гомологічних різниць. Гомологічна різниця СН2 відповідає одному атому вуглецю та двом атомам водню, які не завжди входять до складу однієї СН2-гру-пи.
Гомологічний ряд алканів:
СН4 метан С2Н6 етан С3Н8 пропан С4Н10 бутан С5Н12 пентан
С6Н14 гексан С7Н16 гептан С8Н18 октан С9Н20 нонан С10Н22 декан
Фізичні властивості
СН4 - безбарвний газ, без запаху, майже удвічі легший за повітря. У воді майже не розчиняється. Розчиняється в органічних розчинниках. С – С4 – гази; С5 – С15 – рідини; далі тверді речовини. Не розчиняються у воді, розчиняються в органічних розчинни-ках.
У природі утворюються внаслідок гниття рослин без доступу повітря. Багато на бо-лотах (болотний газ) – метан, у вугільних шахтах. Також метан утворюється в надрах Землі. Становить основу атмосфери планети. Основне природне джерело насичених вуглеводнів – нафта.
Хімічні властивості.
Зв’язки міцні, низька полярність, важко розірвати С-Н-зв'язок.
1) Реакція вільно радикального заміщення (світло, нагрівання)
Взаємодія з галогенами
СН4 + Сl2 = СН3Сl + НCl хлористий метан (хлорометан)
СН3Cl + Сl2 = СН2Сl2 + НCl дихлорометан
СН2Cl2 + Сl2 = СНСl3 + НCl трихлорометан (хлороформ)
СНCl3 + Сl2 = ССl4 + НCl тетрахлоромнтан (чотири хлористий карбон)
СН4 + 4Сl2 = ССl4 + 4НCl
С2Н6 + Сl2 = С2Н5Сl + НCl хлорометан
2) Горіння
СН4 + 2О2 = 2Н2О + СО2
2С2Н6 + 7О2 = 4СО2 + 6Н2О
3) Крекінг. Розкладання
СН4 = С + 2Н2
2СН4 = С2Н2 + 3Н2
С4Н10 = С2Н4 + С2Н6
Застосування метану:
- відносно дешеве паливо.
Використання продуктів переробки метану:
- сажа – виготовлення гуми, друкарських фарб;
- водень – синтез аміаку;
- хлорометан, трихлорометан – медицина, як знеболював;
- тетрахлоретан – засіб для гасіння вогню.
Використання неповного окиснення метану використовуються для виготовлення пластмас, в органічному синтезі.
11.4 Етилен як представник ненасичених вуглеводнів
Вуглеводні, в молекулах яких атоми Карбону зв’язані між собою кратними (подвій-ними або потрійними) зв’язками, називаються ненасиченими.
Етиленові вуглеводні – це ненасичені аліфатичні вуглеводні з одним подвійним зв’язком. Загальна формула СnН2n.
Гомологічний ряд:
С2Н4 етен (етилен) С3Н6 пропен С4Н8 бутен С5Н10 пентен
С6Н12 гексен С7Н14 гептен С8Н16 октен С9Н18 нонен С10Н20 децен
Фізичні властивості етилену. Безбарвний газ, майже без запаху, малорозчинний у воді, трохи легший за повітря. У природі у вільному стані не зустрічається. Утворю-ється під час переробки нафти.
Хімічні властивості етилену
1) Горіння з утворенням оксиду карбону (ІV) і води. кіптяве полум’я – багато С.
2С2Н6 + 7О2 = 4СО2 + 6Н2О
2) Реакція по –С=С– зв’язку:
а) гідрування (приєднання атомів Гідрогену)
С2Н4 + Н2 = С2Н6
етен етан
б) знебарвлення бромної води (приєднання молекул брому)
СН2=СН2 + Br2 = CH2Br-CH2Br
етен дибромоеиан
в) приєднання галогеноводнів
СН2=СН2 + НBr = CH3-CH2Br
етен бромоетан
г) гідратація (приєднання води)
С2Н4 + Н2О = С2Н5ОН
етен етанол
д) окислення відбувається легко: знебарвлення калій перманганату.
Добування етилену.
1) Дегідратація спиртів (при нагріванні з сірчаною кислотою віднімається від спирту вода)
С2Н5ОН = С2Н4 + Н2О
етанол етен
2) Термічне розщеплення насичених вуглеводнів
С4Н10 = С2Н4 + С2Н6
бутан етен етан
С5Н12 = С2Н4 + С3Н8
пентан етен пропан
3) З дигалогенопохідних
CH2Br-CH2Br + Zn = CH2=CH2+ ZnBr2
4) Дегідрування алканів
С2Н6 = С2Н4 + Н2
Застосування етилену. З етилену добувають ряд цінних продуктів. Насамперед поліетилен, з якого виробляють пластмаси. З етилену добувають етиловий спирт, що застосовується на виробництві. Широко застосовуються продукти приєднання хлору до етилену. Дихлоретан – розчинник і засіб знищення шкідників сільськогосподарсь-ких культур. Хлоретан – анестезійний засіб. Етилен прискорює дозрівання плодів (то-матів, груш, динь, лимонів та ін.).
11.5 Дієнові вуглеводні
Алкадієни, або просто дієни, – вуглеводні з двома подвійними зв’язками С=С. Наз-ви дієнів утворюються від назв алканів з такою самою довжиною карбонового ланцюга шляхом заміни суфікса –ан відповідно на –адієн. У розгалужених ненасичених ненаси-чених вуглеводнів вибір головного ланцюга і напрям нумерації визначається не його довжиною, а передусім наявністю подвійних зв’язків. Група СН2 = має назву метилен.
Для алкадієнів характерні хімічні властивості як і для етиленового ряду (по двом под-війним зв’язкам).
11.6 Алкіни. Ацетилен
Алкіни (ацетиленові вуглеводні) – це ненасичені аліфатичні вуглеводні, що мають один потрійний зв'язок. Вони утворюють гомологічний ряд з загальною формулою СnH2n-2.
Гомологічний ряд:
С2H2 ацетилен (етин) С3H4 пропин С4H6 бутин С5H8 пентин
С6H10 гексин С7H12 гептин С8H14 октин С9H16 нонин С10H18 децин
Фізичні властивості ацетилену. Безбарвний газ, без запаху, малорозчинний у во-ді, легший за повітря.
Хімічні властивості ацетилену.
1) Горіння: кіптявим полум’ям, тому що багато С. у кисні – сліпучо-білим полум’ям (більше 3000оС). Суміш з киснем вибухонебезпечна:
2С2Н2 + 5О2 = 4СО2 + 2Н2О
2) Реакція по –С≡≡С– зв’язку (проходять ступінчасто):
а) гідрування (приєднання атомів Гідрогену).
С2Н2 + Н2 = С2Н4 + Н2 = С2Н6
етин етен етан
С2Н2 + 2Н2 = С2Н6
б) знебарвлення бромної води (приєднання молекул брому)
СН ≡ СН + Br2 = CHBr = CHBr + Br2 = CH2Br2-CH2Br2
етен дибромоеиан дибромоетан
в) приєднання галогеноводнів
СН ≡ СН + НBr = CH2=CHBr + НBr = CH3-CHBr2
етин бромоетен дибромоеиан
Правило Марковникова: рухливий атом Гідрогену із галоген оводню приєднується до атома Карбону з найбільшою кількістю атомів Гідрогену.
д) окислення відбувається легко: знебарвлення калій перманганату.
СН ≡ СН ====== Н-CООН
етин КМnО4 мурашина кислота
Добування етилену.
1) Взаємодія карбіду кальцію з водою
СаС2 + 2Н2О = С2Н2 + Са(ОН)2
кальцій карбід вода етин кальцій гідроксид
2) природний газ – 95% метану (термічний розклад метану):
2СН4 = С2Н2 + 3Н2
Застосування ацетилену. Використовується для газового різання і зварювання металів. Ацетиленово-кисневе полум’я має температуру 3000оС і легко плавить сталь. З ацетилену добувають вихідні речовини для виготовлення пластмас і синтетичних каучуків, він є сировиною для синтезу оцтової кислоти.
11.7 Поняття про полімери
Молекули етиленових вуглеводнів можуть вступати в реакцію сполучення між со-бою, утворюючи довгі ланцюги з високими значеннями молекулярних мас. В резуль-таті реакції утворюється полімер.
Процес послідовного сполучення молекул низькомолекулярної речовини з утво-ренням високомолекулярної називається полімеризацією. Вихідні низькомолекулярні речовини називаються мономерами. Високомолекулярна речовина складається з мак-ромолекул.
Внаслідок полімеризації етилену утворюється полімер етилену – поліетилен.
Поліетилен – твердий, білого кольору, термопластичний, жирний, масний на до-тик матеріал. Горить блакитним полум’ям; розчини кислот, лугів, окислювачів на ньо-го не діють. Забарвлюється в різні кольори, не тоне у воді. Плавиться при температурі 102о – 120оС. У розплавленому стані поліетилен можна надати будь-якої форми.
Застосування поліетилену:
- діелектрик для ізоляції електрод ротів і кабелів;
- пакувальний матеріал для різних виробів і продуктів харчування;
- в сільському господарстві при будівництві теплиць, для покриття плодово-ягід-
них культур і саджанців від замерзання ;
- виготовлення посуду та водогінних труб;
- виготовлення тари для зберігання хімічно агресивних рідин тощо.
Поліпропілен. Близький за властивостями до поліетилену. Твердий, жирний на до-тик, білого кольору термопластичний матеріал. На відміну від поліетилену плавиться при більш високій температурі (160-170оС).
Утворюється внаслідок полімеризації поліетилену.
Поліхлорвініл – термопластичний полімер, стійкий до дії кислот і лугів, має добрі діелектричні властивості, міцний. Практично не горить, але легко розпадається при на-гріванні, виділяючи при цьому гідроген хлорид. На основі поліхлорвінілу виготов-ляють пластмаси (вініпласт, пластикат), які використовуються як замінники шкіри, з них виготовляють газоводогінні труби, технічні волокна.
Тефлон. Дуже стійкий полімер, тому його називають «органічною платиною». Не розчиняється навіть у «царській водці» (суміш нітратної і хлоридної кислот), в орга-нічних розчинниках, стійкий до холоду та нагрівання. неотруйний, світлостійкий.
Застосовується для виготовлення деталей машин і приладів, апаратів, що працю-ють у хімічно агресивному середовищі, та у харчовій промисловості. З нього виготов-ляють посуд (петельні, каструлі) з антипригарним тефлоновим покриттям.
11.8 Арени
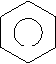
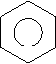
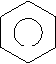
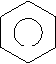
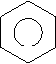
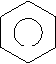
Ароматичні вуглеводні (арени) – органічні сполуки, до складу яких входять одне або декілька бензольних ядер. Найпростіший представник ароматичних вуглеводнів бензин (бензол). С6Н6 – молекулярна формула.
Кільце в середині шестикутника вказує, що в молекулі єдина шести електронна хмара, утворена електронами Карбону. Зв’язки між атомами Карбону не є простими чи подвійними. Бензин не належить ні до насичених, ні до ненасичених вуглеводнів, а є представником ароматичних вуглеводнів.

![]()
Фізичні властивості бензену. Бензен – рідина із специфічним запахом, температу-ра кипіння 80оС, у воді практично нерозчинний. Є розчинником багатьох органічних речовин.
Хімічні властивості бензену.
1) Горіння: сильнокиптявим полум’ям (частинки С), до окисників стійкий, замісники окислюються:
2С6Н6 + 15О2 = 12СО2 + 6Н2О
2) Реакції заміщення.
В присутності каталізаторів (хлориду феруму (ІІІ) та алюміній хлориду, інш.) – іонний механізм. Світло не впливає, каталізатор поляризує молекулу.
а) Взаємодіє з галогенами:
С6Н6 + Br2 = С6Н5Br + НBr
бензен бромбензен
б) Взаємодія з метилбромидом:
С6Н6 + СН3Br = С6Н5 -СН3 + НBr
бензен метилбромид метилбензен
в) Взаємодія з нітратною кислотою (нітрування):
С6Н6 + HNO3 (HО:NO2) = С6Н5- NO2 + H2O
бензен нітратна кислота нітробензен
3) Реакція приєднання:
а) взаємодія з воднем:
С6Н6 + 6Н2 = С6Н12
бензен циклогексан
б) взаємодія з хлором:
С6Н6 + 3Сl2 = С6Н6Сl6
бензен гексахлороциклогексан
Отже, бензен вступає як у реакції приєднання, так і заміщення.
Реакції приєднання у нього відбуваються важче, ніж у ненасичених вуглеводнів, а заміщення – легше, ніж у насичених вуглеводнів Це пояснюється електронною будо-вою молекул бензену.
Бензен не знебарвлює розчин перманганату калію, оскільки виявляє стійкість про-ти дії окисників.
Добування бензену.
1) Хімічна переробка нафти.
2) Дегідрування циклогексану.

–––––––> +3Н2
циклогексан бензен
3) Тримеризація ацетилену
3С2Н2 = С6Н6
Застосування бензену.
Бензен є вихідною речовиною для синтезу великої кількості органічних речовин. Серед них – барвники, лікарські препарати, полімери, отрутохімікати, вибухові речо-вини. Використовується бензен як розчинник.
Похідні бензену використовуються у сільському господарстві. Вони захищають рослини від комах-шкідників, паразитичних грибів, бур’янів. Такі речовини назива-ються пестицидами (зараза, убиваю). В сільському господарстві використовують ін-сектициди – засіб боротьби проти комах-шкідників; гербіциди – для боротьби з бур’я-нами, фунгіциди – для усунення грибкових захворювань, зооциди – для боротьби з тваринами-шкідниками.
11.9 Природні джерела вуглеводнів
У природі вуглеводні зустрічаються переважно у вигляді природного газу, нафти, кам’яного вугілля. Є два способи використання цих горючих копалин. Один – у вигля-ді палива, як джерело енергії, другий – для подальшої переробки. Перший спосіб – це звичайне спалювання, другий – органічний синтез. Природний газ, нафта, вугілля на-лежать до невідновлювальних природних ресурсів. Ця обставина змушує раціонально експлуатувати природні родовища.
Природний газ. У природному газі містяться вуглеводні з низькою молярною мА-сою. Основною складовою частиною його є метан, його масова частка там 80 -90%. Крім метану у природному газі є 2 – 3% його гомологів – етану, пропану, бутану і не-велика кількість домішок – сірководню, азоту, благородних газів, оксиду карбону (ІV) і водяної пари.
Природний газ – цінне паливо, за своєю теплотворністю він перевершує всі відомі види палива. Він є також цінною хімічною сировиною. З нього добувають сажу, во-день, ацителен, хлорпохідні, синтез-газ.
Гази, супутні нафті. До природних газів належать і супутні гази, які розчинні у нафті, містяться над нею і виділяються під час її добування. Вони є сумішшю легких вуглеводнів, хоча, на відміну від природного газу, в них менший вміст метану (до 40%), а більше його гомологів та інших газів.
Раніше попутний газ не знаходив застосування і під час добування нафти його спа-лювали факельним способом. Зараз його уловлюють і використовують як паливо, але головним чином як хімічну речовину.
Нафта. Склад і властивості нафти. Нафта – масляниста рідина темно-бурого або майже чорного кольору з характерним запахом. Вона трохи легше за воду і практично не розчиняється у ній. За хімічним складом нафта є складовою сумішшю вуглеводнів з різною молекулярною масою, головним чином рідких, з домішками інших органічних речовин, що містять азот, кисень і сірку. Звичайно це парафінові вуглеводні, цикло-алкани, ароматичні сполуки, а також розчини неорганічних солей.
Нафту видобувають з надр Землі через свердловини. Сиру нафту звичайно не вико-ристовують. Щоб добути з неї цінні технічні продукти, її піддають переробці.
Перегонка нафти. Первинна переробка нафти полягає в перегонці, тобто розділенні на різні продукти (фракції). Процес перегонки заснований на тому, що різні фракції нафти мають різну температуру кипіння (табл.. 11.2).
Таблиця 11.2 – Вуглеводневі фракції, які добувають при пробці нафти
|
Фракції |
Розміри молекул |
Інтервал температур кипіння компонентів (0С) |
Застосування |
|
Бензин |
С5 – С11 |
Від 400 до 2000С |
Моторне, авіаційне і ав- томобільне паливо. Роз- чинник масел. |
|
Лігроїн |
С8 – С14 |
Від 1200 до 2400С |
Пальне для тракторів, розчинник у лакофарбо- вій промисловості. |
|
Гас |
С12 – С18 |
Від 1800 до 3000С |
Пальне для реактивних і тракторних двигунів. |
|
Газойль |
С18 – С25 |
Від 2700 до 3500С |
Пальне для дизелів, ко- тельне паливо. |
|
Мазут |
Від С20 і вище. Залишок перегонки |
Від 3300 і вище |
Мастила, парафін, вазе- лін, котельне рідке па- ливо, гудрон. |
На виробництві перегонка здійснюється у ректифікаційній колоні. При перегонці нафти ніяких хімічних змін із продуктами не відбувається.
Крекінг нафтопродуктів. Для підвищення виходу бензину і поліпшення його якості застосовують процес, який називається крекінгом (розщеплення). В результаті крекінгу нерозгалужені сполуки перетворюють у більш розгалужені молекули. Відбу-вається також розщеплення важко киплячих фракцій (гасової) у сполуки з меншою мо-лекулярною масою, які як придатні як автомобільне паливо. Крекінг – процес розкладу вуглеводнів нафти на більш леткі речовини. Крекінг дає можливість значно підвищити вихід бензину. Крім рідких продуктів (бензин0, при термічному крекінгу виділяється велика кількість газів, які використовуються як сировина в хімічній промисловості.
Застосовують термічний і каталітичний крекінг. Термічний проводять при високій температурі і підвищеному тискові. Каталітичний крекінг проводять за наявності ката-лізаторів, температурі і атмосферному тиску.
Застосування нафтопродуктів:
- паливні продукти: бензин, гас, мазут;
- сировина для мікробіологічного виробництва білка;
- нафтовий асфальт;
- лікарські мазі, парфумерні вироби, розчинники;
- сировина для хімічної промисловості: етилен, пропілен (для виробництва пласт-мас), бутадієн, ізобутилен (для виробництва синтетичних каучуків, волокон), бензен, стирол, толуол (для виробництва пластмас, синтетичних волокон, каучуків, вибухових речовин), парафін (для виробництва мийних засобів, свічок, кормового білка).
Кам’яне вугілля. Кам’яне вугілля, як і нафта, не індивідуальна речовина. До його складу входять вільний вуглець (до 10%), органічні речовини, що містять Карбон, Гід-роген, Оксиген, Сульфур, Нітроген, мінеральні речовини. Вугілля використовується як паливо, а також в хімічній промисловості.
При хімічній переробці вугілля вилучається величезна кількість цінних речовин. Внаслідок нагрівання до 10000 С без доступу повітря вугілля перетворюється на кокс. Цей продукт на 96 – 98% складається з вуглецю. Застосовується в металургії.
Коксування – це нагрівання кам’яного вугілля без доступу повітря до 10000 С. У ре-зультаті утворюється кокс, кам’яновугільна смола і коксовий газ.
Кам’яновугільна смола і коксовий газ переробляються на коксохімічних заводах.
Продукти коксування кам’яного вугілля:
- кокс;
- кам’яновугільна смола: бензин, гомологи бензену, фенол, гомологи фенолу;
- аміачна вода: амоніак, сульфат амонію, фенол;
- коксовий газ: водень, метан, амоніак, бензен, толуол, сульфат амонію, етилен.
На основі продуктів, виділених із кам’яновугільної смоли, виникли цілі галузі хі-мічної промисловості – виробництво синтетичних барвників, лікарських препаратів, засобів захисту рослин, вибухових речовин тощо.
Вуглеводнева сировина та охорона довкілля. Життя людини пов’язане зі спалю-ванням горючих речовин у побуті, на транспорті, у промисловості. Існує ряд проблем, пов’язаних з цим. Поглинання і випромінювання енергії діоксидом карбону та іншими речовинами створює парниковий ефект. Посилення цього ефекту може мати згубні на-слідки (глобальне підвищення температури та у зв’язку з цим зміна клімату). До цього може призвести підвищення концентрації вуглекислого газу за рахунок спалювання горючих речовин. Останнім часом вміст вуглекислого газу зростає. В результаті пере-робки і використання горючих корисних копалин атмосфера забруднюється шкідливи-ми речовинами. Такими, як оксид карбону (ІІ) СО, оксид сульфуру (ІV) SO2 (утво-рюється з сірки, яка є в бензині, вугіллі) метан СН4, оксиди нітрогену та інш.
Щоб позбутися шкідливих забруднень, треба:
- ощадливо використовувати паливо, пальне;
- вилучати з палива сірку;
- створювати умови повного згорання вугілля та бензину;
- уловлювати відходи після згорання палива за допомогою фільтрів;
- використовувати альтернативні джерела енергії.
Контрольні запитання до теми
Теорія хімічної будови О.М.Бутлерова. Багатоманітність органічних сполук, їх класифікація. Вуглеводні: алкани, алкени, алкіни, арени
1. Сформуйте основні положення теорії Бутлерова.
2. Які сполуки називаються алканами, алкенами, алкінами, аренами?
3. Як з метану добути бензен?
3. Яка маса етанолу утвориться з 45 г етену та 45(н.у.) л води?
4. Напишіть хімічні властивості ненасичених вуглеводнів.
5. Які властивості характерні для аренів?
6. Які спільні властивості для аренів та алканів; аренів та алкенів?
7. Назвіть синтетичні матеріали, їх властивості.
8. Які є природні джерела вуглеводнів?
9. Які міроприємствах є для охорони довкілля при використанні вуглеводневої сиро-
вини.
10. Здійснити цикл перетворень:
Вуглець ––––––> метан ––––––> хлорометан ––––––> етан ––––––> етен ––––––>
––––––> етин ––––––> бензен ––––––> гексахлороциклобензен.
11. Які продукти прегонки нафти людина використовує в своїй діяльності?
Лекція 12
Оксигеновмісні органічні сполуки: спирти, феноли
12.1 Спирти
12.1.1 Насичені одноатомні спирти
Спирти – органічні сполуки, що містять функціональну групу –ОН.
Насичені одноатомні спирти (алканоли, алкоголі) – органічні сполуки, що міс-тять одну функціональну гідроксильну групу–ОН. Загальна формула: СnH2n+1ОН, або R-OH.
Гомологічний ряд: СН3ОН - метиловий спирт (метанол), С2Н5ОН - етиловий спирт (етанол), С3Н7ОН – пропіловий спирт (пропаном), С4Н9ОН – бутанол, С5Н11ОН – пен-таном, С6Н13ОН - гексаном, С7Н15ОН – гептаном, С8Н17ОН – октановий спирт.
Фізичні властивості. Спирти, які містять в молекулі до 15 карбонових атомів, є рі-динами, більше 15 – твердими речовинами. Легші за воду. Нижчі спирти (до пропіло-вого) змішуються з водою у будь-яких відношеннях. Зі зростанням молекулярної маси розчинність у воді зменшується. Вищі спирти практично нерозчинні у воді.
Хімічні властивості.
1) Горіння – світлим полум’ям з виділенням тепла.
С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1374 кДж
2) Взаємодіють з активними металами, утворюючи алкоголяти – кристалічні речовини з властивостями лугів, легко розкладаються водою.
2С2Н5ОН + 2Nа = 2С2Н5ОNа + Н2
С2Н5ОNа +Н2О = С2Н5ОН + NаОН
3) Реакція етерифікації (з кислотами)
С2Н5ОН + СН3СООН = СН2СООС2Н5 + Н2О
етанол оцтова кислота естер оцтово етиловий
4) Взаємодія з галоген оводнями (гідрогенгалогенідами)
С2Н5ОН + Br2 = С2Н5Br + HBr
етанол бромоетан
5) Окиснення – СuO, КMnO4….
а) первинний спирт = альдегід
С2Н5ОН + СuO = СН3СОН + Сu + Н2О
б) вторинний спирт = кетон
6) Дегідратація – tоС, Н2SO4, Al2O3
а) внутрішньомолекулярна з утворенням алкенів (вторинного і третинних відбуваєть-ся за правилом Зайцева: гідроген відщеплюється від менш гідрогенізованого карбону)
С2Н5ОН = С2Н4 + Н2О
б) міжмолекулярна з утворенням естерів (простих ефірів)
С2Н5ОН + ОНС2Н5 = С2Н5 –О– С2Н5 + Н2О
7) Дегідратація і дегідрування
2С2Н5ОН = СН2= СН – СН =СН2 + Н2О +Н2
Добування одноатомних спиртів.
У промисловості
1) Метанол добувають:
а) із синтез-газу:
СО + 2Н2 = СН3ОН
б) під час сухої перегонки деревини (деревний спирт):
2) Гідратація алкенів:
С2Н4 + Н2О = С2Н5ОН
3) Бродіння цукристих речовин:
ферменти
С6Н12О6 =====2С2Н5ОН + 2СО2
дріжджі
У лабораторії
1) Із галагенопохідних, діючи водним розчином лугів:
С2Н5Сl + NaOH = С2Н5ОН + NaCl
2) Відновлення альдегідів
СН3СОН + Н2 = С2Н5 ОН
Фізіологічна дія спиртів на організм людини негативна. Метиловий спирт – сильна отрута! У малих кількостях викликає сліпоту, у великих – спричиняє смерть. Етиловий спирт – наркотик. Під впливом етанолу у людини послаблюється увага, загальмовуєть-ся реакція, порушується корекція рухів. При тривалому вживанні викликає глибокі по-рушення нервової системи, захворювання серцево-судинної системи, травного тракту і зрештою настає важка хвороба – алкоголізм.
Застосування спиртів.
Метанол:
- у промисловому органічному синтезі;
- як розчинник;
- як додаток до бензину.
Етанол:
- виробництво оцтової кислоти;
- як розчинник;
- у парфумах;
- у медицині;
- як паливо;
- у харчовій промисловості.
12.1.2 Багатоатомні спирти
Багатоатомні спирти – органічні сполуки, що містять декілька функціональних гідроксильних груп – ОН.
Двоатомні – дві функціональні групи. СnH2n(OH)2
CH2OH - CH2OH – етандіол (етиленгліколь)
Трьохатомні СnH2n-1(OH)3
CH2OH – CHOH – CH2OH – пропантріол (гліцерин)
Фізичні властивості. Безбарвні, сиропоподібні рідини, солодкуваті на смак, важчі за воду, добре розчинні у воді; мають високу температуру кипіння (етиленгліколь 197оС, гліцерин - 290оС). Гліцерин неотруйний етиленгліколь – сильна отрута.
Хімічні властивості.
1) Взаємодія з лужними металами з утворенням алкоголятів.
2CH2OH - CH2OH + 2Na = 2CH2ONa - CH2ONa + H2
2CH2OH – CHOH – CH2OH + 6Na = 2CH2ONa - CHONa –CH2ONa + 3H2
2) Взаємодіють з галогеноводнями (заміщення -ОН групи)
CH2OH - CH2OH + 2HCl = CH2Cl - CH2Cl + H2O
CH2OH – CHOH – CH2OH + 3HCl = CH2Cl - CHCl –CH2Cl + 3H2O
3) Взаємодія з кислотами з утворенням естерів. Наприклад, нітрування гліцерину.
CH2OH – CHOH – CH2OH + 3HNO3 = CH2ONO2- CHONO2 –CH2ONO2 + 3H2O
три нітрогліцерин
З карбоновими кислотами гліцерин утворює естери, жири, масла.
4) Взаємодія з деякими гідроксидами (на відміну від одноатомних спиртів).
CH2OH - CH2OH + 2NaОН = CH2ONa - CH2ONa + H2О
Якісною реакцією на багатоатомні спирти (гліцерином) є взаємодія з свіже добутим купрум (ІІ) гідроксидом (у надлишку лугу) – яскраво-синій колір.
Застосування.
Гліцерин:
- у косметиці (пом’якшує шкіру);
- у медицині (основа мазей);
- невисихаючі фарби;
- у шкіряному виробництві (запобігає висиханню);
- у текстильній промисловості (надає тканинам м’якості);
- для добування нітрогліцерину.
Етиленгліколь:
- антифризи;
- для синтезу синтетичного волокна – лавсану.
12.1.3 Ароматичні спирти
Феноли – ароматичні сполуки, до складу молекул яких входять гідроксильні групи, зв’язані з ароматичним ядром.
/ОH
Фенол
Фізичні властивості фенолу. Тверда, кристалічна речовина (tпл. 42оС). Червоніє на повітрі через окиснення. За кімнатною температури погано розчинний у воді, при 60оС у будь-яких співвідношеннях, отруйний.
Хімічні властивості.
Обумовлені гідроксильною групою –ОН.
1) Взаємодія з активними металами з утворенням фенолятів.
2C6H5OH + 2Na = 2C6H5ONa + H2
2) Взаємодія з лугами (відмінність від одноатомних спиртів)
C6H5OH + NaОН = C6H5ONa + H2О
Феноляти розкладаються слабкими кислотами
C6H5ONa + СО2 + Н2О = C6H5OН + NaHСО3
3) Якісна реакція на фенол взаємодія з ферум (ІІІ) хлоридом:
3C6H5OH + FeCl3 = [C6H5O]3Fe + 3HCl
ферум (ІІІ) фенолят фіолетовий розчин
Обумовлені бензольним ядром.
Внаслідок зростання електронної густини у кільці полегшується атака кільця частинками, що мають дефіцит електронів (електрофіли). Реакції електрофільного заміщення.
1) Взаємодія з бромною водою:
 / ОН /ОН
/ ОН /ОН
Br Br
+3Br2 = + 3HBr
Br 2,4,6 – трибромомфенол
2) Взаємодія з нітратною кислотою:
 / ОН /ОН
/ ОН /ОН
NO2 NO2
+3НNO3 = + 3H2O
NO2 2,4,6 – тринітрофенол
(пікринова кислота) жовта кристалічна вибухова речовина
Фенол добувають із кам’яновугільної смоли.
Застосування фенолу:
- у медицині як антисептик (карболка);
- виробництво фенолформальдегідних пластмас;
- виробництво барвників, лікарських речовин, вибухових речовин.
Охорона довкілля від промислових відходів, що містять фенол (промислові відходи коксохімічного виробництва). Фенол згубно діє на флору і фауну, у людини викликає опіки і отруєння.
Методи захисту відходів від фенолу:
- каталітичне окислення газів, що містять фенол;
- виділення фенолу розчинниками;
- обробка озоном;
- біохімічний метод.
Контрольні запитання до теми
Оксигеновмісні органічні сполуки: спирти, фенол
1. Які сполуки називаються спиртами?
2. Як класифікують спирти?
3. Які якісні реакції на багатоатомні спирти та фенол?
4. Які спільні хімічні властивості для спиртів?
5. Які реакції називаються реакціями етерифікації?
6. Як з етену отримати натрій етанолят?
Лекція 13
Оксигеновмісні органічні сполуки: альдегіди, карбонові кислоти
13.1 Альдегіди
Альдегіди (алканалі) – це органічні сполуки, молекули яких містять функціональну групу атомів –СОН (альдегідна, або формільна), зв’язану з вуглеводневим радикалом.
Загальна формула: СnH2nO. Найважливіші представники альдегідів наведені в таб-лиці 13.1
Таблиця 13.1 – Представники альдегідів
|
Назва |
Формула |
Температура плавлення |
Температура кипіння |
|
Метаналь |
HCOН |
−92 °C |
−19 °C |
|
Етаналь |
CH3COН |
−123 °C |
20,8 °C |
|
Пропаналь |
CH3CH2COН |
−81 °C |
48,8 °C |
|
Бутаналь |
CH3CH2CH2COН |
−97 °C |
75 °C |
Фізичні властивості. Метаналь – газ, інші нижчі альдегіди – рідини, вищі – тверді. Мурашин та оцтовий альдегіди мають специфічний запах, добре розчинні у воді. Вод-ний 40%-вий розчин формальдегіду називається формалін. Альдегіди мають різкий ха-рактерний запах (наприклад, бензальдегід — запах мигдалю).
Хімічні властивості
Реакції окислення –СОН до -СООН
1) Амоніачним розчином аргентуму оксиду – якісна реакція на альдегіди (реакція «срібного дзеркала»)
СН3СОН + Аq2О = СН3СООН + 2Аq
етаналю оцтова кислота (етанова)
2) Купрум (ІІ) гідроксидом (свіжо виготовленим: NaOH + CuSO4) Cu(OH)2, (II)
R—CHO + 2Cu(OH)2 → R—COOH + Cu2O + 2H2O
червоний колір
3) Повне окиснення.
2СН3СОН + 5О2 = 4СО2 + 4Н2О
Реакції приєднання - внаслідок розриву –СОН
4) Відновлення воднем
СН3СОН + Н2 = СН3 – СН2 –ОН
етаналь етанол
Добування альдегідів.
1) Окиснення одноатомних спиртів (первинних).
СН3 – СН2 –ОН + CuO → СН3-COH + Cu + 2H2O
2СН3 –ОН +2О2 = 2НСОН + 2Н2О
2) Реакція Кучерова (гідратація ацетилену).
СН≡СН + Н2О = СН3–СОН
3) Каталітичне окиснення етилену
2СН2=СН2 + О2 = 2СН3–СОН
4) Окиснення метану
СН4 + О2 = Н–СОН + 2H2O
Застосування етаналю:
- для виробництва оцтової кислоти;
- для лікування алкоголізму.
Застосування метаналю:
- для дезінфікування приміщень (формальдегід);
- для зберігання біопрепаратів (формалін);
- добувають фенолформальдегідні полімери;
- для добування полі формальдегіду (параформ), з якого добувають полімери – замінники металів.
13.1 Карбонові кислоти
Карбоні кислоти – органічні сполуки, що містять одну або декілька карбоксильних груп –СООН (=О карбоніл + - ОН гідроксил). Загальна формула СnН2n+1СООН.
Гомологічний ряд
НСООН метанова (мурашина) СН3СООН етанова (оцтова)
С2Н5СООН пропанова (пропіонова) С3Н7СООН бутанова (масляна)
С4Н9СООН пентанова (валеріанова) С5Н11СООН гексанові (капронова)
Вищі жирні кислоти. Насичені:
С15Н31СООН пальмітинова С17Н35СООН стеаринова
Ненасичені:
С17Н33СООН олеїнова
Фізичні властивості .Мурашина кислота – безбарвна речовина з характерним різ-ким запахом. Кипить при 100,5оС. Оцтова кислота кипить при 118,5оС, а при 16,6оС – твердне, нагадуючи кригу, тому і називається крижаною.
Хімічні властивості.
1) Дисоціація: змінює забарвлення індикаторів: лакмус – червоний.
СН3СООН <==>СН3СОО- + Н+
2) Взаємодія з металами (до Н в ряду напруги металів), оксидами металів, основами, з
солями більш слабких і летких кислот:
2СН3СООН + Zn = (СН3СОО)2Zn + Н2
2СН3СООН + СаО = (СН3СОО)2Са + Н2О
СН3СООН + NaOH = СН3СООNa Н2О
2СН3СООН + СаСО3 = (СН3СОО)2Са + Н2О +СО2
3) Взаємодіє зі спиртами з утворенням естерів:
СН3СООН + СН3ОН = СН3СООСН3 + Н2О
4) Заміщення Н в а-позиції:
СН3СООН + Сl2 = СН2СlCООН + НСl
а- хлороцтова кислота
Добування карбонових кислот.
1) Окиснення альдегідів:
СН3СОН + Аg2О = СН3СООН + 2 Ag
2) Окиснення спиртів:
СН3СН2ОН + О2 = СН3СООН + Н2О
3) Окиснення алканів:
2СН3-СН2-СН2-СН3 + 5О2 = 4СН3СООН + 2Н2О
4) З ацетилену:
СН ≡СН + Н2О =СН3СООН
Застосування карбонових кислот.
Мурашина:
- розчинник;
- медицині (мурашиний спирт);
- відновник
Оцтова:
- 6 – 9%- вий розчин – оцет;
- розчинник;
- виробництво ацетатного волокна;
- синтез барвників;
- синтез ліків (аспірин);
- виробництво пестицидів;
- ацетати.
Суміш стеаринової і пальмітинової кислот – стеарин (свічки).
Контрольні запитання до теми
Оксигеновмісні органічні сполуки: альдегіди, карбонові кислоти
1. Які властивості проявляють альдегіди?
2. Яке практичне застосування має формальдегід?
3. Як добувають карбонові кислоти?
4. Яка маса етаналю потрібна на утворення оцтової кислоти масою 56 г в результаті ре-
акції «срібного дзеркала»?
5. Як з етаналю добути хлороцтову кислоту? Запишіть за допомогою рівнянь хімічних
реакцій.
6. Як пояснити відмінності у агрегатному стані метаналю та метанолу за звичайних
умов?
Лекція 14
Естери. Жири. Мило
14.1 Естери
Естери (складні ефіри) – складаються із залишку кислоти (ацилу), сполученого через атом Оксигену з вуглеводневим радикалом. Вони є похідними спиртів. Загальна формула: R – СООR1, де R – СО залишок кислоти, О - R1 – залишок спирту.
Номенклатура
1) Кислота + спирт – оцтово метиловий ефір СН3СООСН3
2) Спирт + кислота – метилетаноат («ова» - «оат»)
Фізичні властивості. Леткі рідини (відсутність водневих зв’язків), малорозчинні у воді, добре розчинні в органічних розчинниках. Мають приємний запах.
Поширення в природі. Містяться у квітах, фруктах, ягодах, визначають їхній специфічний запах. Бджолиний віск переважно складається із складних ефірів вищих жирних кислот і високомолекулярних одноатомних спиртів.
Хімічні властивості.
1) Гідроліз (омилення). Ця реакція є зворотною щодо реакції етерифікації. Реакція ка-талізується протонами Н+ та гідроксид іонами ОН-. В присутності лугів реакція необо-ротна.
СН3СООС2Н5 + НОН <––––> СН3СООН + С2Н5ОН
оцтова кислота етанол
СН3СООС2Н5 + NаОН <––––> СН3СООNa + С2Н5ОН
оцтовоетиловий естер натрій ацетат етанол
2) Гідрування
С2Н5СООС2Н5 + 2Н2 <––––> С3Н7ОН + С2Н5ОН
пропіоноетиловий естер пропаном етанол
Добування. Реакція етерифікації – кислота + спирт. Для зміщення рівноваги необ-хідний надлишок одного з реагентів або відгін естеру.
СН3СООН + С2Н5ОН <––––> СН3СООС2Н5 + Н2О
оцтова кислота етанол оцтовоетиловий естер
Застосування:
- розчинник лаків та фарб;
- виготовлення штучних фруктових есенцій;
- виробництво парфумів;
- виготовлення полімерів (оргскло);
- виробництво штучних волокон (лавсан);
- виробництво СМЗ і вибухових речовин.
14.2 Жири
Жири – суміш гліцеридів (складних ефірів, утворених гліцерином і вищими (жир-ними) карбоновими кислотами.
Загальна формула:
СН2 – О – СО – R1 R1 – СО - залишки
| різних кислот,
СН – О – СО – R2 R2 – СО - або можуть бути
| однаковими
СН2 – О – СО – R3 R3 – СО - (триацилгліцерин).
Фізичні властивості. Всі легші за воду, нерозчинні у ній, але здатні утворювати стійкі емульсії (молоко); добре розчинні в органічних розчинниках.
Поширення в природі. Тваринні жири – тверді (крім риб’ячого), утворені переважно кислотами: пальмітиновою (С15Н31СООН) і стеариновою (С17Н35СООН).
рослинні жири – рідкі (крім кокосового), утворені переважно ненасиченими кисло-тами: олеїновою (С17Н33СООН) і лінолевою (С17Н31СООН).
Хімічні властивості.
1) Гідроліз водою або лугом:
СН2 – О – СО – R СН2 – ОН
| |
СН – О – СО – R + 3Н2О =====> СН - ОН + 3R- СООН
| | кислота
СН2 – О – СО – R СН2 – ОН
три гліцерид гліцерин
СН2 – О – СО – С17Н35 СН2 – ОН
| |
СН – О – СО – С17Н35 + 3NaОН =====> СН – ОН + 3С17Н35СООNa
| | мило
СН2 – О – СО – С17Н35 СН2 – ОН стеарат натрію
тристеарин гліцерин
2) Гідрування рослинних жирів – перетворення у тверді (маргарин).
СН2 – О – СО – С17Н33 СН2 – О – СО – С17Н35
| |
СН – О – СО – С17Н33 + 3Н2 =====> СН – О – СО – С17Н35
| |
СН2 – О – СО – С17Н33 СН2 – О – СО – С17Н35
трисолеїн тристеарин
Добування. З природних джерел. Синтез економічно невигідний.
Застосування:
- основні продукти харчування;
- сировина для добування мила, стеарину, гліцерину, оліфи.
14.3 Мило
Мило – солі високомолекулярних кислот (пальмітинової та стеаринової). Na – Твер-ді, К – рідкі.
Мийна дія мила. СnH2n+1 (вуглеводневий гідрофобний «хвіст» - відштовхується від води). СООNа (гідрофільна група – притягується до води).
Вуглеводневі гідрофобні «хвости» оточують краплини жиру з брудом і у такому вигляді легко видаляються з тканин, переходячи у воду. але у твердій воді мийна дія втрачається, тому що утворюються нерозчинні солі (Са2+, Мg2+).
2С17Н35СОО- + 2 Nа+ + Са2+ ––––> (С17Н35СОО)2Са+ 2Nа+
Синтетичні миючі засоби СМЗ. Nа – солі кислих складних ефірів Н2SО4 з вищими одноатомними спиртами. Нерозчинних солей не утворюють, менше подразнюють шкіру, не діють послаблююче на тканини.
СН3 – (СН2)n – CH2 – O – SO2 – O- Na+ - натрієва сіль алкіл сульфокислоти.
Застосування:
- миття та прання;
- мило додають до отрутохімікатів для утворення стійких емульсій, які добре змо-
чують листя рослин;
- кальцієві мила (солідол) використовують як мастила.
Охорона довкілля від ПАР (мило і СМЗ).
1) Потрапляння ПАР у водойми викликає бурхливе розмноження мікроорганізмів, що сприяє заболочуванню.
2) Потрібен біологічний та хімічний розклад ПАР на безпечні речовини перед викидом стічних вод.
Контрольні запитання до теми
Естери. Жири. Мило
1. Чим відрізняються тваринні жири від рослинних?
2. Яку масу етилацетату можна добути у реакції етерифікації етанолу масою 1,62 г і
оцтової кислоти масою 1,8 г, якщо вихід продукту становить 75%?
3. Як виходячи з кальцій карбіду, добути натрій ацетат? Скласти рівняння необхідних
реакцій.
4. Від чого залежить мийна дія мила?
5. В чому небезпека СМЗ? Як охороняють довкілля від СМЗ?
Лекція 15
Вуглеводи
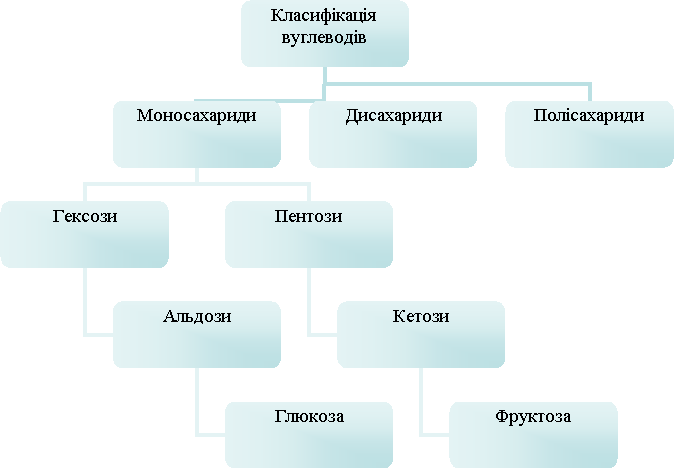
Вуглеводи (сахариди) – це сполуки Карбону, Гідрогену і Оксигену, в яких співвід-ношення між Гідрогеном і оксисеном таке, як у води (СnH2nO)m. Як правило, містять декілька гідроксильних – ОН груп. Класифікація вуглеводів наведена в схемі 15.1.
Схема 15.1 – Класифікація вуглеводів
15.1 Глюкоза – альдегідоспирт
Найважливішим з моносахаридів є глюкоза С6Н12О6, яку називають виноградним цукром. Це біла кристалічна речовина, солодка на смак, добре розчинна у воді. Глюкоза міститься у рослинних та тваринних організмах.
Будову глюкози виведено на підставі вивчення її хімічних властивостей. Глюкоза виявляє властивості спиртів і утворює з металами алкоголяти, складний оцтовий ефір, що має п’ять кислотних залишків. Отже, глюкоза є багатоатомним спиртом. З аміачним розчином оксиду арґентуму вона дає реакцію «срібного дзеркала», що свідчить про наявність альдегідної групи в кінці вуглеводневого ланцюга. Отже, глюкоза є альдегідоспиртом, її молекула може мати будову
СН2ОН – СНОН – СНОН – СНОН –СНОН – С=О-Н
Глюкоза цінна поживна речовина. При окисненні її у тканинах вивільняються енергія, необхідна для нормальної життєдіяльності організмів. Реакцію окиснення можна подати сумарним рівнянням:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О.
Глюкозу застосовують у медицині для приготування лікувальних препаратів, консервування крові, внутрішньовенного вливання тощо. Вона широко використо-вується в кондитерській справі, у виробництві дзеркал та іграшок (сріблення). Нею ко-ристуються при фарбуванні та апретуванні тканин та шкіри.
15.2 Сахароза
З групи дисахаридів найбільше значення має сахароза, яку ще називають буряковим, або тростинним цукром. Емпірична формула сахарози С12Н22О11.
У великих кількостях сахароза міститься в цукрових буряках і стеблах цукрової тростини. Вона міститься також у березовому та кленовому соках, у багатьох плодах і овочах.
Сахароза (звичайний цукор) – біла кристалічна речовина, солодша за глюкозу, добре розчиняється у воді.
Важлива хімічна властивість сахарози – здатність до гідролізу (при нагріванні і наявності іонів водню) При цьому з однієї молекули сахарози утворюється молекула глюкози і молекула фруктози:
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6
сахароза глюкоза фруктоза
Іони водню каналізують процес гідролізу. Сахароза не дає реакції «срібного дзеркала». і не має відповідних властивостей. У цьому її відмінність від глюкози. Молекула сахарози складається із залишків молекул глюкози і фруктози в їх циклічній формі; вони сполучені між собою через атом кисню.
15.3 Полісахариди. Крохмаль. Целюлоза.
Крохмаль і целюлоза належать до полісахаридів.
Крохмаль – білий порошок, без смаку. нерозчинний у холодній воді. В гарячій набухає, утворюючи клейстер.
Крохмаль широко поширений у природі. Він є для різних рослин запасним поживним матеріалом і міститься в них у вигляді крохмальних зерен. Найбагатші на крохмаль зерна злаків: рису (86%), пшениці (до 75%), кукурудзи (до 72%), а також бульби картоплі (до 24%).
Із рослин крохмаль добувають руйнуванням клітин і відмиванням його водою. Гідроліз крохмалю – його важлива хімічна властивість.
(С6Н10О5)п + пН2О = пС6Н12О6 .
Крохмаль не дає реакції «срібного дзеркала», однак її дають продукти його гідролізу.
Розчин йоду забарвлює крохмаль у синій колір. При нагріванні це забарвлення зникає, при охолодженні знову з’являється. Розчин йоду використовується для виявлення крохмалю, а розчин крохмалю (клейстер) – для виявлення йоду.
Застосування крохмалю різноманітне. Він є основним вуглеводом продуктів харчування людини – хліб, крупи, картопля. значні кількості його перероблюють на декстрини, патоку і глюкозу, які використовують у кондитерській справі. З крохмалю, який є в картоплі і зернах злаків, добувають етиловий спирт. Крохмаль використовують як клею чий засіб, застосовують для обробки тканин, крохмалення білизни. У медицині на основі крохмалю виготовляють мазі, присипки, тощо.
Целюлоза, або клітковина, - ще більш поширене ний вуглевод, ніж крохмаль. З неї складаються в основному стінки рослинних клітин. У деревині міститься до 60% целюлози, у ваті й фільтрувальному папері – до 90%.
Чиста целюлоза – біла тверда речовина, не розчинна у воді і звичайних органічних розчинниках, але добре розчинна в аміачному розчині гідроксиду купрум (ІІ). З цього розчину кислоти осаджують целюлозу у вигляді волокон.
Целюлоза також не дає реакції «срібного дзеркала» (не має альдегідної групи), але з кислотами вступає в реакції етерифікації. Це дає підставу розглядати кожну ланку С6Н10О5 як залишок глюкози, що має три гідроксильні групи.
При взаємодії целюлози з концентрованою нітратною кислотою за наявності концентрованої сульфатної кислоти як водовідбираючого засобу утворюється складний ефір – тринітрат целюлози. Це вибухова речовина, яка застосовується при виготовленні пороху.
При звичайній температурі целюлоза взаємодіє лише з концентрованими кислотами.
Подібно до крохмалю целюлоза при нагріванні з розведеними кислотами піддається гідролізу, утворюючи глюкозу.
(С6Н10О5)п + пН2О = пС6Н12О6 .
Гідроліз целюлози, відомий також під назвою оцукрювання, - дуже важлива властивість целюлози. Етиловий спирт, добутий із деревини, називають гідролізним (деревним).
Целюлоза у вигляді бавовнику, льону і прядива йде на виготовлення тканин – бавовняних і льняних. Великі кількості целюлози витрачають на виробництво паперу. Із целюлози виготовляють кілька видів штучного шовку, пластмаси, кіноплівку, бездимний порох, лаки та багато іншого.
Контрольні запитання до теми
Вуглеводи
1. Яка структурна формула глюкози?
2. Яка реакція є якісна реакція на глюкозу? Чому реакція має назву «срібного дзер-кала»? Написати рівняння.
3. В який колір забарвлюється крохмаль при взаємодії з розчином йоду?
4. Яка маса глюконової кислоти утвориться в результаті взаємодії 17 г глюкози з 5 г оксиду срібла?
5. Напишіть рівняння реакцій за схемою, вкажіть умови їх проведення:
сахароза ––––> глюкоза –––––> карбон (ІV) оксид –––––> крохмаль –––––> глю-коза –––––> глюконова кислота.
Лекція 16
Азотовмісні органічні сполуки. Нітросполуки. Аміни. Амінокислоти. Білки
16.1 Нітросполуки
Нітросполуками називаються органічні речовини, в молекулах яких міститься нітрогрупа – NО2 біля атома вуглецю. Загальна формула цих сполук R – NO2.
Введення в органічну речовину нітрогрупи називається нітруванням. Його можна проводити різними способами. Нітрування ароматичних сполук легко здійснити дією суміші концентрованих нітратної і сульфатної кислот (перша виступає в ролі нітрую-чого агента, друга – водовідбираючий).
Нітрування насичених вуглеводнів проводять дією на вуглеводні розведеної нітрат-ної кислоти при нагріванні і підвищеному тиску (реакція М.І. Коновалова).
16.2 Аміни
Амінами називаються похідні аміаку, у якому один, два або всі атоми водню замі-щені органічними радикалами.
Назви амінів звичайно утворюють від назв радикалів, які входять в молекули, з до-даванням закінчення –амін: метиламін (СН3NН2), диметиламін (СН3NНСН3), метил-етилпропіламін.
Аміни повторюють хімічні властивості аміаку, оскільки вони є його похідними. Нижчі аміни за звичайних умов – гази, які мають запах аміаку, середні члени ряду амі-нів – рідини із слабким запахом, вищі – тверді речовини без запаху.
Подібно до аміаку, розчиняються у воді, аміни утворюють основи. Оскільки аміни мають основні властивості, їх часто називають органічними основами.
Аміни, як і аміак, взаємодіють з кислотами, утворюючи солі. Солі амінів – крис-талічні речовини, розчинні у воді. Водні розчини їх проводять електричний струм.
Аміни горять на повітрі.
16.3 Амінокислоти
Амінокислотами називаються органічні сполуки, в молекулах яких міститься одно-часно аміногрупа - NН2 і карбоксильна група – СООН.
Їх можна розглядати як похідні карбонових кислот, які утворюються заміщенням одного або кількох атомів водню у вуглеводневому радикалі на аміногрупу: оцтова кислота СН3СООН – амінооцтова Н2N-СН2-СООН.
Назви амінокислот утворюються від назв відповідних кислот з додаванням префікса аміно-.
Амінокислоти широко розповсюджені у природі – з них добувають білки.
Амінокислоти – безбарвні кристалічні речовини, що плавляться з розкладанням при високих температурах. Легкорозчинні у воді і нерозчинні в ефірі.
За хімічними властивостями амінокислоти – своєрідні органічні амфотерні сполуки. Амфотерні властивості пояснюються взаємним впливом аміногрупи і карбоксильної групи у молекулах амінокислот.
Амінокислоти взаємодіють з лугами, оксидами металів, металами, солями слабких кислот проявляють кислотні властивості - утворюють солі (карбоксильна група), зі спиртами – ефіри.
Взаємодіють амінокислоти між собою, утворюючи пептиди, з низ - білки (за раху-нок пептидних зв’язків – аміногрупи). Так утворюються складні молекули білків.
Амінокислоти утворюються під час гідролізу білків як кінцеві продукти гідролізу. Однак їх можна добути і синтетично:
- при взаємодії аміаку з галогенозаміщеними кислотами. Останні добувають хлоруванням.
СН3СООН + СІ2 = СН2СІСООН + НСІ
оцтова кислота хлороцтова кислота
СН2СІСООН + NН3 = Н2N-СН2-СООН + НСІ
хлороцтова кислота амінооцтова кислота
Амінокислоти необхідні для побудови білків живого організму. Люди і тварини одержують їх у складі білкової їжі. Багато амінокислот застосовується у медицині Як лікувальні засоби, а деякі – у сільському господарстві для підгодівлі тварин. Нерозга-лужені амінокислоти, як біфункціональні мономери, використовуються для вироб-ництва синтетичних волокон, у тому числі капрону і енанту.
16.4 Білки
Білки – це складні високомолекулярні природні сполуки, побудовані з амінокислот за допомогою пептидних зв’язків. Білки мають первинну, вторинну і третинну структуру білкових молекул.
Первинна структура білка – його хімічна структура, тобто послідовність чергування амінокислотних залишків у поліпептидному ланцюгу даного білка.
Вторинна структура білка – форма поліпептидного ланцюга у просторі. Спіральна структура утримується за рахунок водневих зв’язків.
Третинна структура білка – закручений у спіраль поліпептидний ланцюг у просторі (згорнута спіраль –клубок). Утворюється третинна структура за рахунок дисульфід них мостиків, сольових зв’язків, водневого зв’язку.
За хімічним складом білки поділяють на дві групи: 1) прості білки – протеїни, які при гідролізі розкладаються тільки на амінокислоти); 2) складні білки – протеїди, які розпадаються при гідролізі на амінокислоти і речовини небілкової природи (вуглеводи, нуклеїнові кислоти тощо); це сполуки білкових речовин з небілковими.
Оскільки у білках містяться карбоксил і аміногрупа, то, подібно до амінокислот, вони виявляють амфотерні властивості. При дії лугів білок реагує у формі аніона – сполучається з катіоном лугу, утворюючи сіль альбумінат. При дії кислот він стає катіоном, утворюючи сантонін.
Якісними реакціями на білки є кольорові реакції: взаємодія зі свіжедобутим розчином купрум (ІІ) гідроксидом – фіолетове забарвлення. З розчином концентрованої нітратної кислоти – жовте забарвлення, а при додаванні розчину аміаку( нагрівання) – помаранчевий колір. При нагріванні білок змінює свою структуру – денатурує (звертається). Деякі чинники (солі важких металів, луги, кислоти, етиловий спирт, радіація, сильне струшування, нагрівання) руйнують вторинну і третинну структуру білка – денатурація білків.
Контрольні запитання до теми
Азотовмісні органічні сполуки. Нітросполуки. Аміни. Амінокислоти. Білки
1. Як змінюється структура білка під час нагрівання? Як називається цей процес?
2. У яких речовинах містяться білки?
3. Які реакції є якісними на білки?
4. Де знаходять практичне застосування білки?
5. Написати рівняння реакцій за схемою:
Етанол –––––> етаналь –––––> оцтова кислота –––––> хлороцтова кислота -––> аміно-оцтова кислота ––––> мономер білка.
6. Яке значення білків в живих організмах?
СПИСОК ЛІТЕРАТУРИ
1. Буринська Н.М., Величко Л.П. Хімія, 10 кл. – Київ, Ірпінь: ВТР «Перун», 2001.–
192 с.
2. Буринська Н.М., Величко Л.П. Хімія, 11 кл. – Київ, Ірпінь: ВТР «Перун», 2001. –
176 с.
3. Посібник для вступників до вищих навчальних закладів: Хімія/ Хомченко Г.П.:
Пер. з пос. – К.: А.С.К.Ваклер, 1999. – 480 с.
4. Сухан В.В. Хімія: Посібник для вступників до вищих навчальних закладів. – 3-
тє вид. – К.: Либідь, 1996. – 448 с.
5. Хомченко Г.П. та інш. Збірник задач з хімії для вступників до вузів, - 4-е вид. –
К.: А.С.К.Ваклер, 2006. – 320 с.
1


про публікацію авторської розробки
Додати розробку
