Презентація на тему: "Білки як високомолекулярні сполуки"
















Мета уроку:охарактеризувати хімічні властивості білків (гідроліз, кольорові реакції); біологічну роль білків;установити причинно-наслідкові зв'язки між складом, будовою молекул і властивостями нітрогеновмісних органічних сполук;оцінити біологічне значення білків;зробити висновки про властивості білків з урахуванням будови молекул і будови речовин та їхніх властивостей; на основі спостережень.
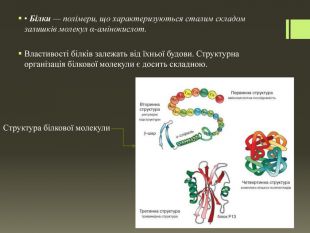
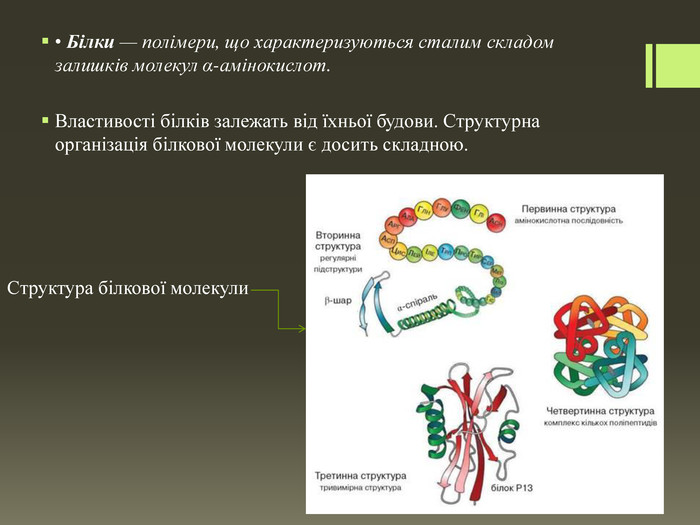
Cклад і будова білкових молекул. Вам уже відомо, що до складу молекул білків входять залишки молекул α-амінокислот. Наявність залишків молекул амінокислот в основі білкових молекул підтвердив Е. Г. Фішер, який уперше синтезував поліпептиди. Різноманітність білкових молекул пояснюється різними комбінаціями амінокислотних залишків. Кожний білок має постійний склад залишків молекул α-амінокислот, які розміщуються в певній, властивій тільки йому, послідовності. Цим визначається просторова будова молекул білків, а отже, і їхні специфічні властивості. Якщо змінити хоча б один залишок молекули амінокислоти в поліпептидному ланцюзі, то утвориться інший за будовою та властивостями білок.
Первинна структура залежить від послідовності амінокислотних залишків, які сполучені між собою пептидним зв'язком. Водночас вам відомо, що до складу молекул амінокислот входять ще й гідроксильні, сульфідні, фенільні групи. Між ними теж виникають зв'язки, скручуючи поліпептидний ланцюг у спіраль. Спіраль утримується завдяки виникненню водневих зв'язків, і таку структуру називають вторинною. Третинна структура виникає внаслідок утворення дисульфідних зв'язків між окремими ділянками спіралі — там, де розташовані характеристичні (функціональні) групи, що містять Сульфур. У більшості білків поліпептидні ланцюги згорнуті особливим чином у компактний клубок — глобулу. Декілька макромолекул, що утворюють третинну структуру, можуть виконувати спільну функцію, взаємодіючи між собою. Унаслідок цих зв'язків виникає білковий комплекс. Це і є четвертинна структура білка.
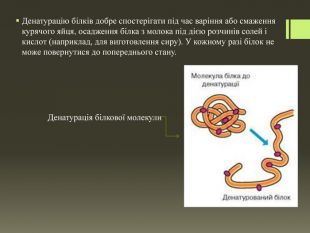
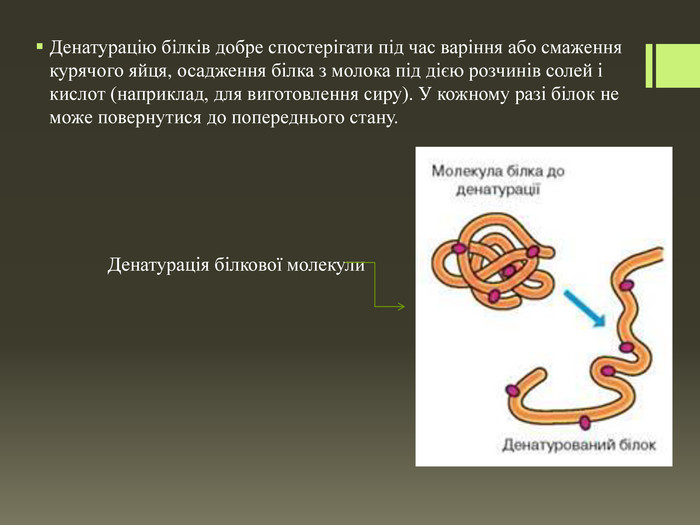
Хімічні властивості білків. У курсі хімії 9 класу ви вже ознайомилися з однією властивістю білків. Пригадайте, що таке денатурація-білка. Отже, під час нагрівання структура білкової молекули змінюється внаслідок руйнування зв'язків, що зумовлюють їхні вторинну, третинну й четвертинну структури. Білки втрачають свої властивості, відповідно до цього змінюються їхні функції. Такий процес називають денатурацією. Білки денатурують за дуже невисоких температур. Наприклад, якщо температура тіла людини підвищується до 42 °С, людина вмирає, тому що білки втрачають свою біологічну активність.
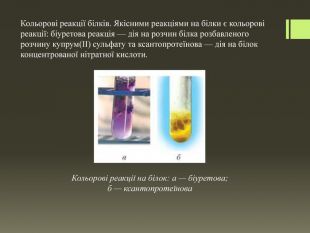
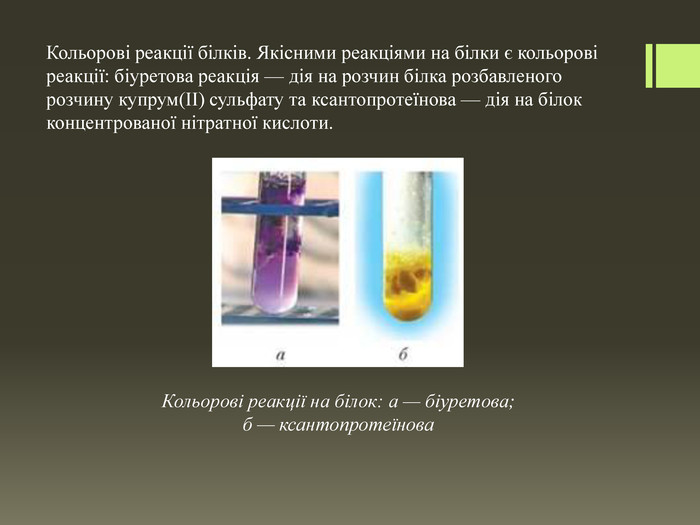
Кольорові реакції білків. Якісними реакціями на білки є кольорові реакції: біуретова реакція — дія на розчин білка розбавленого розчину купрум(ІІ) сульфату та ксантопротеїнова — дія на білок концентрованої нітратної кислоти. Кольорові реакції на білок: а — біуретова; б — ксантопротеїнова
Біологічні функції білків. Білки — високомолекулярні органічні речовини, завдяки яким існує життя, відбувається ріст і розвиток організмів. Ці речовини представлені великою різноманітністю білкових молекул і входять до складу не тільки рослинних, тваринних і клітин людини, а й вірусів, бактерій тощо. Величезна різноманітність їх зумовлена здатністю двадцяти α-амінокислот взаємодіяти між собою в певному порядку з утворенням полімерних молекул, тобто їх природа визначається різною послідовністю розміщення α-амінокислот. Особливість функцій цих сполук полягає в тому, що їх неможливо замінити іншими речовинами, а отже, роль білків в організмі людини є надзвичайно важливою.
Насамперед білки — це будівельний матеріал для клітинних мембран, м'язевих волокон — міофібрил, а міозин та актин виконують функції скорочення м'язів. Білки входять до складу сполучної (колаген) і нервової тканин, волосся та нігтів. Отже, вони виконують будівельну функцію. Білки, завдяки наявності в їхньому складі різних функціональних груп та їх складній будові, здатні транспортувати гормони, гази (кисень), різні поживні речовини до всіх органів. Так, гази до легень і клітин переносить гемоглобін крові, у м'язах це завдання виконує міоглобін. Альбумін крові транспортує жирні кислоти через клітинну мембрану. У цьому полягає транспортна функція білків. Перетравлювання та засвоєння продуктів харчування в організмі здійснюється за допомогою біологічних каталізаторів — ферментів, які пришвидшують біохімічні процеси під час обміну речовин. Унаслідок цього вивільняється велика кількість енергії. Таку функцію білків називають каталітичною.
Білки здатні регулювати обмін речовин. Регуляторну фунцію здійснюють біологічно активні речовини — гормони. Наприклад, білок щитоподібної залози — тіреоглобулін, гормони тироксин, трийодтиронін регулюють вміст мікроелемента йоду в крові. Інсулін — гормон підшлункової залози, забезпечує синтез жирів з вуглеводів, знижує вміст глюкози в крові. За його відсутності виникає важке захворювання — цукровий діабет. Цей гормон, крім регуляторної, виконує ще й запасну функцію, оскільки бере участь у синтезі глікогену. Гормони гіпофізу й пептид пам'яті, страху забезпечують у головному мозку складні психічні й фізіологічні явища. Білки є регуляторами зчитування спадкової інформації з ДНК.
Захисна функція білків полягає в тому, що вони оберігають організми від впливу чужорідних білків. У разі пошкоджень, у відповідь на появу чужорідних — синтезуються антитіла, тобто захисні білки, що протидіють мікроорганізмам і швидко знешкоджують їх. До білків, що виконують захисну функцію, належить інтерферон, який має здатність знешкоджувати чужорідну нуклеїнову кислоту й токсини.
Вам уже відомо, що в організмі разом із синтезом білкових молекул відбувається їх розпад, унаслідок якого, через низку перетворень, утворюються вуглекислий газ і вода. Під час повного окиснення білка масою 1 г виділяється приблизно 17 к. Дж енергії. Вивільнена при цьому енергія використовується на життєдіяльність організму. Крім того, під час розщеплення білків утворюється амоніак, токсична для організму речовина. На його знешкодження теж витрачається енергія. Джерелом енергії є також перетворення деяких амінокислот, які не синтезуються в організмі людини, тому вони у складі білків надходять в організм з їжею. У цьому полягає енергетична функція білків. Білкам властива передача генетичної інформації з покоління в покоління.
Застосування білків Насамперед білки — це харчові продукти. Цінним продуктом, що забезпечує організм білком, є курячі яйця. До білка курячих яєць входять усі вісім незамінних амінокислот: валін, метіонін, триптофан, лізин, фенілаланін, ізолейцин, лейцин, треонін. За дієтичного харчування норма вживання білків становить 90-120 г на добу. Дієтичне харчування зі збалансованою кількістю білків у раціоні має велике значення для зміцнення імунітету людини, бо створює протидію хвороботворним бактеріям. Білки та білкові препарати застосовують як лікувальні засоби. Велике значення для зміцнення імунної системи має застосування гамма-глобуліну. Фармацевтичний препарат гамма-глобуліну створює тимчасовий імунітет проти багатьох інфекційних захворювань. Зокрема, його використовують для профілактики та лікування кору та кашлюку в дітей. У промисловості білки є цінною сировиною для різних виробництв. З шерсті й шовку виготовляють тканини. Із панцерів черепах і рогів тварин виробляють дрібні речі — гребінці, ґудзики, прикраси для інтер'єрів.
ПІДСУМОВУЄМО ВИВЧЕНЕ• Білки — високомолекулярні сполуки, що складаються із залишків молекул α-амінокислот.• Білкові молекули містять значно більше амінокислотних залишків, ніж пептиди; кожному з білків властива певна послідовність їх розміщення. Цим визначаються їхні просторова будова й специфічні властивості.• Структурна організація білкової молекули досить складна: первинна структура підтримується пептидними зв'язками з утворенням поліпептидного ланцюга; вторинна — водневими зв'язками, що спричиняють скручування ланцюга в спіраль; третинна — унаслідок утворення дисульфідних зв'язків виникає глобула; четвертинна структура визначається як комплекс кількох поліпептидів.• Руйнування зв'язків, що зумовлюють вторинну, третинну й четвертинну структури білкової молекули, називають денатурацією.• Якісними реакціями на білки є кольорові реакції: біуретова та ксантопротеїнова.• Білки виконують в організмі важливі біологічні функції: будівельну, транспортну, каталітичну, регуляторну, запасну, захисну, енергетичну.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ1. Поясніть склад молекул білків як високомолекулярних сполук.2. Поясніть утворення пептидного зв'язку.3. Охарактеризуйте хімічні властивості білків (гідроліз, кольорові реакції).4. Складіть рівняння хімічної реакції утворення трипептиду, узявши за основу аміноетанову кислоту.5. Назвіть α-амінокислоти, що утворяться внаслідок гідролізу дипептиду складу:
ЦІКАВО ЗНАТИУ 2017 р. лауреатами Нобелівської премії з хімії стали: швейцарський біофізик Ж. Дюбоше (Університет Лозанни, Швейцарія), американський біофізик німецького походження Й. Франк (Колумбійський університет, США) і шотландський біофізик і молекулярний біолог Р. Хендерсон (Інститут молекулярної біології Кембриджського університету, Велика Британія). Учені отримали нагороду за розробку кріоелектронної мікроскопії високої роздільної здатності для визначення структури біомолекул у розчині. Цей метод дає змогу визначити структуру білків без складного процесу вирощування монокристалів. Суть кріоелектронної мікроскопії полягає в тому, що стало можливим спостерігати молекули, заморожуючи їх зі збереженням природної структури. За допомогою такого мікроскопа можна вивчати живі біомолекули та тривимірні зображення білків у клітинах. Нобелівський комітет, зокрема, наголосив, що вчені допомагають «поліпшити та спростити візуалізацію біомолекул», а кріоелектронна мікроскопія «перемістила біохімію в нову еру» (За матеріалами сайта http://pedpresa.ua/187557-nobelivska-premiya-2017- proryv-u-tehnologiyah-vysoka-literatura-i-nagaduvannya-pro-zagrozu.html).• Хімічний склад гемоглобіну крові відображає формула C3032 H4816 O872 N780 S8 Fe4.
Домашнє завдання: Вивчити конспект, підготувати повідомлення на тему:1. Натуральні волокна тваринного походження: їхні властивості, дія на організм людини, застосування.2. Анілін — основа для виробництва барвників.3. Синтез білків.4. Збалансоване харчування — запорука здорового життя.5. Виведення плям органічного походження.


про публікацію авторської розробки
Додати розробку