Конспект уроку 8 класм Поширення солей в природі та їх практичне значення.
матеріал дає можливість розкрити солей у природі, систематизувати знання учнів про хімічні властивості класів неорганічних сполук на прикладі хімічних властивостей солеудосконалювати навички роботи в колективі й індивідуально; дати учням підґрунтя для само- та взаємооцінювання.
розглянути галузі застосування солей з урахуванням їх хімічних властивостей;й;
Тема: Поширення солей в природі та їх практичне значення.
Мета:
навчальна:
- систематизувати знання учнів про хімічні властивості класів неорганічних сполук на прикладі хімічних властивостей солей;
- пояснювати причини різноманітності речовин,
- встановлювати залежність між складом, властивостями та застосуванням речовин.
- удосконалювати вміння та навички складати хімічні формули, писати рівняння хімічних реакцій;
- удосконалювати навички роботи в колективі й індивідуально; дати учням підґрунтя для само- та взаємооцінювання.
- розглянути галузі застосування солей з урахуванням їх хімічних властивостей;
розвиваюча:
- розвивати пізнавальні здібності, логічне мислення учнів,вміння висловлювати свої думки;
- розвивати пам’ять, увагу, спостережливість та логічне мислення;
- розвивати уміння аналізувати та використовувати набуті знання у
житті;
- формувати самоосвітню, інформативну, соціальну й творчу
компетентності;
- розвивати розумові та інтелектуальні здібності;
- розвивати вміння працювати з науково-популярною літературою;
- розвивати навички самостійної роботи, самоаналізу своєї діяльності на уроці.
виховна:
- підвищувати пізнавальну активність учнів і мотивацію навчання.
Базові поняття та терміни:
- Солі – кристалічні тверді речовини, які можна розглядати як продукти повного чи часткового заміщення йонів гідрогену кислоти металом або гідроксид-іонів основ (чи амфотерних гідроксидів) – кислотними залишками.
- Середні солі - продукти повного заміщення гідрогену кислоти на метал або металоподібну групу атомів.
- Кислі солі – це продукти неповного заміщення гідрогену багато основної кислоти металом.
- Основні солі – продукти неповного заміщення гідроксид-іонів основи чи амфотерного оксиду кислотними залишками.
Міжпредметні зв’язки:
географія,геологія,історія,біологія,українська мова та література.
Обладнання:
Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, електрохімічний ряд напруг металів;комп’ютер, географічна карта.
Тип уроку
Урок поглиблення й систематизації знань.
Методи і методичні прийоми:
індивідуальна робота, фронтальне опитування, повідомлення учнів, гра, групова робота.
Концепція уроку:
- розібратися у виявленні та узагальнити знання про фізичні властивості середніх солей, пояснити учням як вони поширюються у природи та яке практичне значення для людей вони мають.
ХІД УРОКУ
І. Організаційний етап.
Поетичне вітання.
Пролунав уже дзвінок,
Починається урок.
Сьогодні він у нас незвичайний
Тож повернімося обличчям до гостей
І лагідно скажемо: «Добрий день!»
Пошук емоційного контакту.
- Доброго дня. Доброго вам здоров’я.
Мобілізація уваги учнів.
- Любі діти! У наш клас завітали гості щирі. Привітаймо їх у добрий час
посмішкою і миром.
Ми вам раді, люди добрі,
І вітаєм щиро вас,
І запрошуєм ласкаво
На урок у восьмий клас.
Доброго здоров’я вам, люди.
Хай сьогодні радісно вам буде,
Хай мозок повниться знаннями
І цікаво буде з нами.
Психологічний настрій.
- Друзі! Подивіться у вікно. На дворі зима, найулюбленіша пора року
більшості людей і, особливо, дітей . Цієї пори так не хочеться поспішати, метушитися, робити повсякденні справи. Тягне на вулицю, на свіже повітря.
В такі хвилини важливо, щоб святковий настрій завітав у серця тих, з ким ми спілкуємося. Тоді люди зрозуміють один одного: батьки – дітей, діти – батьків, вчителі – учнів, учні – вчителів…
Святковий настрій стане у пригоді кожному з нас і на нашому уроці.
Тепло, сонце, посмішка краще всього пасують людям і природі. Бажаю вам частіше всміхатися, радіти життю, і тоді все у нас буде добре. Сподіваюся, що ви всміхалися і коли виконували домашнє завдання з хімії, тож на уроці отримаєте тільки хороші оцінки.
ІІ. Перевірка домашнього завдання.
Картка-сигнал! (Перевіримо домашнє завдання!)
- Що було задано додому?
- Чи всі виконали домашнє завдання?
- Які були труднощі під час його виконання?
ІІІ. Актуалізація опорних знань.
Фронтальне опитування
- Які класи неорганічних сполук вам відомі?
- Дайте визначення солям, кислотам, оксидам і основам.
- Згадаємо правила складання формул солей.
- Пригадати хімічні властивості солей.
Завдання на взаємоперевірку
- Завершити рівняння хімічних реакцій:
Мg + 2 НС1 = Mg Cl2 + H2
NaOH + HCl = NaCl + H2O
K2CO3 + Ba Cl 2 = Ba CO3 + 2 KCl
2NaOH + Mg SO4 = Mg(OH)2 + Na2SO4
- Здійснити перетворення:
Р → Р2O5 → Н3РO4 → Са3(РO4)2 → СаSO4.
- 4P + 5O2 = 2P2O5
- P2O5 +3 H2O =2 Н3РO4
- 2Н3РO4 +3Ca(OH)2 = Са3(РO4)2 +6H2O
- Са3(РO4)2 +3H2SO4 = 3СаSO4 +2H3PO4
- Півострів «Солі»
«Знайдіть пару» — із запропонованих карток складіть формули солей і назвіть їх.


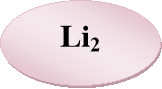
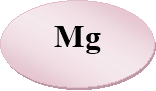


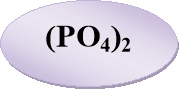
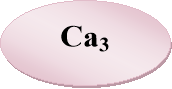
- Розшифруйте казку.
Запишіть зміст казки за допомогою формул і
рівняння хімічної реакції, назвіть тип реакції.
«Товаришували Хлоридна Кислота і Луг — Натрій Гідроксид. Одного разу Хлоридна Кислота запросила в гості товариша. Луг надягнув своє фенолфталеїнове вбрання і став увесь малиновий. День був сонячний. Кислота вирішила показати товаришеві свій красивий сад. Вийшли вони в сад, але що це? Усі квіти, кущі й дерева засохли, хочуть пити й просять допомоги.
- Давай допоможемо їм,— сказала Кислота й задумалася.— Але як?
- Я знаю, як їм допомогти! — вигукнув Луг.— Об'єднаймо мою гідроксогрупу та твій Гідроген.
- Із задоволенням,— погодилася Кислота.
Луг обійняв подругу. Зникли Кислота і Луг. Потекла вода по коренях рослин. Усе ожило навколо, зазеленіло, зацвіло. Усі подякували двом друзям».
- HCl, NaOH.
- NaOH+ фенолфталеїн = малиновий колір
- NaOH + HCl = NaCl + H2O(реакція нейтралізації).
- «Павутинка» ( додаткове завдання).
Необхідно з'єднати між собою назву солі й формулу.
Натрій карбонат NаСІ
Алюміній фосфат А1С13
Кальцій сульфат СаSO4
Натрій хлорид Nа2СO3
Алюміній хлорид А1РO4
Натрій нітрат NaNO3
ІІ. Мотивація навчальної діяльності.
Їх смак нам звичний і приємний.
В них білий колір, зрідка темний.
В природі завжди їх доволі.
Ну, як ви думаєте: що це?
Учитель. Чумацький шлях — це космічна система, яка складається із зірок, пилу й газів.
Чумацький шлях стали називати так з появою чумацької промисловості. Основну частину зірок Чумацького шляху видно восени. У цю пору він перетинає небо в напрямку із заходу на схід. Приблизно в цьому напрямку на території Запорізької й Херсонської областей тече річка Дніпро. Пересуваючись зі сходу на захід, щоби не заблукати, чумаки орієнтувалися вночі на цю світлу доріжку.
Питання до учнів
І.Мета, заради якої чумаки здійснювали настільки тривалий шлях.
- Про яку сіль йдеться? (Кам'яна, кухонна)
- Чому в давнину сіль мала ціну, більшу за золото?
- Перелічіть назви відомих вам кислот.
ІІІ. Вивчення нового матеріалу
(оголошення теми та мети уроку)
Тема: Поширення солей в природі та їх практичне значення.
(учні записують в зошиті).
І на сьогоднішньому уроці ми поговоримо про солі ,їх розмаїтість , розглянемо галузі застосування солей з урахуванням їх хімічних властивостей; закріпимо вміння давати назви солям і складати формули солей за їх назвами; перевіримо наскільки ви вмієте працювати з науковою літературою і глянемо на результати вашої роботи в групах.
Отже, найпоширенішими солями є хлориди, сульфати, карбонати й нітрати.
Робота в мікрогрупах
У класі виділено чотири групи, які самостійно працювали над завданнями:
- перша група — «Нітрати»;
- друга група — «Карбонати»;
- третя група — «Сульфати»;
- четверта група — «Хлориди».
Завдання першої групи «Нітрати»
1. Скласти розповіді про застосування солей.
Нітрати є безбарвними кристалічними речовинами. Добре розчинні у воді. Нітрати лужних і лужноземельних металів називають селітрою. Серед нітратів найпоширенішими є натрій нітрат, арґентум нітрат, калій нітрат.
Натрій нітрат (NaNO3) називають натрієвою, або чилійською селітрою. Великі поклади натрій нітрату, знайдені в Чилі, очевидно, утворилися за рахунок біохімічного розкладання органічних решток. Натрій нітрат застосовують як добриво, окисник у вибухових речовинах, ракетному паливі, піротехнічних сполуках. Він застосовується у виробництві скла й солей Натрію, у тому числі нітриту, який є консервантом харчових продуктів. Натрій нітрат застосовують для готування ковбас, шинки, деяких сортів сиру й риби. Він відновлюється мікроорганізмами до натрій нітриту, який перешкоджає окисненню м'яса й сприяє збереженню рожевого кольору м'ясних виробів, поліпшує смак сирів, облагороджує їх запах.
Арґентум нітрат (АgNO3). Арґентум нітрат використовують для виготовлення дзеркал, а в медицині (ляпісний олівець) — для припікання ранок, як діюча речовина в гомеопатії. Уперше ляпіс застосували лікарі Ян Баптист ван Гельмонт (1579-1644) і Франциск де ла Бої Сильвій (1614-1672), які навчилися одержувати арґентум нітрат взаємодією металу з нітратної кислотою. Вони виявили, що дотик до кристалів отриманою срібною сіллю призводить до появи на шкірі чорних плям, а в разі тривалого контакту — глибоких опіків. Пекельний камінь — це не чистий арґентум нітрат, а його сплав з калій нітратом, іноді відлитий у вигляді паличок — ляпісного олівця. Ляпіс чинить припікальну дію й застосовується здавна. Лікувальна дія арґентум нітрату полягає в пригніченні життєдіяльності мікроорганізмів; у невеликих концентраціях він діє як протизапальний і в'язкий засіб, а концентровані розчини, як і кристали АgNO3, припікають живі тканини.
Калій нітрат (КNO3) — калієва селітра. Безбарвний кристалічний порошок, без запаху. Калій нітрат — це дуже поширений компонент різних видів пороху. Чорний порох — сірий або чорно-сірий порошок, який являє собою суміш 75% калій нітрату, 15% вугілля й 10 % сірки. Калій нітрат — азотне добриво, багате на Калій, необхідний для росту деяких рослин. У стародавності для одержання калій нітрату слугували селітряниці — купи із суміші гною з вапняком, будівельним сміттям і т. п. із прошарками із соломи або хмизу.
(Презентація «Солі нітратної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Рівне, Черкаси, Дніпродзержинськ.
- Дати назви речовинам:
А1NO3, Са(NO3)2, КNO3, LiNO3.
Підсумок роботи: скласти схему «Застосування нітратів».
Завдання другої групи «Карбонати»
1. Проаналізувати текст. Скласти розповідь про застосування солей.
Серед карбонатів найпоширенішими є натрій карбонат, калій карбонат, кальцій карбонат.
Натрій карбонат (Nа2СO3) або сода. Входить до складу сумішей для виробництва скла, мийних засобів. Реагент для збільшення лужності середовища, поліпшення якості глин для глинистих бурових розчинів. Використовується для усунення твердості води під час її підготовки до застосування (наприклад, у казанах), для очищення природного газу від гідроген сульфіду. У хімічній промисловості харчову соду (бікарбонат) застосовують для виробництва барвників, пінопластів та інших органічних продуктів, фтористих реактивів, товарів побутової хімії, наповнювачів у вогнегасниках. У легкій промисловості — у виробництві підошовних гум і штучних шкір, шкіряному виробництві (дублення й нейтралізація шкір), текстильній промисловості (обробка шовкових і бавовняних тканин). У харчовій промисловості — хлібопеченні, виробництві кондитерських виробів, готуванні напоїв.
Калій карбонат (К2СO3). Калій карбонат, або калій вуглекислий застосовують у всіляких галузях промисловості. Найбільше поширення він одержав:
- у будівництві як добавка, що забезпечує захист від впливу морозів;
- хімічній промисловості у виробництві мийних речовин, а також реагентів різного призначення (наприклад, фотосправа);
- текстильній промисловості як компонент технологічного процесу фарбування;
- скляній промисловості в процесах виготовлення тугоплавкого й кришталевого скла;
- сільському господарстві як добриво.
Кальцій карбонат (СаСO3). У природі трапляється у складі вапняку, крейди, мармуру.
Є сировиною для виробництва негашеного вапна СаО, використовується в металургії. Застосовується в буравленні як обважнювач і наповнювач бурових розчинів. Очищений від сторонніх домішок, кальцій карбонат широко використовується в паперовій і харчовій промисловості, під час виробництва пластмас, фарб, гуми, продукції побутової хімії, у будівництві.
Виробники паперу використовують кальцій карбонат одночасно як відбілювач, наповнювач (заміняючи ним дорогі волокна й барвники), а також розкиснювач. Виробники скляного посуду, пляшок, скловолокна використовують кальцій карбонат у величезних кількостях як джерело Кальцію — одного з основних елементів, необхідних для виробництва скла. Виробники пластмаси — одні з основних споживачів кальцій карбонату (понад 50 % усього споживання). Використовуваний як наповнювач і барвник, кальцій карбонат необхідний для виробництва полівінілхлориду, поліефірних волокон (кримплен, лавсан і т. п.), поліолефінів. Вироби з цих видів пластмас можна знайти в себе вдома — це труби, сантехніка, кахельна плитка, черепиця, лінолеум, килимові покриття і т. п. Кальцій карбонат становить порядку 20% барвного пігменту, використовуваного під час виробництва фарб.
Будівництво — ще один з основних споживачів СаС03. Шпаклівки, різні герметики — усі вони містять його в значних кількостях. СаС03 є найважливішою складовою частиною виробництва продукції побутової хімії (засобів для чищення сантехніки, кремів для взуття), товарів особистої гігієни (наприклад, зубної пасти), а також харчової та медичної промисловості.
Кальцій карбонат також широко використовується в очисних системах, як засіб боротьби із забрудненням навколишнього середовища, з його допомогою відновлюють кислотно-лужний баланс ґрунту.
(Презентація «Солі карбонатної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Крим, Карпати, Донбас, Львівська область.
- Дати назви речовинам:
А12(СО3)3, СаСО3, К2СО3, Lі2СO3.
Підсумок роботи: заповнити схему «Застосування карбонатів».
Завдання третьої групи «Сульфати»
1. Проаналізувати текст. Скласти розповідь про застосування солей.
Серед сульфатів найпоширенішими є кальцій сульфат, натрій сульфат, барій сульфат.
Кальцій сульфат (СаSO4). Кальцій сульфат у природі часто трапляється у складі мінералу гіпсу (СаSO4 ·2Н2O). За температури приблизно 150 °С переходить у так званий алебастр (2СаSO4 · Н2O), який широко використовується в будівництві, входить до складу швидкотвердіючих в'язких засобів для ізоляції зон поглинань. У разі додавання до бурових розчинів у складі ангідриту (СаSO4) або гіпсу (СаSO4 2Н20) надає стійкості глинистим породам, які розбуравлюються. Алебастр також використовується для відливу різних художніх виробів. У медицині з алебастру роблять гіпсові пов'язки, використовувані в разі перелому кісток.
Натрій сульфат (Nа2SO4) трапляється в природі в безводному вигляді (тенардит) й у складі декагідрату (мірабіліт, глауберова сіль). Він входить до складу астрахоніту, вантгоффіт, глаубериту Nа2Са(SO4)2. Найбільші запаси натрій сульфату — у країнах СНД, а також у , Чилі, Іспанії. Тривалий час його мало використовували. Тепер ця речовина — основа паперової промисловості, тому що Ка2SO4 є головним реагентом у сульфатному варінні целюлози для приготування коричневого обгорткового паперу й гофрованого картону. Деревні ошурки переробляють у гарячому лужному розчині натрій сульфату. Він розчиняє лігнін (компонент деревини, який з'єднує волокна) і звільняє волокна целюлози, які потім відправляють на машини для виготовлення паперу. Розчин, який залишився, випарюють, поки він не набуде здатності горіти, даючи пару для заводу й тепло для випарювання. Розплавлені сульфат і гідроксид Натрію стійкі до дії полум'я й можуть бути використані повторно. Менша частина натрій сульфату застосовується під час виробництва скла й мийних засобів. Nа2SO4 використовують у виробництві соди й скла. З водяних розчинів кристалізується десятиводний гідрат Ка2SO4 10Н2О, що має назву глауберова сіль. Глауберову сіль застосовують у медицині як проносне.
Барій сульфат (ВаSO4) — безбарвна речовина, яка не розчиняється у воді й кислотах. Його використовують у медицині під час рентгенівських досліджень шлунково-кишкового тракту, тому що йони Барію поглинають рентгенівське випромінювання. Також використовують як компонент для піротехнічної промисловості, оскільки йони Барію забарвлюють полум'я в зелений колір.
(Презентація «Солі карбонатної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Карпати, Разданське.
- Дати назви речовинам:
А12(SO4)3, СаSO4, К2SO4, Li2SO4.
Підсумок роботи: заповнити схему «Застосування сульфатів».
Завдання четвертої групи «Хлориди»
1. Проаналізувати текст. Скласти розповідь про застосування солей.
Серед хлоридів найпоширенішими є натрій хлорид, калій хлорид, ферум(III) хлорид.
Натрій хлорид (NаСl). Про широту використання цієї солі свідчить той факт, що світовий видобуток цієї речовини становить 200 млн т. Цю сіль широко застосовують у харчовій промисловості, вона є сировиною для одержання хлору, хлоридної кислоти, натрій гідроксиду, соди (Nа2С03). ЇЇ використовують у нафтовій промисловості, наприклад, як добавку в бурові розчини для попередження утворення каверн під час буравлення свердловин, як регулятор термінів схоплювання цементних сполук, що тампонують, для зниження температури замерзання (антифриз) бурових і цементних розчинів. Розчини натрій хлориду широко використовують у медичній практиці як допоміжну речовину — для розчинення лікарських препаратів. NaСІ — необхідна приправа до їжі, використовується для консервування харчових продуктів.
Калій хлорид (КСl). Є поширеним калійним добривом.
Крім збільшення врожайності, калійні добрива підвищують якісні характеристики вирощуваної продукції: це проявляється в підвищенні опірності рослин до захворювань, підвищенні стійкості плодів під час зберігання й транспортування, а також поліпшенні їх смакових і естетичних якостей.
Феру(III) хлорид (FеС13). У поєднанні з лугом використовується для очищення води від гідроген сульфіду, під час буравлення свердловин водою, як добавка до цементів з метою підвищення їх стійкості до сірководню, для очищення води від зважених частинок, у хімічних лабораторіях (як реактив), текстильній промисловості (як просочення під час фарбування тканин).
(Презентація «Солі карбонатної кислоти)
- З допомогою кольорових прапорців позначити на географічній карті основні поклади солей. Крим, озеро Сиваш, Одеська область.
- Дати назви речовинам:
А1С13, СаС12, КС1, LіСl.
Підсумок роботи: заповнити схему «Застосування хлоридів».
IV. Систематизація знань.
Заповнення таблиці
|
Група солей |
Назва солі |
Формула солі |
Родовище |
Застосування |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розв’язання задачі.
Задача. Відоме прислів'я говорить: «Людину впізнаєш, коли з'їш із нею пуд солі». Відомо, що добова потреба людини в натрій хлориді становить 0,215 моль. Скільки часу людям необхідно прожити разом, щоби довідатися один про одного? (Один пуд дорівнює 16,38 кг.)
Дано: Розв’язання
![]() υ= 0,215 моль 1.Знаходимо масу солі, що необхідна людині на добу:
υ= 0,215 моль 1.Знаходимо масу солі, що необхідна людині на добу:
m=16,38 кг. M(NaCl) = 23 + 35,5 = 58,5 г/моль
![]() час - ?
час - ?
M =![]() ; m = M υ .
; m = M υ .
m(NaCl) = M(NaCl) · υ(NaCl) = 58,5 · 0,215 =12,6 г
2.Знаходимо, за скільки днів людина з’їсть 16,38 кг солі.
(16,38 · 1000) : 12,6 = 1300 днів або 3,6 роки.
Відповідь: Людям необхідно прожити разом 3,6 роки.
V . Домашнє зав дання.
- Опрацювати параграф
- Виконати завдання №
- Повторити : Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів і продуктів реакції
- Придумати хімічні казки, ребуси, загадки про основні класи неорганічних сполук, їх фізичні та хімічні властивості.
1. Урок на тему «Солі, їх поширення у природі» Осмінкіної Л. М. СЗШ № 28, м. Астрахань.
2. Урок на тему «Хімічні та фізичні властивості солей» Сискової Р. Ф., вчителя хімії, м. Челябінськ, СОШ №118.
3. Ф. А. Деркач "Хімія", - науково-методичний посібник. – Київ, 2008.
4. Л. Б. Цвєткова «Неорганічна хімія» – 2-ге видання, виправлене і доповнене. – Львів, 2006.
5. В. В. Малиновський, П. Г. Нагорний «Неорганічна хімія» - Київ, 2009.
1


про публікацію авторської розробки
Додати розробку
