Фізичні властивості оксидів. Поширеність у природі та використання оксидів.
Мета: ознайомити учнів з фізичними властивостями оксидів, їх поширенням у природі та використанням; розвиток вміння класифікувати неорганічні речовини, складати назви речовин за формулою та навпаки; розвивати вміння аналізувати, порівнювати, виділяти головне та робити висновки, встановлювати залежність між складом та властивостями речовини; формувати самоосвітню, інформативну та творчу компетентність, виховувати сумлінність, здатність до переборення труднощів, працелюбство, екологічну культуру.
Розробка уроку до підручника О. В. ГригоровичТема. Фізичні властивості оксидів. Поширеність у природі та використання оксидів.
Мета: ознайомити учнів з фізичними властивостями оксидів, їх поширенням у природі та використанням; розвиток вміння класифікувати неорганічні речовини, складати назви речовин за формулою та навпаки; розвивати вміння аналізувати, порівнювати, виділяти головне та робити висновки, встановлювати залежність між складом та властивостями речовини; формувати самоосвітню, інформативну та творчу компетентність, виховувати сумлінність, здатність до переборення труднощів, працелюбство, екологічну культуру.
Тип уроку: комбінований урок.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва, комп’ютер, таблиця розчинності кислот, основ і солей у воді, зразки оксидів як демонстраційний матеріал.
Хід уроку
І. Організаційний момент.
Вправа «Посмішка». Учні вітаються із сусідом праворуч, а потім - ліворуч. Побажанням вдалого уроку промовляючи з посмішкою.
ІІ. Актуалізація опорних знань.
- Бліц-опитування.
На які класи поділяють складні речовини?
Які речовини складаються з двох елементів один з яких Оксиген?
До складу яких речовин входить катіон Гідрогену?
Кислотний залишок входить до складу ….
Основи можна визначити за наявністю …
- Хімічний диктант.
Серед запропонованих речовин виберіть окремо кислоти, основи, солі та оксиди, запишіть їх у відповідні колонки таблиці.
К2O, H2S, CO, Fe(OH)2, Na2SО3, SO2, HNO3, Al2(SO4)3, ZnO, NaOH:
|
Оксиди |
Кислоти |
Основи |
Солі |
|
|
|
|
|
Взаємоперевірка за зразком. При перевірці обговорюється класифікація поданих речовин (фронтально).
3. Прийом «Міні-практикум».
Складіть формули сполук, що мають такі назви:
Магній оксид, нітроген (V) оксид, ферум (ІІІ) оксид, силіцій (ІV) оксид, літій оксид, нітроген (ІІІ) оксид, хлор (V) оксид, сульфур (VІ) оксид.
Учні виконують завдання індивідуально. Потім обговорюють відповіді у парах після чого правильні відповіді виводяться на екран і обговорюються фронтально. Самооцінювання за зразком.
ІІІ. Мотивація пізнавальної діяльності.
Вода, пісок, газ вуглекислий,
Ще чадний газ або сірчистий.
Два елемента є в усіх
І Оксиген один із них.
І треба знати вже усім
Що мова йде тут про ……….? (оксид)
Оголошення теми і мети уроку.
IV. Формування вмінь і навичок.
-
Будова та фізичні властивості оксидів.
- Бесіда.
Які типи хімічного зв’язку характерні для неорганічних речовин?
Які типи кристалічних ґраток розрізняють? Наведіть приклади.
Як впливає тип кристалічної ґратки на фізичні властивості?
Розповідь вчителя.
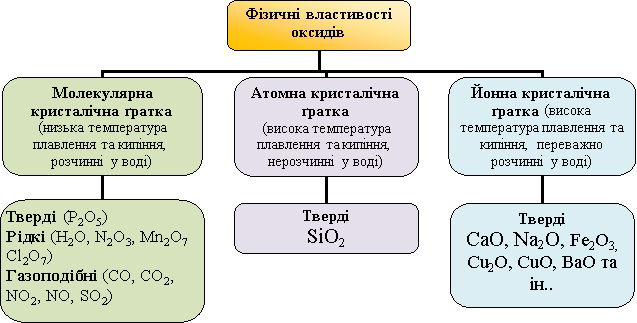
Властивості оксидів, як і інших речовин, залежать від їхньої будови, тобто від того, з яких частинок вони складаються (атомів, молекул, йонів).У йонних оксидах протилежно заряджені йони сильно притягуються між собою, тому ці оксиди за звичайних умов є твердими, мають високу температуру плавлення,більшість нерозчинні у воді, інші з нею реагують. Між молекулами притягання дуже слабке, тому оксиди з молекулярною будовою характеризуються невисокими температурами плавлення і кипіння, різним агрегатним станом за звичайних умов, розчинністю у воді, деякі мають запах. Оксиди з атомною будовою є твердими, із високими температурами плавлення і кипіння, нерозчинні у воді. Йонні оксиди (СаО, Na2O), молекулярні (H2O, SO2, CO2), атомні (SiO2).
Спільне складання опорної схеми:
- Демонстрація зразків оксидів: СаО, CuO, Cr2O3, Fe2O3)
Порівняйте подані зразки оксидів. Чим вони відрізняються?
За забарвленням (СаО-білий, CuO – чорний, Fe2O3 – бурий, Cr2O3– зелений)
- Використання та поширення оксидів.
2.1.Робота в парах. Опрацюйте матеріал підручника «Використання та поширення оксидів» та встановіть відповідність.
1. Н2О
2. Al2O3
3. SiO2
4. CO2
5. SO2
6. NO2
7. Fe2O3
8. СаО
9. MgО
10. ZnO
А) виробництво скла.
В) виготовлення лікарських препаратів.
Д) роса
Е) утворюється при вивержені вулканів.
Ж) для обробки металевих поверхонь.
И) бере участь у процесі фотосинтезу.
О) причина виникнення кислотних дощів.
Т) виготовлення феромагнітних покриттів.
Ц) основа для виготовлення білої фарби.
Я) виробництво вапна.
Відповідь: 1-Д; 2-Ж; 3-А; 4-И; 5-Е; 6-О; 7-Т; 8-Я; 9-В; 10-Ц.
- Гра “Шифрувальник”. Необхідно якнайшвидше розшифрувати вираз про найпоширеніший оксид. Принцип шифрування – кожна цифра означає букву. Використайте для цього відповідь з попереднього завдання.
9 6 1 3 – 10 5 24778!
Відповідь: Вода – це життя!
- Прийом «Міжпредметні зв’язки».
Завдання. Використовуючи атлас України (мінерально-сировинні ресурси) нанесіть на контурну карту місцезнаходження родовищ Al2O3, Fe2O3, ТіО2.
V.Закріплення вивченого матеріалу.
1. Карбон (II) оксид відомий у народі як чадний газ. Він блокує дію гемоглобіну, викликаючи задуху. Де буде розміщуватися чадний газ у приміщенні. Відповідь підтвердіть розрахунками.
2.Рубін здавна вважається класичним ювелірним каменем і зважується у каратах. Найбільший ювелірний рубін мав масу 400 каратів (1 карат-0,2 г). Визначте масу алюмінію, який містився у даному рубіні.
VI. Підсумок уроку.
Учитель разом з учнями підбиває підсумки уроку, виставляє оцінки, дякує найбільш активним за сумлінну роботу.
VII. Домашнє завдання.
Опрацювати §29, виконати вправу 1-3.
Творче завдання: придумати рекламу одного оксиду на вибір.
-
Урок гарний.Дякую.


про публікацію авторської розробки
Додати розробку
