Презентація до уроку на тему " Хімічний зв'язок"
Про матеріал
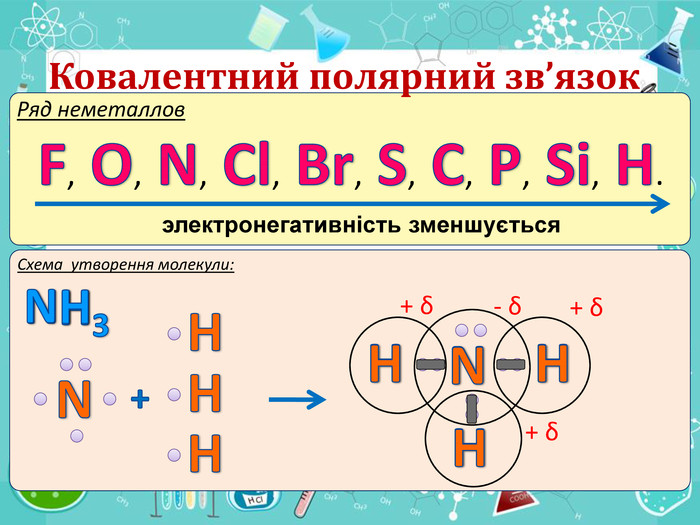
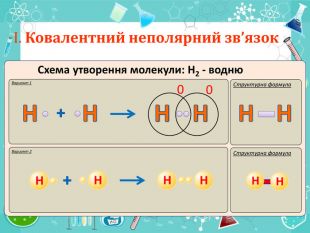
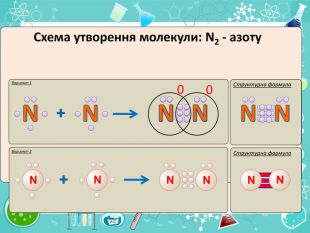
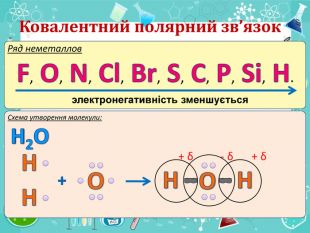
Мета презентації сформувати уявлення про природу хімічного зв'язку; механізм утворення ковалентного та йонного зв'язку;
сформувати навички складання структурних формул та визначати види зв'язку.
Перегляд файлу
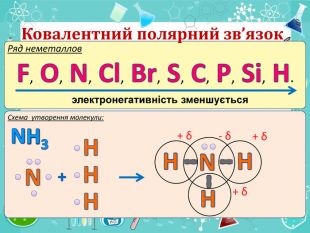
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






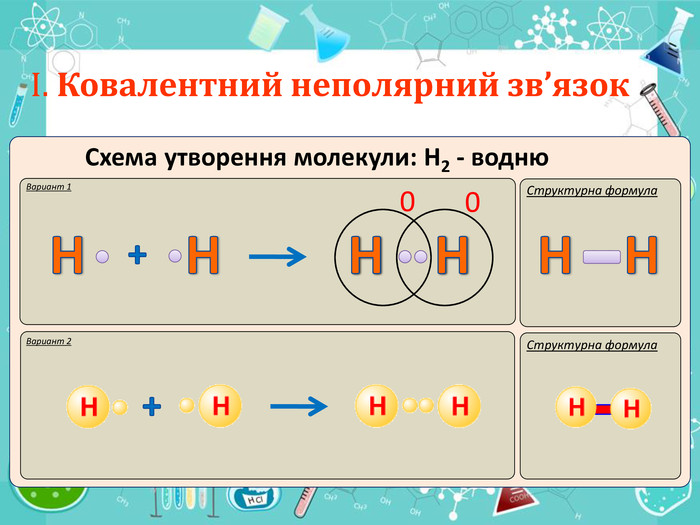
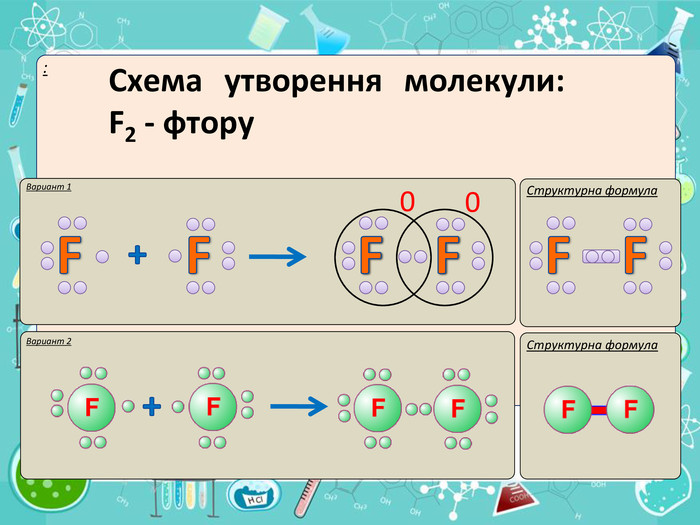
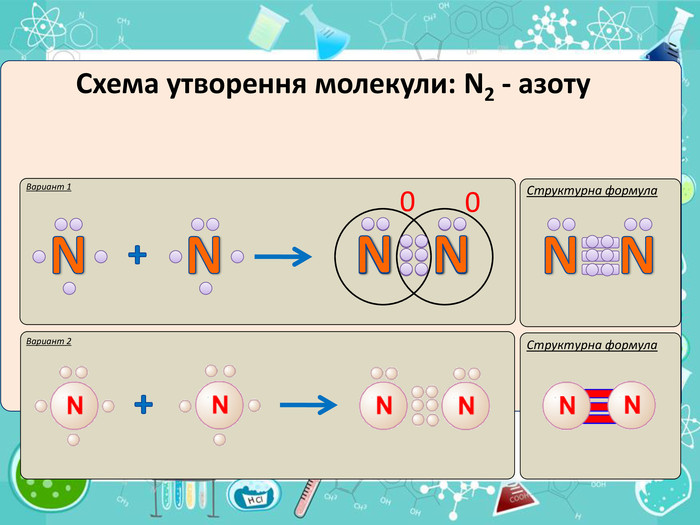



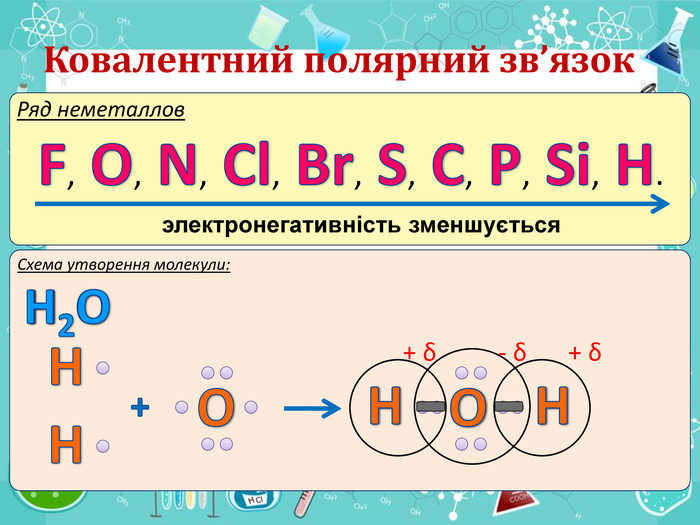

























-

Коверко Ірина Олександрівна
11.09.2025 в 22:10
Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
24.11.2022 в 16:36
Дуже дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
15.11.2022 в 21:44
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Козлова Вiта
14.11.2022 в 10:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ivanenko Olena
22.09.2022 в 09:08
Дякую за вашу роботу. Презентація допомогла в підготовці до уроку.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мельник Людмила Іванівна
12.09.2022 в 21:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Обертінська Вікторія
27.09.2021 в 23:16
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Yacenko Olena
18.11.2020 в 19:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кушерец Анна
29.10.2019 в 13:44
Дякую за розробку!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Golubovska Irina
13.02.2018 в 22:01
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 7 відгуків