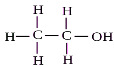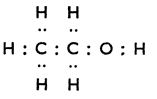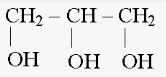Конспект уроку 9 клас Урок №47. Метанол, етанол, гліцерол, їхні молекулярні та структурні формули, фізичні властивості. Функціональна гідроксильна група.
1
9 клас Урок №47. Метанол, етанол, гліцерол, їхні молекулярні та структурні формули, фізичні властивості. Функціональна гідроксильна група.
Мета:
- освітня: сформувати уявлення про оксигеновмісні органічні сполуки, дати поняття про спирти та їхню функціональну групу, ознайомити учнів із представниками спиртів – метанолом , етанолом та гліцерином, навчити записувати їхні молекулярні , електронні та структурні формули; розглянути фізичні властивості спиртів і визначити їх залежність від утворення водневого зв’язку між молекулами.
- виховна: сформувати науковий світогляд учнів при вивченні фізичних властивостей спиртів, їх фізіологічного впливу на організм; сприяти естетичному, екологічному вихованню;
- розвиваюча: розвивати спостережливість учнів, пізнавальний інтерес до предмету; розвивати вміння узагальнювати, робити висновки.
Тип уроку: Урок засвоєння нових знань та вмінь.
Форми роботи: розповідь вчителя, робота з текстом підручника, опорною схемою.
ХІД УРОКУ
І. Організація класу. Підсумки контрольної роботи
ІІ. Мотивація навчальної діяльності учнів. Активація пізнавальної діяльності учнів
Ми закінчили вивчати тему «Вуглеводні». У житті ви будете часто зустрічатися з цією групою речовин. Більшість вуглеводнів використовують у хімічній, паливній промисловості і в побуті.
Давайте пригадаємо, що ми знаємо з вивченої теми.
- Що таке вуглеводні? ( вуглеводні – це сполуки, що складаються з вуглецю і водню, тобто, Карбону та Гідрогену)
- Які класи вуглеводнів ви вивчали? ( насичені і ненасичені)
- Чим вони відрізняються один від одного? ( насичені містять всі одинарні зв’язки між атомами Карбону. Ненасичені один подвійний або потрійний зв’язок)
- Які речовини називають гомологами? ( гомологи – речовини, подібні за будовою та хімічними властивостями, але відрізняються один від одного на одну або кілька груп СН2)
- Які класи органічних сполук існують ще? (робота по опорній схемі).
Багато органічних сполук містять у своїх молекулах, крім атомів Карбону і Гідрогену, ще й атоми Оксигену. Такі сполуки називаються оксигеновмісними. І ми розпочинаємо ознайомлення з ними. Оксигеновмісні сполуки поділяються на класи – клас спиртів, клас карбонових кислот, клас естерів тощо. Сьогодні на уроці ми ознайомимося із класом спиртів.
Отже, тема уроку: «Метанол, етанол, гліцерол : будова молекул, фізичні властивості» .
ІІІ. Вивчення нового матеріалу.
- Функціональна група.
Оксиген, як правило, входить до складу органічних сполук у вигляді груп атомів. Такі групи називають функціональними.
Наприклад:
-ОН – гідроксильна група
-СОН – альдегідна група
-СООН – карбоксильна група.
Функціональні групи – це групи атомів, що визначають фізичні й хімічні властивості речовин.
Якщо замінити атом Гідрогену в карбоновому ланцюзі на гідрорксильну функціональну групу, виходить спирт .
Завдання: Напишіть структурну формулу метану і етану і один атом гідрогену замініть на групу ОН.
- Які речовини вийшли? .
От ми вже почали знайомство з одним з найважливіших класів органічних речовин – спиртами.
- Як можна відрізнити спирти від інших класів органічних сполук?
Яке ж визначення спиртам ви можете запропонувати? .
2) Спирти
Органічні речовини, молекули яких містять одну або кілька функціональних гідроксильних груп, з’єднаних з вуглеводневим радикалом, називаються спиртами.
 Або
Або
Спирт, що містить одну функціональну групу ( ОН) - називається одноатомним. Загальна формула цього одноатомного спирту має наступний вигляд: СnH2n+1OH
Представниками одноатомних спиртів є метанол та етанол
Спирт - який містить декілька функціональних груп (ОН) називається багатоатомним.
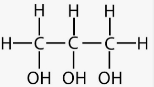
Одним з представників багатоатомних спиртів є гліцерин, формула якого С3Н5(ОН)3.
3). Класифікація спиртів.
Спирти
|
Одноатомні |
Багатоатомні |
|
Молекула містить одну гідроксильну групу. ROH CH3OH, C2H5OH СnH2n+1OH СnH2n+2O
|
Молекула містить декілька гідроксильних груп. R(OH)n CH2 – CH2 CH2 – CH – CH2 │ │ │ │ │ OH OH OH OH OH
|
Існує кілька класифікацій спиртів.
За кількістю гідроксильних груп:
- Одноатомні ;
- Багатоатомні
За природою вуглеводневого радикала:
- Насичені;
- Ненасичені;
- Ароматичні
4). Номенклатура спиртів.
А) Відповідно до систематичної номенклатури, назви спиртів походять від назви відповідного вуглеводня з додаванням суфікса –ол ( метанол, етанол).
Б) існують і інші номенклатури, наприклад, етиловий спирт, метиловий спирт. У сучасній науковій хімічній літературі вам траплятиметься й інша назва гліцерол - гліцерин
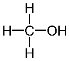
CH3OH метанол, метиловий спирт ![]()
C2H5OH етанол, етиловий спирт ![]()
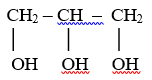 пропантріол, гліцерол, гліцерин
пропантріол, гліцерол, гліцерин
4. Формули спиртів
|
Назва спирту Молекулярна формула |
Структурна формула |
Скорочена структурна формула |
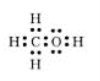
Електронна формула |
|
CH3OH метанол |
|
CH3-OH |
|
|
C2H5OH етанол |
|
CH3- CH2 - OH |
|
|
C3H5 (OH)3 гліцерол , гліцерин
|
|
|
|
5. Полярність молекул спирту
Зв’язки між атомами Оксигену та Гідрогену полярні
![]()
![]()
Завдяки полярності та кутовій будові молекул спирту, між молекулами утворюється водневі зв’язки , тому у гомологічному ряду насичених одноатомних спиртів немає газуватих речовин.
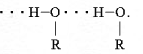
Водневі зв’язки виникають також між молекулами спирту і води.
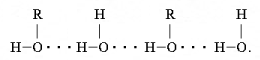
Водневий зв'язок:
- Підвищує температуру кипіння.
- Знижує леткість.
- Сприяє розчинності у воді.
Молекули спирту та води мають кутову будову. Оскільки атом Оксигену більш електронегативний, ніж сполучені з ним атом Гідрогену , то спільна електронна пара зміщується до Оксигену. Внаслідок цього атом Оксигену набуває невеликого ( часткового) негативного заряду, а атом Гідрогену – невеликого ( часткового позитивного заряду. Заряд невеликий але і молекулам спирту і молекулам води достатньо, щоб виникла сила притягання між різнойменними частковими зарядами на Гідрогені однієї молекули та Оксигену іншої. Як видно з малюнку атом Гідрогену молекули спирту завдяки наявності в нього частково позитивного заряду притягується до атому Оксигену сусідньої молекули води. Ця сила, притягання, що виникла між молекулами й спричинила утворення водневого зв’язку. Умовно його зображають трьома крапками. І хоча водневий зв’язок в 10 разів слабше за ковалентний, на їхнє руйнування треба витратити значну кількість енергії, аби спирт перейшов з рідкого стану в газуватий.
6. Фізичні властивості (робота з текстом підручника)
|
Метанол |
Етанол |
Гліцерол |
2.З характерним запахом 3. Леткий, t (кип)65°С 4. Добре розчинний у воді 5. Легший за воду. 6.Дуже токсичний. |
2.З характерним запахом 3. Леткий, t (кип)78°С 4. Добре розчинний у воді 5. Легший за воду. 6.Токсичний |
|
У гомологічному ряду нормальних (нерозгалужених) спиртів зі збільшенням молекулярної маси збільшуються температури плавлення та кипіння., зменшується розчинність.
ІV. Узагальнення та систематизація знань.
1.( Гра з кубиком)
1) Які сполуки називаються спиртами?
2) Що таке функціональна група?
3) Як класифікуються спирти?
4) Назвіть одноатомний спирт.
5) Назвіть багатоатомний спирт.
2.(учні по-черзі зачитують формули і дають відповідь)
Із наведеного переліку виберіть формули насичених одноатомних спиртів:
А) С3Н7ОН; Б) С2Н5СООН; В) СН3ОН; Г) С4Н10О; Д) С5Н11СОН; Е) С2Н5ОН; Є) С5Н10О; Ж) С5Н11ОН.
3. «Третій зайвий»
А) С2Н5ОН, СН3ОН, С2Н6.
Б) С2Н5СООН, С6Н13ОН, С3Н7ОН.
В) СН2 – СН – СН2, С2Н5ОН; СН3ОН.
│ │ │
ОН ОН ОН
V. Підбиття підсумків уроку.
VІ. Домашнє завдання.
Опрацювати параграф 31, 32
(Склад і фізичні властивості)
Творче завдання. Приготувати повідомлення:
- Про застосування спиртів.
- Про вплив спирту на організм людини.


про публікацію авторської розробки
Додати розробку