Конспект уроку на тему "Спирти. Загальні відомості, хімічні властивості одноатомних спиртів."
Дата: 13.02.2019 р.
Навчальний предмет: хімія.
Клас: дев’ятий.
Вчитель: Бождан Ірина Володимирівна
Тема уроку: Спирти. Загальні відомості, хімічні властивості одноатомних спиртів.
Мета уроку: навчальна:
сформулювати уявлення про спирти та їх функціональну групу, дати знання про новий клас оксигеновмісних органічних сполук, ознайомити учнів з класифікацією, назвами та ізомерією спиртів, вивести їх загальну формулу, вивчити хімічні властивості спиртів на прикладі одноатомних спиртів, показати зв’язок хімічних властивостей спиртів з наявністю функціональної гідроксильної групи.
розвиваюча:
розвивати логічне та аналітичне мислення, увагу, самостійність та вміння використовувати вивчений матеріал у повсякденному житті;
виховна:
формувати позитивне та відповідальне ставлення до навчання, сприяти розширенню світогляду учнів.
Обладнання: періодична система хімічних елементів Менделєєва, таблиця активності металів; для досліду: Nа, етиловий спирт, мідна дротина.
Основні терміни і поняття: спирти, функціональна група, загальна формула, ізомери, гомологи, етери, оксигеновмісні органічні речовини, кетони.
Вид заняття: комбінований урок.
Методи та форми проведення уроку: тестова перевірка знань, розповідь учителя, демонстраційний експеримент, бесіда та робота біля дошки, складання схем, розв’язування рівнянь.
Список літератури:
Ярошенко О. Г. Хімія. 9 клас – Київ: Грамота, 2009. – 224 с.
Буринська Н. М., Величко Л. П. Хімія. 9 клас – Київ: Перун, 2009. - 232 с.
П. П. Попель, Л. С. Криля Хімія 11 клас – ВЦ «Академія», 2011. – 352 с.
Структура уроку
|
I. |
Організаційний етап |
2 хв. |
|
II. III. |
Мотивування навчальної діяльності учнів Повідомлення теми уроку |
12 хв. 1 хв. |
|
IV. |
Вивчення нового матеріалу |
20 хв. |
|
V. |
Закріплення знань |
9 хв. |
|
VI. |
Повідомлення домашнього завдання |
1 хв.. |
Хід уроку
I. Організаційний етап:
- привітання з учнями;
- виявлення відсутніх;
- перевірка домашнього завдання.
ІІ. Мотивування навчальної діяльності учнів
Перш, ніж перейти до вивчення нової теми, пригадаємо, що ми вивчали на минулих уроках.
Завдання 1.
Запишіть загальні формули алканів, алкенів, та алкінів. Наведіть по одному прикладу, та назвіть сполуку.
СnН2n+2 – С4Н10 (бутан); СnН2n – С5Н10 (пентен);
СnН2n-2 – С3Н4 (пропін);
Завдання 2.
З яких елементів складаються вуглеводні? Дайте їх визначення.
С – Карбон (Вуглець), Н – Гідроген (Н2 – Водень).
Отож, на попередніх уроках ми вивчали органічні речовини, які містять в своєму складі лише Карбон і Гідроген. Ці речовини – вуглеводні. Сьогодні ми познайомимось з новим класом органічних сполук, до яких входить також Оксиген. Цей клас називають оксигеновмісним.
ІIІ. Повідомлення теми уроку
Запишіть тему сьогоднішнього уроку: «Спирти. Їх хімічні властивості.»
План
- Вивчення нового класу сполук: «Спирти».
- Класифікація спиртів.
- Назви спиртів.
- Ізомерія спиртів.
- Фізичні властивості .
- Хімічні властивості одноатомних спиртів.
- Підсумок уроку.
ІV. Вивчення нового матеріалу
- Вивчення нового класу сполук: «Спирти».
Отже, як вже було сказано, оксигеновмісні органічні сполуки поділяються на класи. Це залежить від наявності в молекулах функціональних груп.
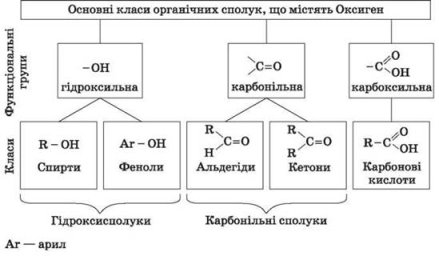
На сьогоднішньому уроці ми розглянемо найпростіший клас оксигеновмісних органічних сполук – спирти. Спирти – це похідні вуглеводнів, в молекулах яких один, або декілька атомів Гідрогену заміщені гідроксильними групами. Група –ОН є функціональною групою спиртів.
Приклад:
![]() СН4 СН3-ОН
СН4 СН3-ОН
![]() С2Н6 С2Н5-ОН
С2Н6 С2Н5-ОН
Отже молекула спирту складається з вуглеводневого залишку та гідроксильної групи. І якщо замінити атом Гідрогену в загальній формулі алканів на ОН-групу, то отримаємо загальну формулу насичених одноатомних спиртів - СnН2n+1ОН (n=1, 2, …).
- Класифікація спиртів.
Спирти можна класифікувати за кількома ознаками:
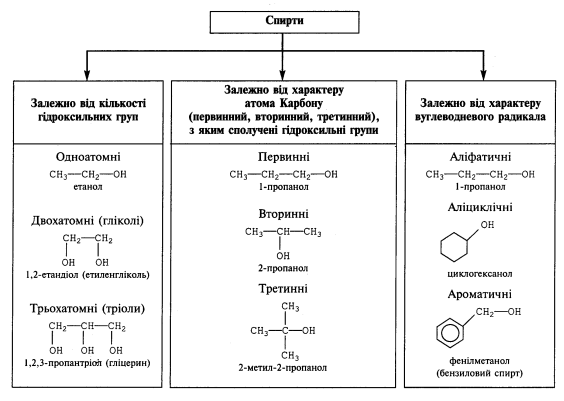
- Назви спиртів.
Назва одноатомного спирту складається з назви представника алканів + суфікс –ол. Їх ми назвемо без проблем. Проте є спирти, у яких ОН-група не завжди стоїть в кінці ланцюга, чи ланцюг може розгалужуватись. Для того, щоб правильно назвати молекулу спирту, спочатку його нумерують, при чому так, щоб ОН-група була ближче до початку ланцюга, у випадку розгалуження – вибирають найдовший вуглеводневий ланцюг, сполучений з гідроксильною групою і також нумерують.
Для прикладу розглянемо кілька сполук.
3 2 1
СН3 ─ СН2 ─ СН2 ─ ОН пропанол -1
4 3 2 1
![]()
![]() СН3 ─ СН -- СН─ СН2 ─ ОН 2,3-диметилбутанол -1
СН3 ─ СН -- СН─ СН2 ─ ОН 2,3-диметилбутанол -1
СН3 СН3
Для кращого засвоєння матеріалу зобразіть на дошці наступне:
2-метил, 3-етил пентанол-1, 2-метил бутанол-2.
Назвіть дані формули:
СН3
![]() 1 2 3 4
1 2 3 4
![]()
![]() ОН─СН3 ─ С ─ СН─ СН2 (2,2,3-триметилбутанол -1)
ОН─СН3 ─ С ─ СН─ СН2 (2,2,3-триметилбутанол -1)
СН3 СН3
![]() СН3
СН3
6 5 4 3 2 1
![]()
![]() СН3 ─СН3 ─СН ─ СН ─ СН─ СН2 (3,4 диметил гексанол-3)
СН3 ─СН3 ─СН ─ СН ─ СН─ СН2 (3,4 диметил гексанол-3)
СН3 ОН
Ті самі спирти можна називати і по іншому. Наприклад метанол – метиловий спирт, етанол – етиловий спирт. 2-атомні спирти мають закінчення –діол, 3-атомні –триол.
- Ізомерія спиртів.
Для спиртів характерна структурна ізомерія. Вона зумовлена різним положенням ОН-груп і будовою карбонового ланцюга.
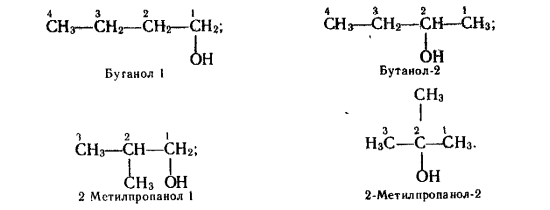
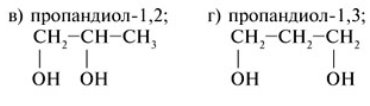
Для спиртів властива також міжкласова ізомерія. Для прикладу: ізомером етанолу є діетиловий етер.
![]() СН3-СН2-ОН СН3-О-СН3
СН3-СН2-ОН СН3-О-СН3
Їх загальна формула R-O-R.
Фізичні властивості метанолу та етанолу.
Метанол – летка безбарвна рідина зі специфічним запахом. Температура кипіння 64,5 оС. Дуже отруйний, потрапляння 10 мл в організм людини спричиняє повну сліпоту, а 40-50 мл – смерть. Метанол – це сильна отрута, яка окислюється в організмі до формальдегіду. Формальдегід в свою чергу має перший клас небезпеки для людини і класифікується, як надзвичайно небезпечна речовина.
Ви мабуть чули в новинах про отруєння метанолом. За недавніми даними в Харківській, Донецькій, Луганській, Миколаївській і Житомирській областях від вживання сурогатного алкоголю зафіксовані майже сто випадків отруєнь фальсифікованим небезпечним алкоголем, із них майже половина випадків завершилися летально.
Етанол – летка безбарвна рідина зі специфічним запахом. Температура кипіння 78,4 оС. Помірно отруйний, летальна доза може коливатись від 500 до 700 мл.
Добування спиртів.
- В промисловості метанол добувають із синтез-газу (суміш монооксиду вуглецю і водню).
CO + H2 (t, P, CuO) → CH3OH
- Етанол, як правило, добувають спиртовим бродінням глюкози, проте також можливі і інші методи.
C6H12O6 → 2C2H5OH + 2CO2 + 2H2O
C2H4 + H2O (t, H+) → C2H5OH
Хімічні властивості.
Спирти – нейтральні речовини. Вони не дисоціюють на йони і тому не змінюють забарвлення індикаторів.
- Горіння спиртів. При підпалюванні спирт горить світлим полум’ям з виділенням великої кількості теплоти. Зазвичай при горіння спиртів утворюються вуглекислий газ та вода:
2 CH3OH + 3O2 → 2CO2 + 4H2O
C2H5OH +3O2 → 2CO2 + 3H2O
Дослід 1.
Етанол – легкозаймиста речовина. Переконаємось у цьому дослідницьким шляхом. Беремо ватну кульку діаметром приблизно 3 см., змочимо її водою так, щоб уся кулька була зволожена, але вода з неї не капала, помістимо у фарфорову чашку. Після цього змочимо вату 0.5 мл. етанолу та піднесемо запалений сірник. Спирт відразу ж загоряється й горить яскравим блакитним полум’ям.
- Спирти проявляють слабкі кислотні властивості – реагують з активними металами. При дії на спирт лужних металів відбувається заміщення атома Гідрогену з ОН-групи на атом Ме. Речовини, що утворилися називаються алкоголятами (від давньої назви спиртів –«алкоголі»).
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Алкоголяти спиртів прийнято називати таким чином: до назви відповідного вуглеводневого радикалу додається закінчення «-ат». Таким чином отримана сполука має назву натрій етилат.
Як бачимо, атоми Н, зв’язані з атомом О є більш активними, порівняно з атомами Н, що зв’язані з атомами С.
Дослід 2.
Наливаємо у пробірку приблизно 2 мл. етанолу, додаємо невеликий шматочок натрію. Спостерігаємо бурхливу взаємодію спирту з натрієм, яка супроводжується виділенням безбарвної газуватої речовини (водню).
- Спирти також проявляють слабкі основні властивості – взаємодіють з галогеноводнями.
В присутності водовіднімаючого засобу, такого як концентрована сульфатна кислота, спирти взаємодіють з галогеноводнями з утворенням галогенопохідних алканів.
C2H5OH + HCl → C2H5Cl + H2O
Як бачимо, на відміну від попередньої реакції, де Ме заміщує лише атом Н, у цьому випадку галоген заміщує ОН-групу.
- Окиснення спиртів.
Первинні, вторинні та третинні спирти окиснюються по-різному. Первинні та вторинні спирти легко окиснюються з утворенням карбонільних сполук – відповідно альдегідів чи кетонів. Як окисники використовують калій перманганат або хромову суміш, які оксинюють спирти вже за кімнатної температури.
Первинні спирти окислюються до альдегідів, а потім до кислот.
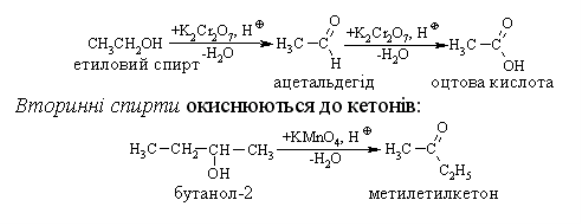
Якщо в спирт занурити розжарену мідну спіраль, покриту чорним нальотом купрум (ΙΙ) оксиду, то спіраль стане блискучою, з’явиться специфічний запах альдегіду - запах зеленого яблука. Цю реакцію використовують для якісного визначення спиртів.
CH3 – CH2 – OH + CuO → CH3 – CОН + H2O + Cu
Дослід 3.
У пробірку додаємо 2 краплі етанолу, 2 краплі 5 %-ого розчину калію перманганату і 3 краплі 10 %-ого розчину сульфатної кислоти. Спостерігають знебарвлення рожево-фіолетового кольору розчину.
- Дегідратація спиртів.
В присутності концентрованої сульфатної кислоти і високої температури від молекул спирту відщеплюється вода. Проте процес дегідратації може відбуватися двома шляхами, залежно від умов.
а) якщо дегідратація відбувається при нагріванні спирту (до 140°С) з достатньою кількістю концентрованої сульфатної кислоти, то відбувається утворення ненасиченого вуглеводню:
![]() C2H5OH (етанол) CH2 = CH2 (етилен) + H2O;
C2H5OH (етанол) CH2 = CH2 (етилен) + H2O;
б) якщо дегідратація відбувається за вищої температури при надлишку спирту, молекула води відщеплюється від двох молекул спирту, внаслідок чого утворюється етер:
![]() 2C2H5OH (етанол) C2H5 – O – C2H5 (діетиловий етер) + H2O
2C2H5OH (етанол) C2H5 – O – C2H5 (діетиловий етер) + H2O
Етер – органічна оксигеновмісна сполука, яка складається з двох вуглеводневих радикалів з’єднаних між собою атомом оксигену. Загальна формула етерів: R – O – R .
Закріплення і узагальнення знань.
Завдання 1. Напишіть структурні формули таких речовин:
гексан-2-ол (CH3-CH(OH)-CH2-CH2-CH2-CH3)
5-метилгептан-3-ол (CH3-CH2-CH(OH)-CH2-CH(CH3)-CH3)
4-хлорпентан-2-ол (CH3-CH(OH)-CH2-CHCl-CH3)
гексилпропіловий етер (CH3-CH2-CH2-CH2-CH2-CH2-O-CH2-CH2-CH3)
Завдання 2. Напишіть рівняння хімічних реакцій, щоб здійснити ланцюжок перетворень:
C2H5Cl
↑
C2H6 → CH2=CH2 → C2H5OH → CH3 – CООН
↓
C2H5OК
C2H6 (t, кат.) → CH2=CH2 + H2↑
CH2=CH2 + H2О → C2H5OH
C2H5OH + HCl → C2H5Cl + H2O
2C2H5OH + 2К → 2C2H5OК + H2
C2H5OH + [O] = CH3 – CООН
Завдання 3. Розв’язати задачу:
У результаті добування натрій етилату виділився газ об’ємом 44,8 л . Який це газ? Скільки г натрій етилату утворилося?
Розв’язання
![]() Дано: 2C2H5OH + 2Na → 2C2H5ONa + H2↑
Дано: 2C2H5OH + 2Na → 2C2H5ONa + H2↑
![]() V (H2) = 44.8 л x (г) - 2∙68 (г/моль)
V (H2) = 44.8 л x (г) - 2∙68 (г/моль)
m (C2H5ONa) - ? 44.8 (л) – 22.4 (л/моль)
x = 272 (г)
Відповідь: 272 г.
V. Домашнє завдання.
1. § 24, впр.6, 7, 11.
Підбиття підсумків уроку
Спирти є нейтральними речовинами й не дисоціюють на йони.
При дії на спирти лужних металів відбувається заміщення атома Гідрогену гідроксильної групи на атом металічного елемента.
При взаємодії спиртів з концентрованими галогеноводневими кислотами утворюються галогенопохідні вуглеводнів.
Якісною реакцією на спирти є їх взаємодія з розжареним CuO – мідь відновлюється.
Спирти піддаються дегідруванню й дегідратації.
Можливо у когось є запитання?
Урок закінчено, до побачення.
-
дякую
-


про публікацію авторської розробки
Додати розробку
