Конспект уроку на тему: "Сучасна модель атома. Протонно-нейтронна модель ядра атома. Ядерні сили. Ізотопи".
Конспект уроку на тему: "Сучасна модель атома. Протонно-нейтронна модель ядра атома. Ядерні сили. Ізотопи". Урок входить до розділу фізики 9 класу "Фізика атома і атомного ядра. Ядерна енергетика". Містить історичні дані, посилання на засоби ІКТ для перевірки знань учнів.
Тема уроку: Сучасна модель атома. Протонно-нейтронна модель ядра атома. Ядерні сили. Ізотопи.
Мета: сформувати знання про сучасні погляди на модель атома та атомного ядра, ізотопи, сильну взаємодію нуклонів. Розвивати у школярів логічне і критичне мислення, стимулювати активну пізнавальну діяльність. Виховувати творче відношення до праці і навчання та свідому дисципліну.
Наочність і обладнання: навчальна презентація, комп’ютер, підручник, періодична система хімічних елементів Д. І. Менделєєва.
Тип уроку: урок засвоєння нових знань.
І. Організаційна частина
ІІ. Актуалізація опорних знань:
Пройти тестування за посиланням: https://learningapps.org/1475381:
ІІІ. Вивчення нового матеріалу.
Усі тіла навколишньої живої й неживої природи складаються з дрібних частинок – атомів. Першими, хто висловив припущення про це, вважаються давньогрецькі філософи Левкіпп і Демокріт.

Левкіпп (приблизно 500 – 440 pp. до н.е.) Демокріт (приблизно 460 – 370 роки до н.е.)
Саме вони назвали атомом дрібну неподільну частинку, що утворює речовину. Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв’язків між ними. Ні природу, ні механізм утворення цих зв'язків вони не уточнювали, зате зробили припущення про форму атомів. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»). Більше двадцяти століть знадобилося вченим для того, щоб експериментально підтвердити атомістичну теорію будови речовини. Остаточно ця ідея утвердилася в науці в другій половині дев’ятнадцятого століття. До початку двадцятого століття фізики вже мали досить інформації про масу й розміри атома. На той час стало зрозумілим, що атоми не є дрібними частинками в складі речовини. Вони мають певну внутрішню структуру, розгадка якої дозволила б пояснити періодичність властивостей хімічних елементів.
Англійський фізик Джозеф Джон Томсон запропонував модель атома у вигляді позитивно зарядженої по всьому об'єму сфери діаметром 10-10 м, усередину якої, ніби родзинки в пудинг, вкраплені електрони. Позитивний заряд сфери компенсується сумарним негативним зарядом електронів. Джозеф Джон Томсон Модель атома Томсона (1856-1940 рр.).

У 1908–1911 рр. під керівництвом Ернеста Резерфорда досвідчений дослідник Ганс Ґейґер (1882–1945) і молодий аспірант Ернест Марсден (1889– 1970) проводили серію дослідів щодо з’ясування структури атома (посилання на відео дослід https://www.youtube.com/watch?v=793ypvIljas).
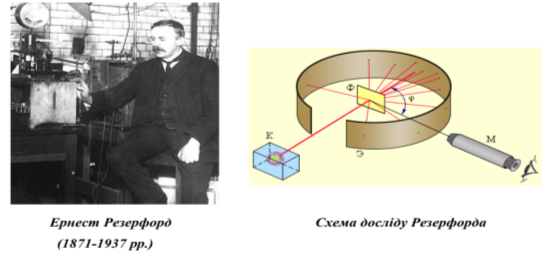
Для дослідів учені використали речовину, із якої з великою швидкістю вилітали позитивно заряджені частинки — так звані α-частинки (альфа-частинки).
Вузький пучок α-частинок зі свинцевого контейнера спрямовувався на тонку золоту фольгу, а далі потрапляв в екран, покритий шаром кристалів цинку сульфіду. Якщо в такий екран улучала α-частинка, то в місці її влучання відбувався слабкий спалах світла. Учені спостерігали спалахи за допомогою мікроскопа та реєстрували влучання α-частинок в екран.
Переважна більшість α-частинок проходила крізь золоту фольгу, не змінюючи напрямку руху, деякі відхилялися від початкової траєкторії. А от приблизно одна з 20 000 частинок відскакувала від фольги.
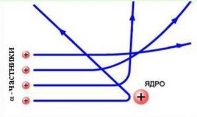
Резерфорд запропонував планетарну модель атома:
- Атом складається з позитивно зарядженого ядра, до складу якого входять позитивно заряджені протони і нейтральні нейтрони, і електронів, які обертаються навколо цього ядра;
- Відстань між ядром і електронами в сотні тисяч разів перевищує розміри самого ядра, тому атом всередині порожній;
- Майже вся маса атома зосереджена в ядрі.
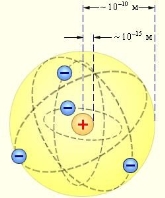
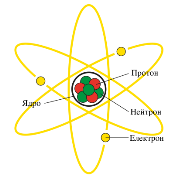
Планетарна модель атома.
- Весь атом складається з позитивно зарядженого ядра, в якому сконцентрована майже вся маса атома. Розміри ядра порядку 10-14 -10-15 м (атом - 10-10 м).
- Навколо масивного ядра по замкнених орбітах рухаються легкі електрони, загальний негативний заряд яких дорівнює позитивному заряду ядра атома.
Будова ядра атома.
- атом складається з позитивно зарядженого ядра, оточеного негативно зарядженими частинками – електронами;
- 99,9% маси і весь позитивний заряд атома зосереджені в ядрі атома;
- розмір ядра порівняно з атомом надзвичайно малий (діаметр атома становить приблизно 10– 10 м, а ядра – 10–15 м).
Будова атомного ядра
Атомне ядро складається із частинок двох видів:
- протони (мають позитивний електричний заряд);
- нейтрони (не мають заряду).
Нуклони – це протони й нейтрони, що входять до складу ядра атома.
Нуклонне (масове) число (А) – це сумарна кількість протонів і нейтронів в атомі.
Зарядове (протонне) число (Z) – це кількість протонів у ядрі.
Кількість нейтронів (N) у цьому ядрі: N = A – Z.
Нуклід – це вид атомів, який характеризується певним значенням зарядового числа та певним значенням масового числа.
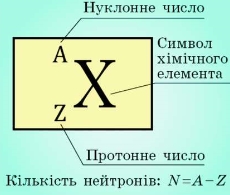
Наприклад:
Скільки протонів і нейтронів містить ядро нукліда Титану ![]() ?
?
![]()
Ізотопи – це різновиди атомів того самого хімічного елемента, ядра яких містять однакове число протонів, але різну кількість нейтронів.
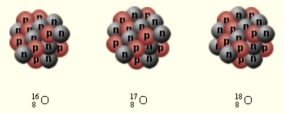
Сильна взаємодія
Кулонівські (електростатичні) сили відштовхування намагаються «зруйнувати» ядро.
Ядерні сили – це сили, які діють між протонами й нейтронами в ядрі та забезпечують існування атомних ядер.
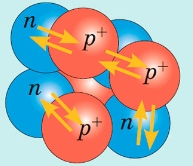
Сили, які утримують частинки в ядрі, називають ядерними силами.
Основні властивості ядерних сил
- є тільки силами притягання;
- є близькодіючими: вимірювання показали, що ядерні сили між нуклонами виявляються лише на відстанях, які приблизно дорівнюють розмірам нуклона;
- не залежать від заряду: на однаковій відстані сили, що діють між двома протонами, між двома нейтронами або між протоном і нейтроном, є однаковими;
- мають властивість насичення: нуклон виявляється здатним до ядерної взаємодії одночасно лише з невеликою кількістю нуклонів - «сусідів».
ІV. Закріплення знань. Розв’язування задач
1. Скільки протонів і скільки нейтронів міститься в ядрах атомів Меркурію ![]() , Купруму
, Купруму ![]() , Германію
, Германію ![]() ?
?
2. Як визначити кількість електронів в атомі?
3. У ядрі атома Брому 35 протонів і 45 нейтронів. Скільки електронів у цьому атомі?
4. У ядрі атома Карбону міститься 12 частинок. Навколо ядра рухаються 6 електронів. Скільки в ядрі цього атома протонів і нейтронів?
5. У ядрі атома певного хімічного елемента 31 протон і 39 нейтронів. Що це за елемент?
6. Чим відрізняються ядра ізотопів Феруму: ![]() ?
?
V. Підбиття підсумків уроку
Розгадайте кросворд за посиланням:
https://onlinetestpad.com/ua/crossword/17341-budova-atomu

VI. Домашня робота: опрацювати § 22, вправа № 22 (1 – 4).


про публікацію авторської розробки
Додати розробку