Конспект уроку: Самостійна робота: «Кількість речовини. Розрахунки за хімічними формулами.»
|
Тема |
Самостійна робота: «Кількість речовини. Розрахунки за хімічними формулами.» |
|
Мета |
Визначити рівень навчальних досягнень учнів з теми «Кількість речовини. Розрахунки за хімічними формулами.»; узагальнити знання учнів з вивченого матеріалу; розвивати вміння працювати з тестовими завданнями; виховувати самостійність. |
|
Обладнання та матеріали |
Періодична система хімічних елементів Д.І. Менделєєва, картки з тестовими завданнями. |
|
Тип уроку |
Урок – контроль знань. |
|
Форми й методи |
Письмова робота за тестовими завданнями |
Структура уроку
- Організаційний етап
- Мотивація навчальної діяльності.
- Самостійне виконання завдань за картками
- Домашнє завдання
- Підбиття підсумків уроку
ХІД УРОКУ
- ОРГАНІЗАЦІЙНИЙ ЕТАП
ІІ. МОТИВАЦІЯ НАВЧАЛЬНОЇ ДІЯЛЬНОСТІ.
Повідомлення теми, мети, основних завдань уроку.
Пояснюємо, що завдання кожного варіанту відповідають 4 дидактичним рівням складності.
У тестових завданнях на вибір правильної відповіді – завдання оцінюється в 1 бал (1-3 завдання + 4);
На встановлення відповідностей – 2 бали (№5,6);
Завдання, що передбачають проведення обчислень – 3 бали (№7-11).
ІІІ. САМОСТІЙНЕ ВИКОНАННЯ ЗАВДАНЬ:
Письмову роботу учні виконують за завданнями складеними у відповідності до чинної програми для 12-річної школи. Розроблено 3 варіанти завдань;
1 варіант
І рівень
1. . Позначте правильне твердження щодо числа Авогадро:
А) дорівнює числу молекул в одному кілограмі речовини;
Б) саме таке число атомів має вступати в хімічну реакцію;
В) саме таке число частинок міститься у зразку речовини кількістю 1 моль;
Г) саме таке число частинок міститься в одному літрі газуватої речовини.
2. Позначте визначення молярної маси речовини:
А) найменша маса речовини, що визначає її властивості;
Б) маса одного моля речовини;
В) маса однієї молекули речовини;
Г) кількість речовини в грамах, що бере участь в реакції.
3. Запишіть значення сталої Авогадро:_________________________________________.
II рівень
- Запишіть хімічну формулу речовини, структурна формула якої зображена:
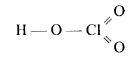 Хімічна формула: _______________________________________________
Хімічна формула: _______________________________________________
5. Обчисліть та позначте значення молярної маси речовини, молекула якої має формулу H2SO3.
Молярна маса:_________________________________________
6. З'єднайте лініями назви газів і їх відносну густину за воднем.
|
Сульфур(ІV) оксид |
|
15 |
|
|
|
|
|
Карбон (ІV) оксид |
|
32 |
|
|
|
|
|
Нітроген (II) оксид |
|
22 |
Ill рівень
7. Обчисліть кількість речовини атомів Оксигену, що міститься в 0,5 моль наведених сполук:
|
Сполука |
Кількість речовини атомів Оксигену |
|
H2O2 |
|
|
Н2SO3 |
|
|
Н3РO4 |
|
8. Визначте, який зразок має більшу масу (і позначте знаком >, <, =):
|
0,25 моль Fe2O3 |
(<, >, =) |
0,7 моль LiNO3 |
9. Обчисліть, маса якого газу більша (за н. у.):
|
33,6 л SO2 |
(<, >, =) |
15,68 л І2 |
IV рівень
10. Визначте, про яку просту речовину йде мова, якщо її зразок кількістю речовини 7 моль має масу 444,5 г.
11. Газ, утворений одним елементом, важчий за кисень в 1,25 раза. Визначте, про який газ йде мова.
Варіант 2
І рівень
1. Позначте правильне твердження щодо молярного об'єму речовини:
А) числове значення дорівнює відносній молекулярній масі;
Б) використовується для обчислення маси речовини, виходячи з кількості речовини;
В) обчислюється як сума відносних атомних мас елементів, що входять до складу речовини з урахуванням стехіометричних співвідношень;
Г) за нормальних умов дорівнює 22,4 л/моль.
2. Позначте правильне твердження. Кількість речовини — це величина, що визначається:
А) числом структурних частинок в певній порції речовини;
Б) масою однієї молекули речовини;
В) найменшою масою речовини, здатною існувати самостійно;
Г) загальним числом атомів в молекулі речовини.
3. Запишіть значення об'єму 1 моль будь-якого газу за нормальних умов: .
II рівень
4. Запишіть хімічну формулу речовини, структурна формула якої зображена:

Хімічна формула: ________________________________________
5. Обчисліть та позначте значення молярної маси речовини, молекула якої має формулу H3РO4.
Молярна маса: _________________________________
6. З'єднайте лініями формули речовин і їх молекулярну масу.
|
P2S5 |
|
146 |
|
|
|
|
|
B2O3 |
|
70 |
|
|
|
|
|
SF6 |
|
222 |
III рівень
7. Обчисліть кількість речовини атомів Оксигену, що міститься в 0,25 моль наведених сполук:
|
Сполука |
Кількість речовини атомів Оксигену |
|
Na2O |
|
|
HNO3 |
|
|
Ca(NO3)2 |
|
8. Визначте, який зразок має більшу масу (і позначте знаком >, <, =):
|
0,5 моль Н2O2 |
(<, >, =) |
0,35 моль SO3 |
9. Обчисліть, маса якого газу більша (за н. у.):
|
11,2 л NO2 |
(<, >, =) |
16,8 л SO2 |
IV рівень
10. Визначте, про яку просту речовину йде мова, якщо її зразок кількістю речовини 6,5 моль має масу 364 г.
11. Газ, утворений одним елементом, важчий за гелій у 8 разів. Визначте, про який газ йде мова.
Варіант З
I рівень
1. Позначте правильне твердження щодо відносної густини газу:
А) показує масу одиниці об'єму речовини;
Б) визначає, у скільки разів даний газ важчий за інший;
В) дорівнює відношенню об'єму даного газу до маси іншого;
Г) дорівнює відношенню маси даного газу до густини іншого.
2. Позначте визначення молярного об'єму речовини:
А) найменший об'єм речовини, що може існувати за нормальних умов;
Б) об'єм однієї молекули речовини;
В) об'єм, в якому міститься 6,02∙1023 молекул речовини;
Г) кількість речовини в літрах, що бере участь в реакції.
3. Запишіть значення температури (за шкалою Цельсія), що відповідає нормальним умовам: ____.
II рівень
4. Запишіть хімічну формулу речовини, структурна формула якої зображена:
O = Fe – O – Fe = O
Хімічна формула: .____________________________________
5. Обчисліть та позначте значення молярної маси речовини, молекула якої має формулу H2CO3.
Молярна маса:_________________________________________
6. З'єднайте лініями формули речовин і масу їх зразків кількістю 1 моль:
|
SO2 |
|
64 |
|
|
|
|
|
CO |
|
46 |
|
|
|
|
|
NO2 |
|
28 |
III рівень
7. Обчисліть кількість речовини атомів Оксигену, що міститься в 1,5 моль наведених сполук:
|
Сполука |
Кількість речовини атомів Оксигену |
|
СrO2 |
|
|
Fe3O4 |
|
|
Са3(РO4)2 |
|
8. Визначте, який зразок має більшу масу (і позначте знаком >,<,=):
|
0,75 моль Сu2O |
(<, >, =) |
0,4 моль КМnO4 |
9. Обчисліть маса якого газу більша (за н. у.):
|
5,6 л Вr2 |
(<, >, =) |
13,44 л NO |
IV рівень
10. Визначте, про яку просту речовину йде мова, якщо її зразок кількістю речовини 0,2 моль має масу 50,8 г.
11. Газ, утворений одним елементом, важчий за повітря в 2,45 раза. Визначте, про який газ йде мова.
IV. ДОМАШНЄ ЗАВДАННЯ
Повторити параграфи 19-22.
V. ПІДБИТТЯ ПІДСУМКІВ УРОКУ


про публікацію авторської розробки
Додати розробку
