Уроки. "Періодичний закон і періодична система хімічних елементів. Будова атома"
РОЗРОБКИ УРОКІВ З ХІМІЇ
Періодичний закон
і періодична система хімічних елементів. Будова атома
8 клас

Розробки уроків з хімії. Періодичний закон і періодична система хімічних елементів. Будова атома. 8 клас.- Червоноград:ІМЦО, 2019.- 36 с.
Укладач: Калитовська Н. Р. вчитель хімії Червоноградського навчально - виховного комплексу №13
Подані матеріали рекомендуємо використати вчителям хімії
Затверджено на засіданні методичної ради ІМЦО (протокол №1 від 30.10.2019)
ПЕРЕДМОВА
Сьогодні існує багато форм і методів навчання хімії, що орієнтовані на краще засвоєння учнями матеріалу, підвищення якості їх умінь і навичок. Для цього необхідно урок будувати так, щоб він був не лише цікавим, але і не перевантаженим для учня. Ефективність його зростає, коли поряд із класичними методами широко використовуються активні інноваційні форми навчання.
Урок є основною формою організації навчання школярів, підготовка до якого – процес трудомісткий, особливо для молодого учителя. Педагог повинен ретельно працювати над кожним етапом уроку відповідно до можливостей учнів і поставленої мети. Успішне засвоєння знань відбувається лише тоді, коли вчитель правильно і логічно спланує кожен урок навчальної теми. А допоможе йому цей збірник, у якому вміщено конспекти уроків хімії з теми ««Періодичний закон і періодична система хімічних елементів. Будова атома» (8 клас)
Усі уроки детальні, структуровані, у кожному з них визначені тип уроку та засоби навчання. Для здійснення контролю навчальних досягнень дібрано завдання різної складності. Завдання вчителя, що викладає хімію, - зацікавити дитину цим предметом. Сподіваюся, що пропоновані уроки допоможуть учителю досягнути мети.
ЗМІСТ
стор.
УРОК 1: Історичні відомості про спроби класифікації хімічних
елементів. Поняття про лужні, інертні елементи, галогени 5 УРОК 2: Хімічні властивості лужних металів та галогенів 7 УРОК 3.Самостійна робота. Поняття про лужні елементи і галогени.
Хімічні властивості лужних металів і галогенів 10
УРОК 4: Будова атома: ядро і електронна оболонка. Склад атомних
ядер. Протонне число. Нуклонне число 12
Урок 5: Будова електронних оболонок атомів хімічних елементів
№ 1-20. Стан електронів у атомі 14
Урок 6: Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах елементів № 1-20. Електронні та графічні електронні формули атомів хімічних елементів №1-20.
Поняття про радіус атома 18
УРОК 7: Періодичний закон Д.І. Менделєєва (сучасне формулювання).
Періодична система хімічних елементів, її структура 21
УРОК 8: Періодичний закон та періодична система хімічних елементів
Д. І. Менделєєва 23
Урок 9. Характеристика хімічних елементів №1-20 за їх місцем у періодичній системі та будовою атома. Значення періодичного закону 25
Урок 10: Характеристика хімічних елементів за положенням
у періодичній системі та будовою атома 27 УРОК 11. Тематичне оцінювання 28
Для нотаток 34
УРОК 1: Історичні відомості про спроби класифікації хімічних елементів.
Поняття про лужні, інертні елементи, галогени
МЕТА: повторити класифікацію елементів і поглибити ці знання вивченням природних груп елементів, підготувати учнів до вивчення періодичного закону.
ТИП УРОКУ: урок засвоєння нових знань.
ФОРМИ РОБОТИ: розповідь вчителя, демонстрація комп’ютерних слайдів та зразків простих речовин, самостійна робота.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів, комп’ютерні слайди.
ХІД УРОКУ
1. Організація класу.
2. Мотивація навчальної діяльності.
Повідомляю учням тему і мету, розповідаю про основні завдання розділу в цілому, кількість
уроків в даному розділі, приблизний час проведення контрольної роботи.
Пояснюю, чому важливо знати і розуміти взаємозв’язок між будовою і властивостями речовин, і що саме для цього потрібні знання періодичного закону.
3. Вивчення нового матеріалу.
Коротко повторюємо найпростішу класифікацію хімічних елементів:
- Як класифікують хімічні елементи?
- Наведіть приклади: металів; неметалів; амфотерних елементів. Для цього використовую комп’ютерний слайд «Класифікація хімічних елементів» ( демонстрація слайду 2):
Пригадайте, за якими зовнішніми ознаками розрізняють прості речовини, утворені елементами металами і неметалами. Демонструю слайд «Фізичні властивості простих речовин» ( демонстрація слайду 3):
Після цього пропоную учням розглянути зразки простих речовин (вчитель використовує речовини, які є в лабораторії).
На сьогодні нагромадилось дуже багато знань про хімічні елементи, тому розглянута нами класифікація не є достатньо досконалою. Виникло питання нової систематизації елементів за спільністю у будові та властивостях. Проаналізуємо слайд 4. «Класифікація металів»:
Наше завдання вивчити лужні метали. Демонструю слайд 5. «Порівняльна характеристика лужних металів»:
Висновки: лужні метали – група хімічно активних металів, у сполуках одновалентні, загальна формула оксидів Е2О, гідроксидів ЕОН (луги), відрізняються хімічною активністю, яка посилюється із зростанням атомної маси елементів ( зверху вниз).
Переходимо до галогенів. Пояснюю двохатомний склад їх молекул та агрегатний стан за н. у.: F2, Cl2 – гази, Вr2 – рідина, І2 – тверда речовина. Демонструю слайд 6. «Порівняльна характеристика галогенів»:
Висновки: Галогени – група найактивніших неметалів, що утворюють прості речовини молекулярної будови, у вищих оксидах семивалентні, загальна формула Е2О7, загальна формула водневих сполук НЕ, у сполуках з Гідрогеном і металами одновалентні; відрізняються хімічною активністю, яка послаблюється із зростанням атомної маси.
Виконуємо самостійну роботу, вкінці деякі учні зачитують відповіді.
Самостійна робота.
№1. Написати рівняння взаємодії Li, Na, K з киснем, пам’ятаючи, що два останні утворюють пероксиди складу Е2О2.
№2. Написати рівняння взаємодії F2, Cl2, Br2: а) з воднем; б) з кальцієм. Назвати утворені сполуки.
Вивчаємо групу інертних елементів. Інертні елементи (благородні гази) були відкриті англійським хіміком Рамзаєм в кінці ХІХ ст. Це елементи неметали головної підгрупи VIII групи, які не утворюють сполук з Гідрогеном та металами, не сполучаються між собою, їх молекули одноатомні, хімічно малоактивні.
Додаток: на сьогодні відомі сполуки з інертними газами ХеF4 ксенон тетрафлуорид, а також сполуки Kr, Xe, Rn з F2 і O2.
4. Узагальнення і систематизація знань.
Написати рівняння реакцій, що лежать в основі схеми: (біля дошки) Li → Li2O → LiOH
5. Підведення підсумків.
- Які природні групи елементів вивчені нами сьогодні?
- Що призвело до класифікації елементів на природні групи? Набуті сьогодні знання стануть ключем до розуміння і вивчення періодичного закону Д. І. Менделєєва.
6. Домашнє завдання.
П. 4, ст. 23, № 5, 7, 8, 9,10.
Скласти табличку «Порівняльна характеристика лужноземельних металів».
УРОК 2: Хімічні властивості лужних металів та галогенів
МЕТА: вивчити хімічні властивості простих і складних речовин, утворених елементами металами і неметалами, на їх прикладах показати подібність, що стала причиною класифікації елементів.
ТИП УРОКУ: узагальнення і систематизація знань.
ФОРМИ РОБОТИ: розповідь вчителя, виконання вправ.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів.
ХІД УРОКУ
1.Організація класу.
2. Мотивація навчальної діяльності.
Повідомляю тему і мету уроку, звертаю увагу на те, що, хоча елементи і класифіковані у взаємно протилежні групи, між ними існує певний зв’язок, сьогодні ми прослідкуємо за цим зв’язком, вивчаючи хімічні властивості простих і складних речовин.
3. Актуалізація опорних знань.
Завдання:
- Дайте характеристику лужним металам. (усна відповідь учня)
- Дайте характеристику галогенам. (усна відповідь учня)
4.Завдання на розвиток логічного мислення:
1) «Цікаві квадрати»
Знайдіть і випишіть за порядком зростання відносної атомної маси усі лужні метали( перший квадрат; галогени ( другий квадрат):
|
H |
S |
Аl |
P |
Cs
|
|
Fr |
Cu |
K |
Si |
Fe
|
|
Mn |
Rb |
Zn |
Nа |
Co
|
|
Os |
Cl |
Mg |
Br |
Аg
|
|
Hg |
Li |
B |
Pt |
He
|
|
N |
S |
Аu |
P |
F
|
|
Аs |
Cl |
Nа |
O |
Cu
|
|
He |
Pt |
Аg |
Аl |
Br
|
|
Аt |
Zn |
I |
Fe |
C
|
|
Si |
Co |
Mg |
U |
Ne
|
2) «Морський бій»
|
|
1 |
2 |
3 |
4
|
|
А |
Br
|
Cl |
Nа |
F
|
|
Б |
Li |
Be |
Cs
|
Rb |
|
В |
Sr |
K |
I |
Bа
|
|
Г |
Cа |
He |
Mg |
Ne
|
1 учень називає квадрат;
2 учень дає характеристику елемента, що в цьому квадраті.
Наприклад, 1 учень - 2В; 2 учень дає характеристику Калію.
4. Перевірка домашнього завдання.
Перевіряємо виконані домашні вправи, вносимо поправки, зауваження до неточностей чи неправильних відповідей (якщо є потреба).
5. Узагальнення і систематизація знань.
5.1. Аналізуємо хімічні властивості лужних металів. 1) Взаємодія з киснем:
4Li + O2 = 2Li2O
2Na + O2 = 2Na2O2 K + O2 = KO2
( активніші метали окислюються швидше, Nа і K утворюють пероксиди і надоксиди ) 2) Взаємодія з воднем:
2К + Н2 = 2КН 3) Взаємодія з іншими неметалами:
6Na + N2 = 2K3N
3K + P = Na3P
2Na + Cl2 = 2NaCl 4) Взаємодія з водою:
2К + 2Н2О = 2КОН + Н2
5.2. Аналізуємо хімічні властивості галогенів на прикладі хлору: 1) Хлор, як активний неметал, взаємодіє з металами:
2K + Cl2 = 2KCl
Інші приклади:
Cu(II) + Cl2 = CuCl2
2Fe(III) +3Cl2 = 2FeCl3
2Sb(III) + 3Cl2 = 2SbCl3
2) Взаємодія з деякими неметалами:
H2 + Cl2 = 2HCl
2P + 5Cl2 = 2PCl5 З киснем, азотом і вуглецем безпосередньо не взаємодіє.
(Учні записують рівняння, називаємо утворені речовини)
Висновок: взаємозв’язки між металами і неметалами та їх речовинами простежуються у їх взаємоперетвореннях.
6. Розв’язування вправ. Здійснити перетворення:
K → K2O → KOH ( учні складають рівняння реакцій, аналізують властивості речовин, утворених Калієм).
7.Перенесення знань у нестандартні умови.
Елемент входить до ІV групи періодичної системи. З Гідрогеном утворює летку сполуку складу ЕН4, масова частка Гідрогену в якій становить 12,2%. Який це елемент?
8. Домашнє завдання.
П.4, ст. 23, №13,14. Скласти кросворд.
УРОК 3.Самостійна робота. Поняття про лужні елементи і галогени. Хімічні властивості лужних металів і галогенів
МЕТА УРОКУ: перевірити та оцінити: вміння користуватися періодичною системою, записувати рівняння хімічних реакцій, навички у розв’язуванні задач.
ТИП УРОКУ: перевірки знань, навичок та умінь.
ФОРМИ РОБОТИ: письмова робота за індивідуальними завданнями.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів Д.І. Менделєєва.
ХІД УРОКУ
1.Мотивація навчальної діяльності.
Коротко характеризуємо мету та основні завдання уроку.
2.Письмова робота.
Варіант 1
1. Якому елементу ІV періоду відповідає найактивніший метал?
2. Обчислити відносну молекулярну масу вищого оксиду елемента № 17.
3. В якій групі розміщені галогени?
4. З якими із зазначений нижче речовин може реагувати натрій: Cl2, Al, S ? Записати рівняння. 5. Напишіть рівняння реакцій, що відповідають поданій схемі: Ca → CaO → Ca(OH)2
6. Скласти формули оксидів і гідроксидів перших двох елементів ІІІ періоду.
7. Оксид хімічного елемента І групи головної підгрупи має відносну молекулярну масу 62. Назвати елемент і скласти формулу його гідроксиду. 8. Закінчити рівняння реакцій:
Na + P →
Li + O2 →
K + Cl2 →
Варіант 2
1. Якому елементу ІІІ періоду відповідає найактивніший неметал?
2. Обчислити відносну молекулярну масу сполуки з Гідрогеном елемента № 35.
3. В якій групі розміщені лужні метали?
4. З якими із зазначений нижче речовин може реагувати хлор: K, S, Ca, ? Записати рівняння. 5. Напишіть рівняння реакцій, що відповідають поданій схемі: Na → Na2O → NaOH
6. Скласти формули оксидів і гідроксидів перших двох елементів ІІ періоду.
7. Оксид хімічного елемента І групи головної підгрупи має відносну молекулярну масу 94. Назвати елемент і скласти формулу його гідроксиду. 8. Закінчити рівняння реакцій:
Na + Cl2 →
K + P →
Li + S →
Варіант 3
1. Якому елементу ІІІ періоду відповідає найактивніший метал? 2. Обчислити відносну молекулярну масу гідроксиду елемента № 20.
3. В якій групі розміщені галогени? 4. З якими із зазначений нижче речовин може реагувати хлор: Na, P, Mg ? Записати рівняння. 5. Напишіть рівняння реакцій, що відповідають поданій схемі: Li → Li2O → LiOH
6. Скласти формули оксидів і гідроксидів перших двох елементів ІІІ періоду.
7. Гідроксид хімічного елемента ІІ групи головної підгрупи має відносну молекулярну масу 58. Назвати елемент і скласти формулу його оксиду. 8. Закінчити рівняння реакцій:
Mg + N2 →
K + H2 →
Na + Br2 →
Варіант 4
1. Якому елементу ІV періоду відповідає найактивніший неметал?
2. Обчислити відносну молекулярну масу оксиду елемента № 38.
3. В якій групі розміщені лужні метали?
4. З якими із зазначений нижче речовин може реагувати натрій: O2, Cu, H2? Записати рівняння. 5. Напишіть рівняння реакцій, що відповідають поданій схемі: K → K2O → KOH
6. Скласти формули оксидів і гідроксидів перших двох елементів ІІ періоду.
7.Гідроксид хімічного елемента ІІ групи головної підгрупи має відносну молекулярну масу 74. Назвати елемент і скласти формулу його оксиду. 8. Закінчити рівняння реакцій: Ba + Cl2 →
Li + P →
Ca + H2 →
3.Домашнє завдання. Повторити П.4,ст.24, №14.
УРОК 4: Будова атома: ядро і електронна оболонка. Склад атомних ядер. Протонне число. Нуклонне число
МЕТА: на основі знань про будову атома з фізики розкрити фізичний зміст періодичного закону, характеризувати будь-який атом хімічного елемента періодичної системи.
ТИП УРОКУ: засвоєння навичок та умінь.
МІЖПРЕДМЕТНІ ЗВ’ЯЗКИ: фізика.
ФОРМИ РОБОТИ: фронтальне опитування, розповідь вчителя, розв’язування вправ.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів, плакат з будовою атома Бору.
ХІД УРОКУ
1. Організаційний етап.
2. Перевірка домашнього завдання, актуалізація опорних знань.
2.1. Перевіряю вправи, задані додому. 2.2. Розгадуємо кілька кросвордів, підготовлених учнями.
3. Мотивація навчальної діяльності.
Довго не було відомо, що є причиною змін, які відбуваються в періодах і групах періодичної системи. І це було загадкою до тих пір, поки не була відкрита будова атома, радіоактивність. Один з перших дослідників в цій галузі був Е. Резерфорд, це вам відомо з курсу фізики. Завдання нашого уроку – ознайомитися із взаємозв’язком між будовою атома і властивостями елементів.
4. Пояснення нового матеріалу.
Використовую плакат з атомом Бору.
Атом складається з позитивно зарядженого ядра: Z = +5 і електронної оболонки, що містить таке число електронів, який заряд ядра: е = 5, тому будь-який атом електронейтральний.
З‘ясовуємо те, що порядковий номер елемента відповідає заряду ядра чисельно.
Невеличке завдання:
Визначити заряди ядер та кількість електронів в таких елементів: C, Mg, Al, S.
Таке виявлення фізичного змісту порядкового номера дало нове обґрунтування розміщення елементів у періодичній системі:
Встановили, що елементи розміщенні не тільки в порядку зростання їх атомних мас, але у порядку зростання зарядів ядер їх атомів. Це і є сучасне трактування періодичного закону.
А тепер розглянемо склад атомного ядра. Демонструю слайд 7:
«Будова атомного ядра»
Оскільки, маса електрона дуже мала, то маса атома в основному відповідає масі ядра:
Аr = р + n , Ar – нуклонне число, р – кількість протонів, n – кількість нейтронів.
Тепер поняття «порядковий номер» ми можемо замінити поняттям «протонне число». Ось чому Менделєєв переставив місцями деякі хімічні елементи (елементи перебувають у прямій залежності від зарядів ядер, а не атомних мас).
Запис атомів з позначенням нуклонного числа:
23Na, 27Al, 32S, і т.д.
5. Застосування набутих знань.
Самостійна робота.
Користуючись періодичною системою, обчислити кількість протонів і нейтронів в таких елементів:
І в. №3,№7, №15, №20. ІІ в. №6, №9,№12, №19.
7. Домашнє завдання.
П. 7 ( до пункту «ізотопи»), ст. 40, № 3, 5, 7.
УРОК 5: Будова електронних оболонок атомів хімічних елементів № 1-20. Стан електронів у атомі
МЕТА: ознайомити учнів з рухом електронів у атомі, ввести нові поняття:
«орбіталь», «запас енергії електрона», «орієнтація орбіталей у просторі», «спін», «форми орбіта лей»; навчити учнів складати форми будови електронних оболонок та схеми розподілу електронів за енергетичними рівнями атомів хімічних елементів №1-20.
ТИП УРОКУ: лекція
ФОРМИ РОБОТИ: лекція, комп’ютерні демонстрації
ЗАСОБИ НАОЧНОСТІ: комп’ютерні слайди
ХІД УРОКУ
1. Організаційний етап.
2. Мотивація навчальної діяльності.
Повідомляю тему і мету. Звертаю увагу на те, що під час реакцій ядра атомів не беруть ніякої участі, проте змін зазнають електрони (електронні оболонки атомів), саме від їх будови будуть залежати властивості хімічних елементів їх сполук. Сьогодні перед нами стоять завдання:
- з’ясувати, як побудовані електронні оболонки атомів;
- з’ясувати розміри і форми орбіталей, правила заповнення електронами вільних орбіта лей;
- навчитися складати електронні формули та схеми розподілу електронів за енергетичними комірками.
3. Вивчення нового матеріалу.
Проектую план лекції на екран(слайд 8) :
1. Утворення орбіта лей при русі електронів навколо ядра.
На початку ХХ ст. вважали, що електрони – це частинки, які обертаються на певних орбітах навколо ядра (як планети навколо сонця). Але, пізніше результати досліду засвідчили, що електрон має двоїсту природу – властивості частки і хвилі. Електрони в атомі можна уявити як хмару з певною густиною від’ємного електричного заряду в певному об’ємі простору навколо ядра. Тобто, є певний простір навколо ядра, в якому перебування електрона є найбільш імовірним, такий простір називають ОРБІТАЛЛЮ.
Орбіта лі є різні, кожна орбіталь має свій запас енергії і це залежить від відстані орбіта лі від ядра.
Отже, орбіта лі із однаковим запасом енергії знаходяться на однаковій відстані від ядра.
Крім того, для електронів характерний СПІН – властивість електрона обертатися навколо своєї осі, тобто власний магнітний момент електрона. Спін може мати лише два значення. На одній орбіта лі може знаходитися не більше двох електронів з антипаралельними спінами. – принцип Паулі.
2. Характеристика орбіта лей.
Записую на дошці назви орбіта лей s, p, d та їх форми.
3. Поняття про енергетичні рівні.
Ми вже встановили, що орбіталі із однаковим запасом енергії знаходяться на однаковій відстані від ядра. Такі орбіта лі знаходяться на одному ЕНЕРГЕТИЧНОМУ РІВНІ – сукупність орбіта лей, що характеризуються однаковим значенням енергії. Чим далі від ядра знаходиться орбіталь, тим більшу енергію вона має, а електрони, що знаходяться дальше від ядра, легше відщепити іншими атомами.
Кожен енергетичний рівень складається з підрівнів:
1 – ен. рів. ----- один підрівень s,
2 – ен. рів. ----- два підрівні s і p,
3 – ен. рів. ----- три підрівні s, p і d,
4 - ен. рів. ----- чотири підрівні s, p, d і f.
Кількість електронів на енергетичному рівні можна обчислити за формулою:
N = 2n2 де
N – число електронів, n – номер енергетичного рівня.
Обчисліть самостійно, по скільки електронів містить на перших чотирьох енергетичних рівнях:
1 – ен. рів. ----- N = 2*12 = 2 електрони
2 – ен. рів. ----- N = 2*22 = 8 електронів
3 – ен. рів. ----- N = 2*32 = 18 електронів
4 - ен. рів. ----- N = 2*42 = 32 електрони і т. д.
4. Правила заповнення елеронами енергетичних рівнів.
Електрони заповнюють енергетичні рівні за зростанням їх енергій ( від меншої до більшої).
Зроблено розрахунок всіх підрівнів семи існуючих енергетичних рівнів, було одержано таку послідовність:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
5. Будова електронної оболонки атомів.
Ми вже підрахували, скільки електронів може міститися на кожному енергетичному рівні. Як же відбувається розподіл електронів по енергетичних підрівнях:
1 2 3
______ __________
↓ ↓ ↓ ↓ ↓ ↓
S S P S P D
Якщо на s – підрівні чи іншому не всі місця зайняті електронами, такий рівень називається незавершеним. Електрони заповнюють комірки поступово по одному.
6. Зв’язок електронної будови атома з положенням елемента в періодичній системі.
Номер періоду в періодичній системі відповідає числу енергетичних рівнів в того чи іншого елемента.
У елементів головних підгруп число електронів останнього енергетичного рівня співпадає з номером групи.
6. Узагальнення і систематизація знань.
Складаємо електронні та графічні електронні формули таких атомів:
B, C.
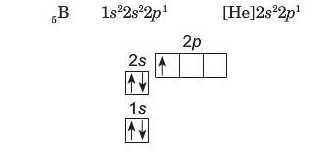
В атомі елемента Бору (порядковий номер 5), міститься п'ять електронів:
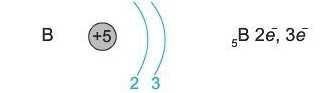
П'ятий електрон займає одну із р-орбіталей:
В атомі Карбону (елемент номер 6) є шість електронів:
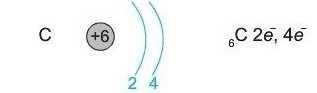
Шостий електрон займає вільну р-орбіталь:
![]()
7. Домашнє завдання.
П.8,9;
Розписати електрони по енергетичних рівнях таких атомів: Li, O, N, F.
УРОК 6: Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах елементів № 1-20. Електронні та графічні електронні формули атомів хімічних елементів №1-20. Поняття про радіус атома
МЕТА: закріпити навички складання електронних формул та схем розподілу електронів, сформувати вміння за місцем в періодичній системі визначати електронну формулу.
ТИП УРОКУ: комбінований.
ФОРМИ РОБОТИ: опитування, самостійна робота.
ХІД УРОКУ
1. Організаційний етап.
2. Корекція знань. (до 25 хв.)
Охарактеризувати подвійну природу електрона.
Що таке орбіталь?
Які вам відомі типи орбіталей?
Яке розміщення орбіталей у просторі?
Яка будова електронної оболонки атомів за запасом енергії електрона?
Пригадайте правила заповнення електронами вільних орбіталей. (правило Паулі)
Визначити число енергетичних рівнів у атомів: Be, Ar, K.
Який елемент має електронну конфігурацію 1s2 2s2 2p6 3s2 3p3 ?
Для яких елементів І – ІІІ періодів число електронів зовнішнього енергетичного рівня становить 3?
Запишемо електронні та графічні електронні формули для атомів деяких елементів ІІІ періоду (можна використовувати плакати):
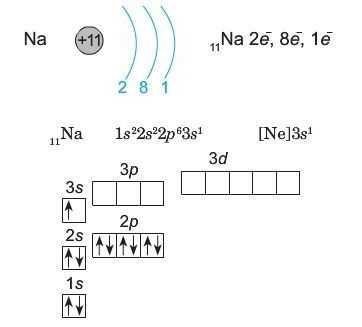
Натрій (порядковий номер 11) — елемент третього періоду, тому в його атомі починає заповнюватися третій енергетичний рівень:
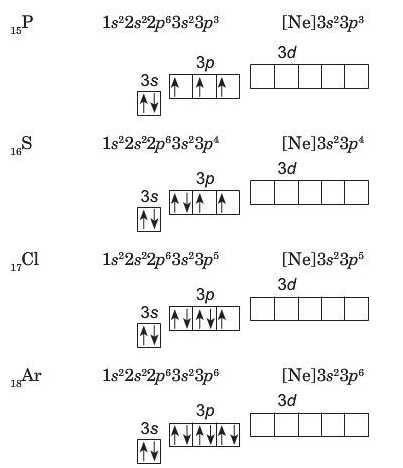
Трохи іншою буде будова атомів IV періоду. Розглнемо будову електронних оболонок Калію і Кальцію.
Калій (порядковий номер 19) і Кальцій (порядковий номер 20) - елементи четвертого періоду. Їх атоми мають по чотири енергетичні рівні. Всупереч очікуванням, в атомах Калію і Кальцію не заповнюються вільні Зd-ор-біталі. Електрони займають 4s-орбіталі, оскільки на 4-s орбіталі їх енергія менша, ніж на 3d-орбіталі:
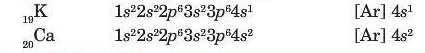
Дуже важливою характеристикою.атома є його радіус. Чим більший атомний радіус, тим слабкіше утримуються зовнішні електрони. І навпаки, із зменшенням атомного радіуса електрони сильніше притягуються до ядра.
Радіус атома – це відстань від центра ядра до сферичної поверхні, якої торкаються орбіталі з електронами останнього енергетичного рівня.
![]() Чим
більший заряд ядра атома елемента, тим радіус атома менший (за умови, що
кількість електронних оболонок однакова).
Чим
більший заряд ядра атома елемента, тим радіус атома менший (за умови, що
кількість електронних оболонок однакова). ![]() Чим більше
електронних оболонок має атом, тим більший його радіус.
Чим більше
електронних оболонок має атом, тим більший його радіус.
3. Контрольне завдання (письмово) (до 20 хв.)
1. Намалюйте форму р-орбіталі.
2. Який елемент має електронну конфігурацію 1s2? Вкажіть період, групу, підгрупу.
3. За схемою розподілу електронів по енергетичних рівнях вказати елемент: 1s2 2s2 2p5.
4. В якому ряду елементів відбувається зростання радіуса атома: а) Be, Mg, Ca; б) Be, B, C; в) Ве, Li, H?
5. Напишіть формули вищих оксидів і гідроксидів елементів з протонними числами 6 і 16.
6. Виразіть будову електронних оболонок атомів елементів з протонними числами 14 і 17. Покажіть розподіл електронів за енергетичними рівнями.
7. Знайти в періодичній системі елемент з протонним числом 7. Написати формулу його простої речовини, вказати вищу валентність за Оксисеном, скласти формулу вищого оксиду.
8. Що подібне і що відмінне у будові електронних оболонок атомів N і P? Відповідь підтвердіть електронними та графічними електронними формулами.
9. Написати електронну конфігурацію атома Аr. Чим пояснити його хімічну інертність?
4. Домашнє завдання. П. 9, ст. 54, № 3, 6.
УРОК 7: Періодичний закон Д.І. Менделєєва (сучасне формулювання). Періодична система хімічних елементів, її структура
МЕТА: підвести учнів до розуміння закону періодичності в природі за зміною властивостей елементів залежно від їх атомних мас, показати значення періодичного закону як основи для створення таблиці, що відображає природну класифікацію елементів, вивчити зміну властивостей елементів у періодах і групах.
ТИП УРОКУ: лекція.
ФОРМИ РОБОТИ: лекція, бесіда, розв’язування вправ.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів.
ХІД УРОКУ
1. Організаційний етап.
2. Перевірка домашнього завдання, корекція знань.
Перевіряю виконане домашнє завдання, виправляємо помилки при необхідності.
3. Завдання уроку.
Повідомляю тему і мету, підкреслюю те, що відкриття закону дало змогу пояснити багато фактів і допомогло широкому розвитку хімії як науки в майбутньому.
4. Лекційний виклад.
А зараз ми попрацюємо над 2-им періодом періодичної системи. 2-період починається лужним металом Li і закінчується інертним газом Ne ( перед ним стоїть галоген F). Бачимо, що: 1) елементи розташовані за зростанням атомних мас на 1; 2) металічні властивості елементів поступово змінюються до неметалічних.
Складемо оксиди цих елементів:
Li2O - BeO - B2O3 - CO2 - N2O5 - …
F оксиду не утворює, утворює флуорид OF2. Ne теж оксиду не утворює, бо він інертний, тобто валентність в даному ряді зростає від І доV. Характер змінюється від основного до кислотного через амфотерний.
Складемо гідроксиди (кислоти) цих елементів:
LiOH - Be(OH)2 - H3BO3 - H2CO3 - HNO3 - …
(F і Ne таких сполук не утворюють)
Валентність зростає від І доV, Властивості змінюються від основних до кислотних через амфотерні.
Зверніть увагу на те, що 3-ій період повторюється, зміни відбуваються в тій самій послідовності: від лужного металу Na до інертного газу Ar і т.д. (слайд 9)
Отже, ПЕРІОД - це горизонтальний рядок хімічних елементів, розміщених у порядку зростання їх атомних мас, що починається лужним металом і закінчується інертним газом. Періоди лежать в основі періодичності системи, ( учні можуть попробувати дати визначення самостійно).
А тепер попрацюємо над групами – вертикальними рядками. Зверніть увагу на те, що лужні метали всі розміщені в одному вертикальному ряді, так само і галогени, і інертні гази (слайди 10, 11) Отже, ГРУПА – вертикальний стовпчик елементів, подібних за хімічними і фізичними властивостями.
Висновок: Властивості хімічних елементів, а також хімічних речовин, які вони утворюють, перебувають у періодичній залежності від значення їх атомних мас. (формулювання періодичного закону).
5. Узагальнення і систематизація знань Завдання: хто швидше?!
№1. Скласти формули вищих оксидів елементів ІІІ періоду. Як змінюється валентність елементів та властивості їх оксидів?
№2. Скласти формули вищих оксидів елементів головної підгрупи ІІ групи. Як змінюється валентність елементів та властивості їх оксидів?
Ще одне завдання (якщо є час):
Скласти формули летких сполук неметалів елементів ІІІ періоду з Гідрогеном. Як змінюється валентність атомів за Гідрогеном та їх властивості?
6. Підведення підсумків.
Відзначаю активних учнів, даю загальну оцінку роботи класу. Коротко характеризуємо вивчене.
7. Домашнє завдання.
П. 5,6, ст. 28, № 3,5; ст. 34, № 3,6.
УРОК 8: Періодичний закон та періодична система хімічних елементів Д. І. Менделєєва
МЕТА: сформувати знання про структуру періодичної системи, вивчити класифікацію періодів і груп.
ТИП УРОКУ: засвоєння нових знань.
ФОРМИ РОБОТИ: розповідь вчителя, бесіда, фронтальне опитування, розв’язування задач.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів, комп’ютерні слайди.
ХІД УРОКУ
1. Організаційний етап.
2. Перевірка домашнього завдання, корекція знань.
Перевіряю виконане домашнє завдання, виправляємо помилки при необхідності.
3. Завдання уроку.
Повідомляю тему і мету уроку, сьогодні нашим завданням буде більш докладніше вивчити періоди і групи.
4. Корекція знань.
Фронтальне опитування.
- Що таке періоди?
- Як змінюються властивості елементів та їх сполук в ряді Nа – Si?
- Що таке групи?
- Як змінюються властивості елементів та їх сполук в ряді F – At?
5. Засвоєння нових знань.
При доброму спостереженні бачимо, що є періоди, які мають більшу кількість елементів, ці елементи розміщені в 2 ряди ( парний і непарний).
Тут спостерігається та сама періодична залежність ( від лужного металу до інертного газу, перехід металічних властивостей в неметалічні), але це відбувається значно повільніше, тому
- у парному ряді – елементи метали;
- у непарному ряді – метали плавно переходять у неметали. Звертаю увагу на тріади елементів та родини лантаноїдів та актиноїдів.
Періоди класифікують на великі і малі. Демонструю слайд 12:
«Класифікація періодів періодичної системи»:
Зазначаю також, що кожна група має головну і побічну підгрупи. До головної підгрупи входять елементи і малих, і великих періодів, побічні ж підгрупи містять елементи тільки малих періодів.
Повторюємо те, що із зростанням атомних мас елементів металічні властивості посилюються ( І група), а неметалічні властивості послаблюються ( VІІ група, галогени). Демонструю слайд 13:
«Класифікація груп періодичної системи»:
В загальному в періодичній системі проводиться діагональна подібність елементів із зміною властивостей у періодах і групах (Be – At).
6. Узагальнення і систематизація знань. Фронтальне опитування.
- Скільки періодів у періодичній системі?
- Як поділяють періоди?
- Як змінюються властивості елементів у: а) малих; б) великих періодах із зростанням їх атомних мас?
- Як поділяють групи?
- Які елементи входять до складу: а) головних; б) побічних підгруп?
- Як змінюються металічні властивості із зростанням атомних мас у: а) ІІ групі; б) VІІ групі?
8. Домашнє завдання. Повт. П. 5,6, ст. 35, № 7.
УРОК 9. Характеристика хімічних елементів №1-20 за їх місцем у
періодичній системі та будовою атома. Значення періодичного закону
МЕТА: закріпити знання учнів про будову атомів елементів І – ІІІ періодів, сформувати вміння та навички характеризувати елементи за місцем у
періодичній системі та будовою атома.
ТИП УРОКУ: засвоєння навичок та вмінь.
ФОРМИ РОБОТИ: розповідь, фронтальне опитування, розв’язування вправ.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів, комп’ютерні слайди.
ХІД УРОКУ
1. Організаційний етап.
2. Перевірка домашнього завдання, актуалізація опорних знань. Перевірємо виконане домашнє завдання.
3. Мотивація навчальної діяльності.
Мета уроку – закріпити знання про періодичний закон і будову атома на основі одержаних знань, навчитися характеризувати елементи за місцем знаходження в періодичній системі та будовою атома, ми можемо відкрити можливість передбачити будову і властивості елементів та їх сполук на основі вивчених закономірностей.
4. Вивчення нового матеріалу.
Періодичний закон Д.І. Менделєєва є одним з
найфундаментальніших і найзагальніших законів природи. Його вплив на розвиток світогляду людства можна порівняти лише із законом збереження маси і енергії або квантовою теорією будови матерії.
1. Періодичний закон і періодична система елементів Д.І. Менделєєва дають змогу встановити зв’язок між усіма хімічними елементами, передбачити існування раніше невідомих елементів і описати їх властивості.
2. Найбільше значення періодичний закон має для хімії, фізики, геохімії, біохімії тощо. Він дає можливість передбачати нові факти і явища, зокрема нові елементи. Ще Менделєєв зазначав можливість існування багатьох невідомих елементів, відкриття яких продемонструвало велике значення періодичного закону для дальших досліджень. Так, сучасний синтез нових надважких елементів проводиться з урахуванням закономірностей періодичного закону Менделєєва.
3. Велику роль відіграв періодичний закон у розвитку теорії будови атома. Вказавши на глибокий внутрішній зв’язок між елементами, він вробив можливим висновок, що всі атоми побудовані принципово однаково. Тому створення моделей атомів Н.Бором стало можливим після відкриття періодичного закону.
4. Періодичний закон є основою для класифікації хімічних елементів, яка дала змогу чітко сформулювати загальнохімічні поняття валентності, типів хімічних сполук. Стало можливим передбачати нові типи сполук, нові властивості для відомих і невідомих елементів, а також їхніх сполук.
5. В наш час періодичний закон Менделєєва лишається тією науковою основою, яка зумовлює дальший розвиток сучасної хімії, теорії будови атома, теорії хімічного зв’язку, ядерної фізики ти багатьох інших наук.
6. Періодичний закон має велике філософське значення.
Кожен елемент можна характеризувати за місцем його знаходження в періодичній системі, в нього є свій «паспорт», своя «адреса».
Розглянемо план характеристики елемента за місцем його знаходження в періодичній системі. Слайди 14 і 15: « Алгоритм характеристики хімічного елемента».
5. Первинне застосування набутих знань.
Пропоную учням по одному охарактеризувати елементи №3 і №4. Інші слухають, при потребі виправляють помилки.
6. Застосування знань у стандартних умовах.
Поділяю учнів на 2 варіанти і пропоную виконати завдання: Користуючись періодичною системою, описати такі елементи за загальним планом:
І в. №7, №11 ІІ в. №6, №12.
Після завершення роботи по одному учню з кожного варіанту зачитують свою характеристику, інші перевіряють, зачитують помилки.
Пізніше разом характеризуємо елемент №13, звертаю увагу на його амфотерність, переходимо до складнішого завдання – елемент №19 (великий період).
7. Творче перенесення знань і навичок у нові (нестандартні) умови. Задача.
Елемент знаходиться у IV групі. Масова частка його у вищому оксиді становить 60%. Назвати елемент. Скласти формулу його оксиду.
8. Домашнє завдання.
П. 11,12;
Охарактеризувати елементи №5, №8, №10.
УРОК 10: Характеристика хімічних елементів за положенням у періодичній системі та будовою атома
МЕТА: закріпити вміння і навички характеризувати елементи за місцем у періодичній системі та будовою атома при самостійному розв’язуванні вправ.
ТИП УРОКУ: засвоєння навичок і вмінь.
ФОРМИ РОБОТИ: самостійна робота, розв’язування вправ.
ЗАСОБИ НАОЧНОСТІ: періодична система.
ХІД УРОКУ
1. Організаційний етап.
2. Перевірка домашнього завдання.
3. Мотивація навчальної діяльності.
Знання основних закономірностей періодів, груп, фізичного змісту періодичної системи, будови атома полегшує вивчення хімії, оскільки, знаючи властивості і будову атома одного хімічного елемента можна передбачити будову і властивості інших елементів.
4. Корекція знань.
Пропоную одному учню пригадати по пам’яті план характеристики елемента за місцем у періодичній системі.
5. Застосування набутих знань.
2 варіанти:
1) Охарактеризувати елемент за місцем знаходження у періодичній системі:
І в. №17 ІІ в. №14
2) І в. Якому гідроксиду відповідає оксид Na2O?
Здійснити перетворення:
Nа → Na2O → NaOН
ІІ в. Якій кислоті відповідає оксид складу Р2О5 ? Здійснити перетворення:
Р → Р2О5 → Н3РО4
6. Творче перенесення знань і навичок у нестандартні умови. Задача1.
Формула леткої сполуки елемента з Гідрогеном ЕН4. Масова частка Гідрогену 25%. Який це елемент? Написати формулу його вищого оксиду та рівняння реакцій, що характеризують його властивості. Задача 2.
Елемент утворює оксид складу ЕО3. Масова частка Гідрогену в його леткій сполуці 5,88%. Який це елемент? Написати формули його оксиду і гідроксиду.
7. Домашнє завдання.
Повторити П. 11, 12, ст. 65, № 3,4. Охарактеризувати елементи №15, №18.
УРОК 11. Тематичне оцінювання
Періодичний закон і періодична система хімічних елементів. Будова атома
МЕТА УРОКУ: перевірити та оцінити: а) знання учнів з даної теми; б) вміння користуватися періодичною системою при характеристиці будови атома; в) записувати рівняння хімічних реакцій; г) навички у розв’язуванні задач.
ТИП УРОКУ: перевірки знань, навичок та умінь.
ФОРМИ РОБОТИ: письмова робота за індивідуальними завданнями.
ЗАСОБИ НАОЧНОСТІ: періодична система хімічних елементів Д.І. Менделєєва.
ХІД УРОКУ
1.Мотивація навчальної діяльності.
Коротко характеризуємо мету та основні завдання уроку.
2.Письмова робота.
Варіант1
І рівень
1. Електрони, орбіталі яких мають форму правильної вісімки, називають ...
2. Скільки всього груп в періодичній системі елементів? 3. Як називають загальне число протонів і нейтронів у ядрі?
ІІ рівень
4. Яка кількість електронів міститься на зовнішньому енергетичному рівні в атомі елемента з протонним числом 16?
5. Вкажіть протонні числа елементів, атоми яких мають однакову кількість енергетичних рівнів:
1) 17 і 18; 2) 18 і 19.
6. Установіть відповідність між електронною формулою та атомом елемента.
1) 1s22s22p3 A) Na
2) 1s22s22p63s2 Б) N
В) Mg
ІІІ рівень 7. Закінчити рівняння реакцій:
Sr + O2 = Li2O + H2O = H2 + Cl2 =
8. Вищий оксид хімічного елемента, що належить до IV групи періодичної системи, має відносну молекулярну масу 44. Визначте елемент, вкажіть формулу його оксиду та його характер.
IV рівень
9. В оксиді хімічного елемента, який утворює з Гідрогеном сполуку RH4, масова частка Оксигену становить 53,3%. Який це елемент? Варіант2
І рівень
1. Максимальне число електронів, які можуть займати р-підрівень, дорівнює …
2. Скільки всього періодів в періодичній системі елементів? 3. Хто відкрив періодичний закон?
ІІ рівень
4. Протонне число елемента ІІІ-го періоду, атом якого має на зовнішньому енергетичному рівні 6 електронів, дорівнює…
5. Які пари хімічних елементів мають найбільш подібні хімічні властивості?
1) K i Rb, 2) Al i Si, 3) S i Cl.
6.Установіть відповідність між елементом та його валентними електронами.
1) P A) …3s23p5
2) Li Б) …2s1
В) …3s23p3
ІІІ рівень
7. Оксид хімічного елемента, що належить до IІ групи періодичної системи, має відносну молекулярну масу 56. Визначте елемент, вкажіть формулу його оксиду та гідроксиду. 8. Закінчити рівняння реакцій:
Li + O2 = BaO + H2O = H2 + F2 =
IV рівень
9. В оксиді одновалентного металу масова частка Оксигену становить 8,6%. Який це метал?
Варіант3
І рівень
1. Що таке нуклонне число?
2. Як поділяють періоди в періодичній системі хімічних елементів? 3. Чому дорівнює заряд ядра атома?
ІІ рівень
4.Установіть відповідність між елементом та його валентними електронами.
1) S A) …3s23p2
2) Na Б) …3s1
В) … 3s23p4
5. Вкажіть протонні числа елементів, атоми яких мають однакову кількість енергетичних рівнів:
1) 29 і 30, 2) 11 і 19.
6. Яка кількість електронів міститься на зовнішньому енергетичному рівні в атомі елемента з протонним числом 15?
ІІІ рівень
7. Оксид хімічного елемента, що належить до I групи періодичної системи, має відносну молекулярну масу 30. Визначте елемент, вкажіть формулу його оксиду та гідроксиду. 7. Закінчити рівняння реакцій:
Cs + O2 = CaO + H2O = H2 + I2 =
IV рівень
9.Елемент знаходиться у IV групі періодичної системи елементів. Масова частка елемента в його вищому оксиді дорівнює 60%. Назвати елемент.
Варіант4
І рівень
1. Які елементи належать до тріади Феруму?
2. Як називаються орбіталі, що мають форму кулі?
3. В якого елемента з даного ряду найбільш виражені металічні властивості?
F, K, P, Cl.
ІІ рівень
4.Протонне число елемента ІІІ періоду, атом якого має на зовнішньому енергетичному рівні 5 електронів, дорівнює …
5. Які пари хімічних елементів мають найбільш подібні хімічні властивості?
1) Ca i Sr, 2) Se i Br, 3) Ca i Sc.
6. Установіть відповідність між електронною формулою та атомом елемента.
1) 1s22s22p33s1 A) C
2) 1s22s22p2 Б) N
В) Na
ІІІ рівень
8. Елемент належить до V групи періодичної системи. Відносна молекулярна маса його леткої сполуки 34. Записати цю формулу та формулу його оксиду. 7. Закінчити рівняння реакцій:
Ca + O2 = Rb2O + H2O = H2 + Cl2 =
IV рівень
9. В оксиді тривалентного металу масова частка Оксигену становить 47,1%. Який це метал?
Варіант5
І рівень
1. Загальне число електронів в атомі дорівнює … 2. Скільки протонів містить ядро атома Mg?
2. Максимальне число електронів, які можуть займати s-підрівень, дорівнює …
ІІ рівень
4.Установіть відповідність між елементом та його валентними електронами.
1) Cl A) …2s22p4
2) O Б) …3s1
В) …3s23p5
5. Протонне число елемента ІІ періоду, атом якого має на зовнішньому енергетичному рівні 7 електронів, дорівнює …
6. Вкажіть протонні числа елементів, атоми яких мають однакову кількість енергетичних рівнів:
1) 14 і 22, 2) 14 і 15.
ІІІ рівень
7. Оксид хімічного елемента, що належить до II групи періодичної системи, має відносну молекулярну масу 40. Визначте елемент, вкажіть формулу його оксиду та гідроксиду. 8. Закінчити рівняння реакцій:
Rb + O2 = BaO + H2O = H2 + Br2 =
IV рівень
9.Елемент утворює оксид складу ЕО3. Масова частка Гідрогену в його леткій сполуці – 5,88%. Про який елемент йдеться?
Варіант6
І рівень
1. Чому дорівнює вища валентність елемента в періодичній системі?
2. Скільки електронів містить атом Оксигену? 3. Як поділяють кожну групу в періодичній системі?
ІІ рівень
4. Яка кількість електронів міститься на зовнішньому енергетичному рівні в атомі елемента з протонним числом 17?
5. Установіть відповідність між електронною формулою та атомом елемента.
1) 1s22s22p6 A) S
2) 1s22s22p63s23p1 Б) Al
В) Ne
6. Які пари хімічних елементів мають найбільш подібні хімічні властивості?
1) Li i Na, 2) Li i Cu, 3) Na i Mg.
ІІІ рівень 7. Закінчити рівняння реакцій:
Ba + O2 = Li2O + H2O = H2 + F2 =
8. Елемент належить до ІV групи періодичної системи. Відносна молекулярна маса його леткої сполуки 32. Записати цю формулу та формулу його оксиду.
IV рівень
9. Елемент V групи періодичної системи елементів утворює вищий оксид, відносна молекулярна маса якого вдвічі більша за відносну молекулярну масу хлору. Який це елемент?
3.Домашнє завдання. Повтор. П.4-12.
Для нотаток:
_______________________________________
_______________________________________ _______________________________________ _______________________________________ _______________________________________
_______________________________________ _______________________________________ _______________________________________ _______________________________________
_______________________________________ _______________________________________
_______________________________________
_______________________________________ _______________________________________ _______________________________________ _______________________________________
_______________________________________ _______________________________________
_______________________________________ _______________________________________ _______________________________________ _______________________________________ _______________________________________
_______________________________________



про публікацію авторської розробки
Додати розробку
