Конспект уроку у 9 класі Тема "Горіння вуглеводнів. Визначення яісного складу вуглеводнів за продуктами горіння"
9 клас Урок №40. Тема. Горіння парафіну, визначення його якісного складу за продуктами згоряння.
Мета: навчальна: розширити знання про вуглеводні, показати, як використовуючи експеримент, можна визначити якісний склад вуглеводню за продуктами згоряння.
розвиваюча: розвивати пізнавальний інтерес, увагу, логічне мислення, вміння самостійно робити висновки та оцінювати свою роботу на уроці, розвивати предметну, комунікативну, полікультурну компетентність.
виховна: розвивати пізнавальні інтереси учнів; сприяти формуванню в учнів уявлень про зв’язок теорії з практикою.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок та їх творчого застосування на практиці.
Форми роботи: бесіда , фронтальна робота з класом, демонстраційний експеримент,
Обладнання: мультимедійна презентаці.
Хід уроку
І. Актуалізація опорних знань.
Перевірка д/з
Впр. 3 ст. 136
А) С3Н8 + 5О2 → 3СО2 + 4Н2О
Б) 2С4Н10 + 13О2 → 8СО2 + 10Н2О
В) С5Н12 + 8О2 → 5СО2 + 6Н2О
Г) С7Н16 +11О2 → 7СО2 + 8Н2О
Перевірка знань (у формі хімічного диктанту або усних відповідей)
1. Пригадайте, які гомологічні ряди вуглеводнів ми вивчали?
2. Який хімічний елемент обов’язково входить до складу органічних речовин?
3. Як називаються ненасичені вуглеводні, в молекулах яких між атомами Карбону є один подвійний зв’язок?
4. Як називаються ненасичені вуглеводні, в молекулах яких між атомами Карбону є один потрійний зв’язок?
5. Як можна назвати одним словом наступні речовини: етен, пропен, бутен, пентен.
6. Перший представник гомологічного ряду алкенів.
7. Перший представник гомологічного ряду алкінів.
8. Загальна формула алканів.
9. Загальна формула алкенів.
10. Загальна формула алкінів.
11. Чим відрізняються за хімічними властивостями алкани, алкени, алкіни?
12. Яку хімічну властивість виявляють всі вуглеводні?
ІІ. Мотивація навчальної діяльності.
Обов’язковий елемент органічних сполук – Карбон, майже завжди – Гідроген, Мета уроку навчитися виявляти ці елементи в органічних речовинах.
ІІІ. Вивчення нового матеріалу
- Пригадайте, які речовини утворюються під час горіння будь-якого вуглеводню? Напишіть рівняння реакції горіння різних вуглеводнів (3 учня на дошці записують рівніння реакцій горіння етану, етену, етину.
- Реакцією горіння можна скористатися, щоб довести якісний склад алканів:
- Визначимо якісний склад парафіну.
Демонстраційний дослід: (відео)
Горіння парафіну, визначення його якісного складу за продуктами згоряння.
Дослід 1.
- Збираємо прилад: розташуємо над свічкою, що горить, суху склянку.
- Спостерігаємо: на холодних стінках склянки утворюються краплі води.
3. Робимо висновок: під час горіння парафіну утворюється вода. Джерелом Гідрогену для утворення Н2О є парафін. Отже, до складу парафіну входить Гідроген.



Дослід 2.
- Збираємо прилад: розташуємо над свічкою, що горить, склянку, стінки якої змочені вапняною водою (Са(ОН)2).
- Спостерігаємо: на стінках склянки прозорі краплі вапняної води поступово стають білими.
- Робимо висновок: Вапняна вода стала каламутною, краплі побіліли. Це говорить про те, що в пробірці утворився вуглекислий газ , який зреагував з вапняною водою, в результаті чого утворився нерозчинний СаСО3. Джерелом Карбону для утворення СО2 є парафін. Отже, до складу парафіну входить Карбон.
Са(ОН)2 + СО2 → СаСО3↓+ Н2О
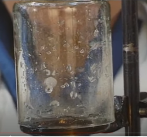


Зробимо висновок щодо якісного складу парафіну: до складу парафіну входять атоми Карбону і Гідрогену.
ІІІ. Закріплення набутих знань. Розв’язок вправ та задач.
Ст. 136 №4
|
m (C5Н12) = 7,2 г
ν (Н2О) - ? |
7,2 г х моль C5Н12 + 8О2 =5 CO2 + 6Н2О 72 г 5моль 7,2 · 5
72 Відповідь: 0,5 моль Н2О |
Здійснити перетворення:
CО2 СО2 CО2 СО2
↑ ↑ ↑ ↑
С → СН4 → С2Н2 → С2Н4 → С2Н6 → C2H5Br
↓ ↓ ↓
СН3Cl С2Н2Br4 С2Н4Cl2
ІV. Підведення підсумків уроку.
V. Домашнє завдання
Повторити § 24 – 27.Впр. 2 ст 136.
-
Дякую.


про публікацію авторської розробки
Додати розробку
