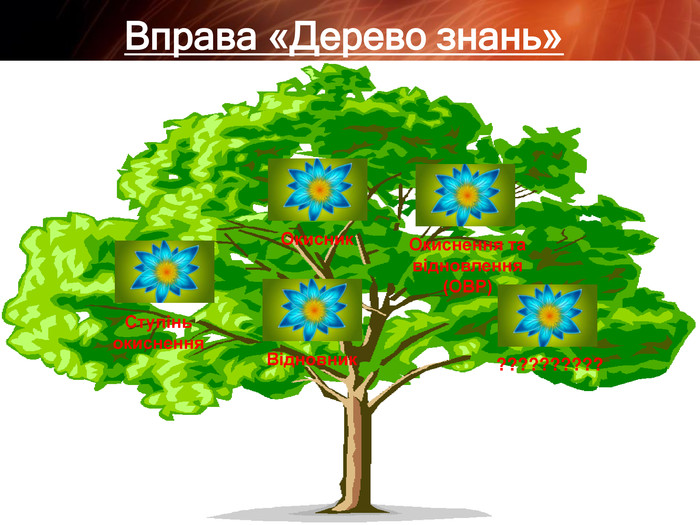
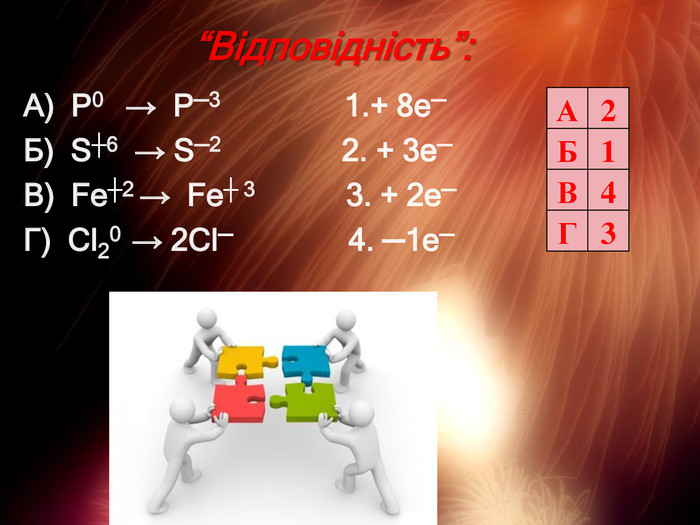
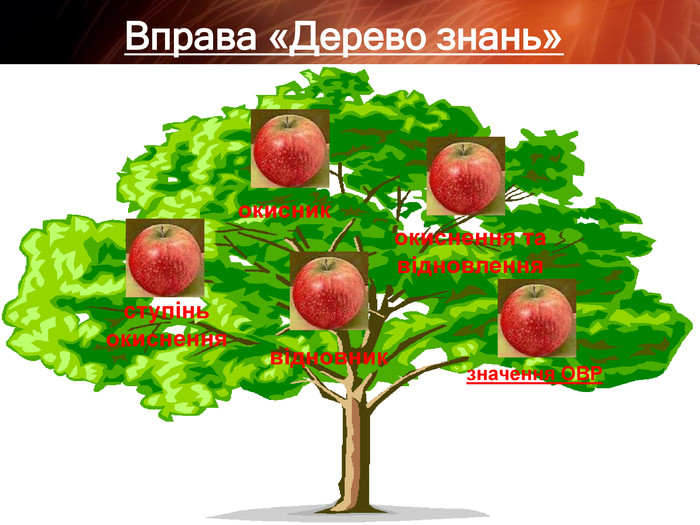
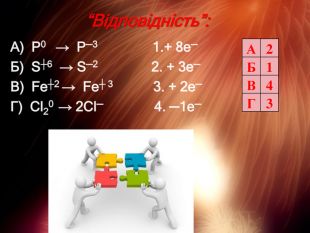
Презентація "Складання рівнянь окисно-відновних реакцій"
Про матеріал
Дану презентацію можна використовувати по темі "Окисно-відновні реакції" для 9-го класу Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Дякую
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку