Конспект уроку з хімії для 7 класу на тему: "Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності"
№ 26
Дата: _____________
Дата: Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор. Способи збирання кисню. Доведення наявності кисню.
Тема: Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор.
Очікувані результати: учень складає рівняння реакції добування кисню з гідроген пероксиду, пояснює суть реакцій розкладу, знає як використовувати лабораторний посуд для добування (з гідроген пероксиду) і збирання кисню.
Тип уроку: комбінований.
Методи навчання: словесні, наочні, практичні.
Клас: 7 клас.
Демонстрації
6. Добування кисню з гідроген пероксиду.
7. Збирання кисню витісненням повітря та витісненням води.
8. Доведення наявності кисню.
Хід уроку
I. Організаційна частина.
II. Перевірка домашнього завдання.
III. Актуалізація опорних знань і мотивація навчальної діяльності.
У складі хімічних сполук Оксиген розповсюджений на земній поверхні так, як жоден інший елемент. Він становить близько 8/9 масових частин води (88,8% масових). У твердому зовнішньому шарі Землі на частку Оксигену припадає 47 % масових. У повітрі поряд з азотом і незначною кількістю інших домішок міститься 23,15 % масових, або 21 % об'ємних. Оксиген входить до складу таких біологічно важливих речовин, як вода, білки, жири, вуглеводи, нуклеїнові кислоти.
Про роль кисню в природі написані тисячі книг. Усі тварини дихають киснем і в безкисневій атмосфері просто не можуть існувати. Лише деякі мікроорганізми – анаеробні бактерії, живуть без кисню.
Вдихуваний кисень окиснює вуглеводи та інші речовини, і в цьому хімічному процесі виділяється та енергія, що витрачається на всі життєві процеси. Весь кисень виник і зберігається на планеті завдяки процесу фотосинтезу.
IV. Засвоєння нових знань
• В який спосіб можна зібрати кисень?
Немає сумніву, що заповнюючи пробірку водою, ви її триматимете дном донизу, а не навпаки. Тепер уявіть собі, що ви надумали заповнити пробірку водою, тримаючи її догори дном. Що з цього вийде? Щось подібне спостерігатиметься, якщо ви будете наповнювати пробірку важчим за повітря газом, що розташована догори дном. Він «виливатиметься», а точніше буде опускатися вниз, а не підніматиметься вгору. Зібрати такий газ у розташовану догори дном пробірку вам не вдасться. Зовсім по-іншому поводить себе газ, легший за повітря. Виділившись через газовідвідну трубку, він піднімається вгору. Там йому на перепоні стає дно пробірки-приймача, розташованої догори дном, і газ залишається в ній. Якщо ж такий газ збирати в пробірку, розташовану донизу дном, то він не опускатиметься на дно пробірки, а підніматиметься вгору й полишить пробірку.
• Як перевірити наявність кисню в склянці?
• Основне джерело одержання кисню в природі. (Фотосинтез – відбувається на світлі за участю хлорофілу. При цьому з вуглекислого газу та води утворюється глюкоза та кисень)
6СО2 + 6Н2О → С6Н12О6 + 6О2↑
• Основний спосіб промислового одержання кисню. (Перегонка рідкого повітря. Так як повітря – це суміш газів, основними компонентами є азот і кисень. Для отримання кисню повітря під тиском зріджують. Але температура кипіння рідкого азоту -296 ͦ С нижче температури кипіння рідкого кисню -183 ͦ С, то азот випаровується а кисень залишається. Газоподібний кисень зберігають у стальних балонах під тиском 15 МПа)
Запишемо на дошці основні способи одержання кисню в лабораторії.
1. Розклад води при постійному струмові:
2Н2О → Н2↑ + О2↑
2. Розклад пероксиду водню в присутності каталізатора MnO2:
2Н2О2 → Н2О + О2↑
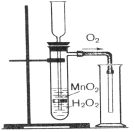
Прискорення реакції розкладу пероксиду водню в присутності манган(ІV) оксиду.
3. Розклад оксиду ртуті (ІІ) при нагріванні:
2НgО → 2Нg + О2↑
4. Розклад хлорату калію (бертолетової солі) при нагріванні в присутності каталізатора MnO2:
2КСlО3 → 2KCl + 3О2↑
- при нагріванні без каталізатора відбувається інша реакція:
4КСlО3 → KCl + 3КСlО4
5. Розклад перманганату калію при нагріванні:
2КMnО4 → К2MnО4 + MnО2 + 3О2↑
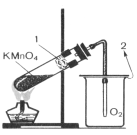
Збирання кисню методом витіснення повітря: 1 – стікловата; 2 – повітря.
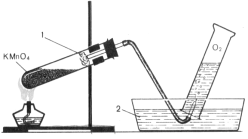
Збирання кисню методом витіснення води: 1 – скловата; 2 – вода.
6. Розкладання нітратів (за умови, що метал з якого утворена сіль стоїть в ряду активності металів до міді):
2KNO3 → 2KNO2 + O2↑
• До якого типу належать реакції одержання кисню? (Розкладу)
• Які речовини називаються каталізаторами? (Речовини, що прискорюють реакції, самі при цьому не витрачаючись)
• Що таке інгібітори? (Речовини, що сповільнюють реакції, негативні каталізатори)
V. Узагальнення і систематизація знань.
- Охарактеризуйте Оксиген як хімічний елемент. До складу яких він природних речовин входить?
- Схарактеризуйте кисень як просту речовину. Де він трапляється?
- Як можна добути кисень в лабораторії?
- Що таке каталізатори і яке їхнє значення в хімічних процесах?
- Як добувають кисень в промисловості.
Розв’язування вправ за підручником с. ________________
VІ. Підсумок уроку
VІІ. Домашнє завдання.
Опрацювати §
Письм. №


про публікацію авторської розробки
Додати розробку
