Конспект уроку з хімії для 7 класу на тему: "Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання). Умови виникнення та припинення горіння."
№ 28
Дата: _______________
Тема: Поняття про оксиди, окиснення (горіння, повільне окиснення, дихання). Умови виникнення та припинення горіння.
Очікувані результати: учень називає склад оксидів, пояснює суть реакцій сполучення, процесів киснення, розрізняє процеси горіння, повільного окиснення, дихання, описує поширеність Оксигену в природі; його фізичні властивості; складає рівняння реакцій кисню з воднем, вуглецем, сіркою, магнієм, залізом, міддю, метаном, гідроген сульфідом.
Тип уроку: комбінований.
Методи і прийоми: словесні, наочні, практичні.
Клас: 7 клас.
Основні поняття і терміни: оксиди, окислення, горіння.


Кисень
З покоління в покоління
Світ без мене – ні на мить
Не зупиниться й незгасне
Я бажаю все спалить
Завдяки мені горить,
Даючи тепло вугілля,
Проростає хліб чи зілля.
Мною всі на світі люди
Дихають на повні груди
З воднем в бурю чи негоду
Ми народжуємо воду,
Щоб поїла світ зелений,
Льон, пшеницю, горді клени.
Перебіг уроку
I. Організаційна частина.(1 хв.)
II. Актуалізація опорних знань. Перевірка домашнього завдання. (15 хв.)
Учень на дошці пише домашнє завдання.
Обговорення:
1. Положення Оксисену в періодичній системі.
Доповіді учнів:
2. Історія відкриття кисню.
3. Характеристика простих речовин кисню та озону.
4. Застосування кисню та озону.
Вікторина
1. Який порядковий номер у Оксигену в періодичній системі?
2. Яка валентність у Оксигену?
3. Які прості речовини утворює Оксиген?
4. Агрегатний стан кисню за звичайних умов?
5. Важчим чи легшим за повітря є кисень?
6. Вкажіть розчинність кисню у воді.
7. Скільки атомів оксисену входить до складу озону?
8. Що таке каталізатор?
9. В який спосіб можна зібрати кисень?
10. Як перевірити наявність кисню в склянці?
11. Вкажіть формулу води та кількість атомів Оксигену в ній.
12. Яка відносна молекулярна маса кисню.
13. В якій групі розташований Оксиген?
Перевірка домашнього завдання
III. Мотивація навчальної діяльності (1 хв.)
Проста речовина кисень підтримує горіння. Кисню, що міститься в повітрі, досить для горіння дров у багатті, природного газу в грубці, вугілля в каміні. Якщо використовувати для горіння чистий кисень, воно відбувається інтенсивніше.
Розгляньмо процес взаємодії кисню з деякими простими і складними речовинами, а також сполуки що утворюються при цьому.
Тому тема нашого уроку: Поняття про оксиди, окиснення.
Що це нам дає:
- поглиблюємо знання про властивості кисню
- знаючи властивості кисню попереджуємо процеси гниття, скисання, ржавіння
- розширюємо кругозір про речовини побуту
- вивчаємо хімію і здобуваємо позитивні оцінки на уроці
IV. Вивчення нового матеріалу.(20 хв.)
- Взаємодія речовин з киснем не завжди супроводжується горінням. Більшість таких реакцій відбувається непомітно:
- скисання молока
- ржавіння заліза
- гниття
Речовина, взаємодіючи з киснем, зазнає окислення, тобто змінюється за участю кисню. (Такі реакції називаються реакціями окиснення).
Запис в зошит
Окиснення – це хімічна реакція взаємодії речовин (простих і складних), з киснем.
Окиснення
![]()
![]()
![]()
Повільне окиснення: Горіння Вибух
- гниття опалого листя
- згіркнення масла
- іржавіння заліза
- дихання
- Опрацювання параграфа підручника с. 131
Повільним окисненням речовин зумовлено ржавіння заліза, скисання молока, фруктових і ягідних соків, прогорання масла, псування багатьох інших продуктів харчування.
Кисень, потрапляючи через легені в організм людини, окиснює різні сполуки, в тому числі й ті, які постійно входять із їжею.
Дихання – приклад життєво необхідного повільного окиснення в живій природі.
Фізкультхвилинка
Повторення правил БЖД.
Спалювання простих та складних речовин.
Взаємодія кисню з деревом.
- Ми знаємо що кисень підтримує і пришвидшує горіння але сам при цьому не горить. Пересвідчимося в цьому…
Взаємодія кисню з залізом.
- В О2 горять такі речовини, які звичайно вважаються негорючими, наприклад залізо. Якщо до тонкої стальної проволоки прикріпити сірник, запалити і опустить у атмосферу з киснем, то від нього загориться й залізо:
3Fe + 2O2 → FeO ∙ Fe2O3 – залізна окалина (або Fe3O4)
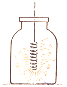
Горіння заліза в кисні.
Горіння – це хімічна реакція, за якої відбувається окиснення речовин з виділенням тепла і світла. У більшості випадків у результаті цих реакцій утворюються оксиди.
- Опрацювання параграфа підручника с. 130
Оксиди – це складні речовини, що складаються з двох елементів, один з яких – Оксиген з валентністю II.
Загальна формула оксидів ЕnOm.
Найпоширенішим оксидом на нашій планеті є звичайна вода!
2Н2 + О2 → 2Н2О
Презентація оксиди.
Кожний оксид має хімічну назву, а деякі ще й традиційні, або тривіальні назви. Хімічна назва оксиду складається із двох слів. Першим словом є назва відповідного елемента, а другим словом – «оксид». Якщо елемент має змінну валентність, то він може утворювати кілька оксидів. Їх назви мають відрізнятися. Для цього після назви елемента вказують (без відступу) римською цифрою в дужках значення його валентності в оксиді. Приклад: купрум(ІІ) оксид (читається «купрум-два-аксид»). Оксиди в яких елемент має найбільшу валентність (відповідає номеру групи) називаються вищими.
V. Закріплення знань. (6 хв.)
Напишіть рівняння реакцій та дайте назви оксидам:
Li + O2 →
N2 + O2 →
Ca + O2 →
С + O2 →
АІ + O2 →
N2 + O2 →
Складіть формули оксидів:
Хлор(ІІ) оксид
натрій оксид
фосфор(ІІІ) оксид
магній оксид
Сульфур(VI) оксид
VI. Підсумок уроку.(1 хв.)
VІI. Домашнє завдання. (1 хв.)
Вивч. § 28 (с. 129-133)
Письм. № 7 (с. 134)
Творче завдання.
Повідомлення:
Значення кисню.
Оксиди у природі.
Умови виникнення і припинення горіння.


про публікацію авторської розробки
Додати розробку
