Конспект уроку з хімії для 8 класу на тему: " Кількість речовини. Одиниця кількості речовини. Число Авогадро". "
Тема: Кількість речовини. Одиниця кількості речовини. Число Авогадро.
Цілі уроку: Забезпечити в ході уроку введення нових понять « кількість речовини «, « моль – одиниця кількості речовини «; з’ясувати значення сталої Авогадро; формувати вміння користуватися набутими знаннями при розв’язуванні розрахункових задач ( на визначення кількості речовини, числа структурних частинок речовини); розвивати самостійність та творчість учнів при розв’язуванні задач; розвивати пізнавальний інтерес учнів, включаючи в зміст уроку елементи нових знань. Формувати умінні працювати в колективі, спілкуватися рідною мовою.
Очікувані результати: учні називають одиницю вимірювання кількості речовини,сталу Авогадро; обчислюють число частинок (атомів, молекул, йонів) у певній кількості речовини, кількість речовини; роблять висновки щодо значущості математичних знань для розв’язування хімічних задач.
Тип уроку: урок вивчення й первинного закріплення нових знань
Методи та прийоми: бесіда, розповідь, самостійна робота учнів.
Хід уроку
І. Організація початку уроку
Привітання
Відомий американський підприємець Генрі Форд говорив «Зібратися разом — це початок, триматися разом — це прогрес, працювати разом — це успіх». Тож я бажаю вам успіху сьогодні.
ІІ. Підготовка учнів до засвоєння, актуалізація опорних знань
Майже все, що людина бачить навколо себе, вона намагається описати кількісними характеристиками. Так, коли ми витрачаємо воду, ми лічимо, скільки літрів (або кубометрів ) її витекло з крана. Купуючи цукерки, ми говоримо продавцеві, скільки грамів потрібно зважити. Але в певних випадках знання маси або об’єму зовсім недостатньо. Наприклад, нам потрібно купити 240 яблук, щоб вистачило на всіх учнів у школі. Значно простіше, якщо ми знаємо, скільки яблук знаходиться в одному ящику. У цьому випадку достатньо лише полічити кількість ящиків. Тобто ми лічимо не окремі частинки, а число груп чи порцій частинок.
Схожим принципом користуються і в хімії. Не завжди важливо знати масу чи об’єм речовини. Часто набагато важливіше для визначення знати число окремих атомів чи молекул. Тому у хімії, крім використання таких величин, як маса та об ‘єм, застосовують величину про яку йтиме мова на сьогоднішньому уроці.
IІІ. Вивчення нового матеріалу.
Для початку давайте з’ясуємо, про яку ж саме величину піде далі мова.
Для цього виконаємо наступне завдання, після чого зможемо отримати наступні підказки.
Вправа « Дешифрувальник » 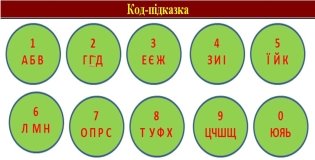
Використовуючи ключ – підказку розшифруйте назву хімічної величини:
5/3, 4/3, 6/1, 0/3, 5/3, 4/3, 7/4, 8/1, 0/3 7/3, 3/1, 9/2, 7/1, 1/3, 4/2, 6/3, 4/2
Тож мова сьогодні піде про кількість речовини, одиниці її вимірювання, та способи обчислення. Про все це ви дізнаєтеся користуючись підказками, які отримаєте виконуючи нескладні завдання.
- Тож, що таке кількість речовини?
Вам відомо, що при перетворенні одних речовин на інші, відбувається розпад молекул на атоми, сполучення атомів у молекули, перегрупування атомів чи йонів.
Тобто, щоб провести якийсь дослід нам потрібно взяти певну кількість молекул, атомів чи йонів якихсь речовин.
- Можливо це зробити?
Тому хіміки і використовують фізичну величину, яка визначається кількістю частинок речовини в певній її порції. Назва цієї величини – кількість речовини.
Кількість речовини — це фізична величина, що вказує на число структурних частинок (атомів, молекул, йонів), які містяться в даній порції цієї речовини.
Позначається кількість речовини – n ( ен).
Як і будь-яка фізична величина, кількість речовини має одиницю виміру. Назву якої ви дізнаєтеся скориставшись наступною підказкою
Назва одиниці вимірювання кількості речовини походить від латинського слова « moles «, що в перекладі значить « маленька маса».
- Здогадалися назву цієї одиниці? Підручник с.101
Моль — це кількість речовини, що містить стільки структурних частинок (атомів, молекул, йонів), скільки атомів міститься в Карбоні масою 0,012 кг (12 г).
Моль — це порція речовини, маса якої чисельно дорівнює її відносній атомній, молекулярній чи формульній масам. Тому 1 моль сірки має масу 32 г, водню — 2 г, вуглецю — 12 г, натрій хлориду — 58,5 г, води — 18 г.
Демонстрація порцій речовин кількість 1 моль
Відомий італійський учений, ім’я та прізвище якого ви дізнаєтеся, розгадавши наступну підказку, вивчив і виміряв кількість речовини для різних речовин.


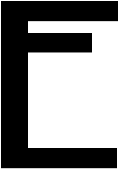


 3 == Г
3 == Г ![]()
![]()

Італійський учений А. Авогадро обчислив та експериментально дослідив число атомів у Карбоні з нуклонним числом 12, масою 0,012 кг (12 г), що відповідає кількості речовини вуглецю 1 моль. З цією метою він поділив цю масу на масу одного атома Карбону й отримав число 6,02 · 1023.
За допомогою обчислень А. Авогадро підрахував, що у 12 г вуглецю міститься 6,02 • 1023 атомів. Таку кількість речовини взяли за 1 моль.
Подібні обчислення показали, що:
у 32 г сірки міститься 6,02 1023 атомів;
у 18 г води міститься 6,02 1023 молекул.
Ця величина отримала назву стала (число) Авогадро.
Позначається вона NA= 6,02 • 1023 частинок/моль, або моль-1. Ця величина не залежить від агрегатного стану речовини.
Число Авогадро 6,02 *1023 — це число, що вказує на кількість структурних частинок, які містяться в 1 моль будь якої речовини незалежно від її агрегатного стану.
Стала Авогадро настільки велика, що складно й уявити. Ось деякі приклади, що показують велич цього числа.
- У пустелі Сахара міститься менше, ніж 3 моль найдрібніших піщинок.
- Якщо об’єм футбольного м’яча збільшити в таку кількість разів, то в ньому поміститься земна куля.
- Якщо в NA разів збільшити діаметр м’яча, то в ньому поміститься найбільша галактика, що має сотні мільярдів зірок.
- Якщо взяти 1 моль доларових папірців, вони вкриють усі материки Землі щільним шаром завтовшки 2 км.
Якщо кількість структурних частинок речовини N поділити на сталу Авогадро NA (тобто фізико-хімічну константу цього числа), то можна обчислити кількість речовини – n
n = N/NA;
N = NA * n
ІV. Первинне закріплення знань
Здавна людей цікавили різні запитання: « Як?», «Чому?», «Скільки?». А найбільше запитань задають вчителі. Тож давайте спробуємо задовольнити їх цікавість.
Задача І
Історики вважають, що однією з причин занепаду Римської імперії, було систематичне отруєння свинцем: останки стародавніх римлян, знайдені під час розкопок, містять значні кількості цього металу. Саме “ завдяки ” йому середня тривалість життя римлян не перевищувала 25 років. Мене цікавить, скільки атомів свинцю спричинять смерть римлянина, коли його смертельна доза становить приблизно 0, 05 моль?
Задача 2.
Вчителька математики за урок витрачає 0, 15 моль крейди. Скільки молекул крейди вчителька математики витратить за день, коли проведе 7 уроків? .
Задача 3.
Всі знають, що надмірне споживання цукру сприяє розвитку карієсу. Цікаво, скільки молекул цукру «атакуватимуть» ваші зуби, коли ви п’єте солодкий чай? Зауважте, що 1 чайна ложка цукру містить приблизно 0, 02 моль.
Задача 4
На день народження мені подарували 3 повітряні кульки. В кожній з них міститься 21,07 *1023 атомів гелію. А яка кількість речовини гелію міститься в усіх моїх кульках?
Задача 5
Щоб почепити картину я використав 2 залізних цвяхи кожен з яких містить по 0, 602 *1023 атомів Феруму. Яку кількість речовини це становить?
Вітаю вас, ви відповіли на всі запитання наших вчителі, а заодно навчилися обчислювати кількість речовини, та кількість структурних часточок речовини.
Всі завдання ми виконали, тож можемо підвести підсумки.
V. Підбиття підсумків уроку. Рефлексія
Інтерактивний прийом «Мікрофон».
Рефлексивні фрази на екрані:
- Сьогодні я зрозумів…..,
- Було цікаво….,
- Було важко…..,
- Я виконував завдання….,
- Тепер я можу…,
- В мене вийшло….,
- Мене здивувало…
VІ. Інформація про домашнє завдання
- Опрацювати параграф 18 підручника
- Виконати вправу 4 (а,б) с. 104


про публікацію авторської розробки
Додати розробку
