Конспект уроку з хімії для 8 класу на тему:"Кислоти: номенклатура, класифікація. Фізичні та хімічні властивості кислот"
Цей урок дає можливість розширити знання про класифікацію неорганічних речовин на прикладі кислот; ознайомити учнів із номенклатурою кислот, класифікацією та їх складом. Розглянути фізичні та хімічні властивості кислот; ознайомити з поширеністю кислот у природі та їх використанням.
Тема. Кислоти: номенклатура, класифікація. Фізичні та хімічні властивості кислот.
Мета: розширити знання про класифікацію неорганічних речовин на прикладі кислот;
ознайомити учнів із класифікацією кислот за складом, номенклатурою кислот;розглянути фізичні та хімічні властивості кислот; ознайомити з поширеністю кислот у природі та їх використанням., сформувати вміння виявляти кислоти за допомогою індикаторів; розглянути правила техніки безпеки при роботі з кислотами;розвивати вміння логічно та критично мислити, творчо використовувати отриману інформацію, порівнювати та систематизувати.
Тип уроку: засвоєння нових знань
Матеріали: зразки кислот, пробірки, стакан з водою, універсальний індикатор
Обладнання: періодична система хімічних елементів Д.І.Менделєєва, таблиця розчинності.
Хід уроку
І. Організаційний етап
Привітання, перевірка готовності учнів до уроку.
ІІ.Перевірка домашнього завдання. Перевірка виконання письмових завдань.
ІІ. Актуалізація опорних знань
Запитання:
-Як у періоді зі збільшенням порядкового номера хімічних елементів змінюється тип оксидів, які вони утворюють ?(основні – амфотерні – кислотні).
«Мозковий штурм»: « Які речовини?»
а) З яким класом неорганічних речовин ви ознайомились?
б) Які речовини називають оксидами?
в) Як складаються назви оксидів?
г) У якому агрегатному стані перебувають оксиди? Наведіть приклади.
д) За якими ознаками можна класифікувати оксиди?
Мотивація
- Що спільного між лимоном, томатом, квашеною капустою, щавлем та кефіром?
- Чому від кропиви виникає подразнення шкіри?
- Чому чай після додавання лимону світлішає?
Саме так, сьогодні мова піде саме про кислоти. Запитання до учнів – що вам відомо про кислоти?
Учні формулюють питання, які слід розглянути на уроці:
-Що таке кислоти, який склад вони мають?
-Які назви мають кислоти?
-За якими ознаками класифікують кислоти?
-Яким чином можна виявити кислоти?
-Якими хімічними властивостями характеризуються кислоти?
-Де використовуються кислоти?
VІ. Вивчення нового матеріалу.
- Склад та назви кислот.
Розповідь вчителя. У лимонах і грейпфрутах міститься лимонна кислота, у щавлі – щавлева, у яблуках – яблучна, а в оцті, що утворюється при бродінні виноградного або яблучного соку - оцтова. Все це приклади органічних кислот. Серед кислот є й неорганічні. Наприклад, до числа неорганічних (мінеральних) кислот відносяться сульфатна і хлоридна кислоти.
(Складання схеми)
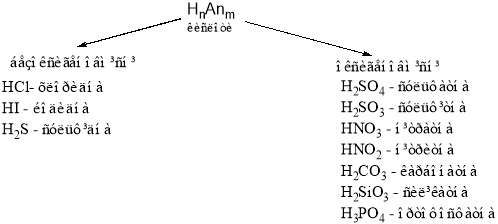
Завдання:
Порівняйте склад кислот, визначте спільне.
У всіх кислот є атом гідрогену, символ Гідрогену стоїть на першому місці у формулах кислот.
Учитель зауважує, що у формулах кислот можна виділити кислотний залишок. До складу кислотного залишку може входити атом або група атомів.
Учні за допомогою вчителя дають визначення кислот:
Кислоти – це складні речовини, до складу яких входять атоми Гідрогену й кислотний залишок.
- Класифікація кислот.
Валентність кислотного залишку дорівнює числу атомів Гідрогену в молекулі кислоти.
Запитання учням: чому? (тому що валентність Гідрогену завжди дорівнює І).
Кислоти можна класифікувати за цілим рядом ознак:
-за кількістю атомів Гідрогену;
-за наявністю атомів Оксигену;
-за ступенем дисоціації;
-за окисною здатністю;
-за міцністю.
3. Фізичні властивості кислот.
Фізичні властивості кислот залежать від їх будови. Кислоти – молекулярні речовини. При звичайних умовах вони можуть бути рідкими (H2SO4, H2SO4) або твердими (H3BO3, H2SiO3). Між молекулами оксигеновмісних кислот утворюються водневі зв’язки. Майже всі мінеральні кислоти, за винятком силікатної H2SiO3, розчиняються у воді. Їх розчина мають кислий смак, руйнують рослинні та тваринні тканини. Густина, температури кипіння та плавлення кислот змінюються у широких межах.
Хімічні властивості кислот
- Дія на індикатори
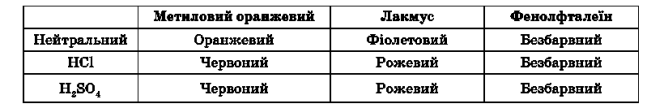
Речовини, які змінюють своє забарвлення внаслідок дії кислот або лугів називаються індикаторами.
2. Розглянемо, як узаємодіють кислоти з металами.
— Чому метали неоднаково реагують із кислотою?
Це пов'язано з властивостями металів. М. М. Бекетов розташував метали відповідно до їх активності в ряд від найсильніших до найслабших. Цей ряд так і називається — ряд активності металів. (Розглядаємо таблицю, знаходимо ряд активності металів у підручнику.)
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb 2H Cu Hg Ag Pt Au
←Зростання активності металу Зменшення активності металу →
Водень серед металів перебуває не випадково. Він розділяє метали на активні, які витісняють водень із розчинів кислот, і ті, що не взаємодіють із розчинами кислот і водень не витісняють.
2HCl + Mg = MgCl2 + H2↑,
2HCl + Fe → FeCl2 + H2↑,
H2SO4(розв.) + Mg →MgSO4 + H2↑,
2H3PO4 +2Al → 2AlPO4↓ + 3H2↑,
H2SO4(розв.) + Pb → PbSO4↓ + H2↑.
реакція заміщення
Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів, наприклад:
4Mg + 9HNO3(розв.) → 4Mg(NO3)2 + NH3↑+ 3H2O,
Концентрована нітратна кислота при взаємодії з металами відновлюється до нітроген (IV) оксиду, а метал при цьому окиснюється найчастіше до максимального (чи достатньо високого) ступеня окиснення.
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑+ 2H2O
Концентрована сульфатна кислота, при взаємодії з металами залежно від їх активності, температури середовища, ступеня концентрування кислоти може відновлюватися по-різному. Малоактивні метали відновлюють H2SO4(конц.) до SO2, метали середньої активності – до вільної сірки S0, активні метали – переважно до H2S
2Ag + 2H2SO4(конц.) → Ag2SO4 + SO2↑ + 2H2O,
3Ni + 4H2SO4(конц.) → 3NiSO4 + S + 4H2O,
4Mg + 5H2SO4(конц.) → 4MgSO4 + H2S↑ + 4H2O.
(Al, Cr, Fe, Ti пасивуються)
3) З основними і амфотерними оксидами кислоти утворюють середні солі.
2HCl + ZnO → ZnCl2 + H2O
Реакція обміну
4) Взаємодія кислот з основами
KOH + HCl → KCl + H2O
Реакція обміну
Така реакція між розчинами кислот і основ називається реакцією нейтралізації. Поясніть, чому.
Кислоти взаємодіють із солями.
5) Кислоти можуть витісняти більш слабкі кислоти з їхніх солей.
Кислоти реагують з солями, якщо внаслідок реакції випадає осад, виділяється газ чи утворюється слабкий електроліт
H2SO4 + BaCl2 → BaSO4↓ + 2HCl,
2HNO3 + CaCO3→ Ca(NO3)2 + CO2 + H2O,
HCl + NaNO2 → HNO2 + NaCl
Які правила безпеки слід виконувати, працюючи з кислотами?
Пам'ятайте! Працювати з кислотами треба вкрай обережно. Якщо кислота випадково потрапила на шкіру, її треба негайно змити великою кількістю проточної води, поки не перестане пекти, потім промити розчином питної соди й звернутися до лікаря. У разі потрапляння кислоти в очі необхідно промити їх водою і негайно звернутися до лікаря.
Використання кислот.
(випереджальне завдання, виступ учня)
. Кислоти є дуже поширеними речовинами. У своєму житті ви дуже часто з ними стикаєтесь. В багатьох овочах, фруктах і ягодах містяться органічні кислоти – лимонна, яблучна, щавлева, виноградна, винна, янтарна. При скисанні продуктів також утворюються кислоти. Навколо нас зустрічаються також неорганічні кислоти. Навіть прісна вода містить невеликі домішки карбонатної кислоти завдяки розчиненню в ній вуглекислого газу. Дощова вода часто містить домішки сульфітної або сульфідної кислот, які потрапляють у повітря під час виверження вулканів. У шлунку завжди міститься розчин хлоридної кислоти.
Кислоти є одними з найважливіших речовин у промисловості, і не тільки в хімічній. Найбільша увага приділяється сульфатній, нітратній, хлоридній та фосфатній кислотам. Їх добувають на хімічних заводах у величезних кількостях, особливо сульфатну. Часто навіть про рівень розвитку якої-небудь країни судять по тому, скільки вона виробляє сульфатної кислоти. А це саме тому, що сульфатну кислоту (як і інші кислоти) використовують майже у всіх галузях народного господарства. Без цих кислот неможливо виготовляти метали, тканини, папір, мінеральні добрива тощо. Величезні об`єми сульфатної кислоти витрачаються у виробництві кольорових металів, мийних засобів, ліків і барвників, вибухових матеріалів, акумуляторів і сірників.
У великих кількостях кислоти використовує і харчова промисловість, і не тільки як смакові приправи для надання кислого смаку. В більшості випадків кислоти (оцтова, лимонна, бензойна, винна, щавлева) використовуються як консерванти – речовини, які уповільнюють псування харчових продуктів.
Майже в кожному домі є оцет (розчин оцтової кислоти) і лимонна кислота для приготування їжі. В домашній аптечці завжди знайдеться аскорбінова кислота (вітамін С), ацетилсаліцилова кислота (аспірин) і борна кислота (її розчин використовується для дезінфекції). (Учитель демонструє добавки та ліки, про які йде мова.)
V. Узагальнення та систематизація знань
Завдання.
1) З наведеного переліку речовин випишіть формули кислот: CaO, H2SiO3,K2SO4, HCl, HNO3, MgCl2, CO2, HPO3, NaOH, HBr, HCIO4, AgCl, HF, FeS, H2S, NaNO2, H2SO3. Серед виписаних формул підкресліть формули безоксигенових кислот.
2) Дано 2 пробірки з прозорими розчинами. Відомо, що в одній з них кислота, а в іншій вода. Запропонуйте метод, за яким можна знайти, в якій з пробірок кислота. Доведіть своє твердження дослідним шляхом.
3)Які з перелічених сполук реагують з розведеним розчином сульфатної кислоти: NaCl, Zn, Al2O3, P2O5, CO, Na2HPO4, , BaCl2, CO2, Mg(ОН)2, NH3, Cr(OH)3, НNO3, CaО? Складіть рівняння відповідних реакцій.
4)Які з перелічених металів реагують з хлоридною кислотою: Mg, Cu, Fe, AI, Hg, Ca? Складіть рівняння відповідних реакцій.
VІ. Домашнє завдання
Опрацювати параграф 28,29 вправа 8, стор. 113
VІІ. Підсумки уроку


про публікацію авторської розробки
Додати розробку
