Урок на тему"Нерозчинні основи. Розкладання нерозчинних основ під час нагрівання. Використання основ".
Дана розробка дасть можливість:
- закріпити знання учнів про хімічні властивості основ;
- розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ; здатність висловлювати свої думки; пізнавальний інтерес учнів до більш глибокого вивчення хімії ; через порівняння знаходити подібність та відмінність між розчинними і нерозчинними основами ;
- виховувати особистість, здатну творчо мислити і застосовувати свої знання у нестандартних ситуаціях.
Дата ______ Клас _____ Вчитель: Дерев’янко Л.В.
УРОК № ______
Тема. Нерозчинні основи. Розкладання нерозчинних основ під час
нагрівання. Використання основ.
Мета :
- закріпити знання учнів про хімічні властивості основ;
- розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ; здатність висловлювати свої думки; пізнавальний інтерес учнів до більш глибокого вивчення хімії ; через порівняння знаходити подібність та відмінність між розчинними і нерозчинними основами ;
- виховувати особистість, здатну творчо мислити і застосовувати свої знання у нестандартних ситуаціях.
Тип уроку: формування вмінь і навичок.
Форма проведення : урок-дослідження.
Форми роботи: розв’язування кросвордів ,творчі ігри «Впізнай нас» та «Виділи мене серед інших двічі » ; «Мозковий штурм» , робота з опорною схемою «Хімічні властивості лугів » , самостійна робота з підручником, лабораторна робота у парах, колективне складання опорної схеми «Хімічні властивості нерозчинних основ», розв’язування задач, самоперевірка.
Обладнання:
- Періодична система хімічних елементів Д. І. Менделєєва,
- таблиця розчинності,
- таблиця «Правила техніки безпеки в кабінеті хімії»,
- ряд активності металів,
- дерев’яний тримач , спиртівка, штатив для пробірок, пробірки,
- комп’ютер.
Реактиви : мідь, їдкий натр, кальцій гідроксид, купрум (ІІ) оксид, вода,
розчини сульфатної та хлоридної кислот, купрум (ІІ) нітрат, купрум (ІІ) сульфат.
Базові поняття і терміни: основа, кислота, луг , реакція обміну, нейтралізація, кислотні оксиди, індикатори.
ХІД УРОКУ
I. Організація класу.
II. Перевірка домашнього завдання.
1 2 3
Са СаО Са(ОН)2 Са (NO3)2
- 2Са+ О2 = 2СаО
- СаО+Н2О= Са(ОН)2
3)Са(ОН)2+2Н NO3 = Са (NO3)2+2Н2О
2.Розв’язування кросвордів.
Завдання 1 Назвіть один із класів неорганічних сполук за початковими
літерами слів:
|
1 |
|
|
|
|
|
|
|
|
|
|
||
|
2 |
|
|
|
|
||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
||||||
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|||||
1.Якість, притаманна людині, яка вміє поводитись з лугами.
2.Клас речовини, яка утворюється при взаємодії кислотних оксидів з лугами.
3.Дія кислоти на луг.
4.Тип реакцій , характерний для лугів.
5.Ознаки, за якими речовини подібні, або відрізняються одна від одної.
6.Категорія металів, що утворюють луги.
Відповідь
|
о |
б |
е |
р |
е |
ж |
н |
і |
с |
т |
ь |
||
|
с |
і |
л |
ь |
|
||||||||
|
н |
е |
й |
т |
р |
а |
л |
і |
з |
а |
ц |
і |
я |
|
о |
б |
м |
і |
н |
у |
|
||||||
|
в |
л |
а |
с |
т |
и |
в |
о |
с |
т |
і |
|
|
|
а |
к |
т |
и |
в |
н |
і |
|
|||||
Завдання 2. Кросворд «Луги»
|
1 |
8 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
12 |
|
|||||||||||||||||||
|
|
|
|
|
5 |
|
|
|
|
|
||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
3 |
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
13 |
|
|
||||
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|||||||||||||||||||
|
4 |
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
||||||||||||||||||||||
По горизонталі:
- Складова частина одного з класів неорганічних сполук.
- Фізична властивість лугів.
- Лужний метал.
- Назва речовин, здатних розчинятися у воді.
- Колір метилоранжу у лузі.
- Речовина , що змінює колір тільки в лугах.
- Клас неорганічних сполук.
По вертикалі:
8.Речовина – визначник.
9. Колір лакмусу у лузі.
10.Медичний інструмент.
11.Колір лугів у твердому стані.
12.Кислота, яка використовується для нейтралізації лугу на поверхні
шкіри.
13.Характер лугу.
Відповідь
|
г |
і |
д |
р |
о |
к |
с |
о |
г |
р |
у |
п |
а |
|||||||||||
|
|
н |
|
б |
|
|||||||||||||||||||
|
д |
|
|
|
ж |
о |
в |
т |
и |
й |
||||||||||||||
|
м |
и |
л |
к |
і |
с |
т |
ь |
|
б |
|
|
р |
|
|
|||||||||
|
|
к |
|
і |
н |
|
||||||||||||||||||
|
н |
а |
т |
р |
і |
й |
|
ф |
е |
н |
о |
л |
ф |
т |
а |
л |
е |
ї |
н |
|
||||
|
|
т |
|
с |
|
|
|
и |
|
|
|
д |
|
|||||||||||
|
о |
и |
|
й |
к |
|||||||||||||||||||
|
р |
о |
з |
ч |
и |
н |
н |
і |
|
о |
с |
н |
о |
в |
и |
|||||||||
|
|
|
|
|
|
|
н |
|
|
|
й |
|||||||||||||
|
|
й |
ц |
|
||||||||||||||||||||
|
|
|
е |
|
||||||||||||||||||||
|
т |
|
||||||||||||||||||||||
Вчитель. Я бачу, що ви маєте непоганий багаж знань про луги і хочу подякувати тим учням, які підготували для нас цю невеличку творчу розминку.
IІІ . Актуалізація опорних знань.
• Бесіда
1. На які групи можна поділити складні речовини? (Оксиди, кислоти, основи,солі).
2.Який клас неорганічних сполук називається основами? (Складні речовини, що містять атом металу та гідроксогрупу).
3. Як дати назву основі за сучасною українською номенклатурою.
Завдання 1. Скласти формули основ за їх назвами: калій гідроксид, магній гідроксид, плюмбум (ІІ) гідроксид, кальцій гідроксид.
Завдання 2. Назвати основи за формулами:
Ba(OH)2 , LiOH, Al(OH)3, Cu(OH)2.
4.Як класифікують основи? (Розчинні (луги) й нерозчинні (малорозчинні))
Завдання 3. Класифікуйте основи із завдання 1,2
• Творчі ігри
Два наступних завдання даються на картках. Це логічно пошукові завдання, мета яких –не тільки закріпити чи перевірити знання, але і, використовуючи хімічні знання, розвинути вміння порівнювати, систематизувати і узагальнювати. Ці завдання учні виконують самостійно (5 хв.), а потім перевіряють методом «Мікрофона». Цікаво, що у цих творчих іграх можна пропонувати завдання не пов’язані з хімією і потребуючі нестандартного підходу до рішення.
• Творча гра «Впізнай нас»
Завдання: у переліку знайди закономірність і поясни її.
а) NaOH, KOH, Ba(OH)2 , Ca(OH)2 ;
б) літій, мідь, кальцій , ртуть;
в) Fе(ОН)2, Сu(ОН)2, Нg(ОН) 2, Zn(ОН)2;
г) SO3, СO2, SO2, SiO2;
д) Н2СО3, H3PO4, Н2SО4, НNO3.
• Творча гра «Виділи мене серед інших двічі »
а) NaOH, LiOH , Fe(OH)3, Ba(OH)2.
б) яблуко, груша, огірок, вишня;
в) НСl, Сu(ОН)2, Н2SО4, Н2S ;
г) Ni(OH)2, N2О5, CО2, Cl2O7 ;
д) лакмус, фенолфталеїн, метилоранж, магній гідроксид.
• Робота з опорною схемою «Хімічні властивості лугів »
Завдання . За опорною схемою записати рівняння реакцій, що демонструють властивості калій гідроксиду.
Нагадую, що завдання є творчим, тому реакції пишемо самостійно.
- 2 КОН + Н 2 SO4 = К2 SO4 + Н2O
- 2 КОН + N2О5 = 2КNО3+ Н2O
- 3 КОН + FеСl3 = Fe(OH)3 + 3КСl
Хімічні властивості розчинних основ (лугів)
+ індикатори Лакмус – синій
![]()
 Фенолфталеїн - малиновий
Фенолфталеїн - малиновий
Метиловий оранжевий - жовтий
![]()
![]() + кислота сіль + Н2O (реакція нейтралізації ) Луги
+ кислота сіль + Н2O (реакція нейтралізації ) Луги
![]()

![]() + кислотний оксид сіль + Н2O (реакція обміну )
+ кислотний оксид сіль + Н2O (реакція обміну )
![]()
![]() + розчинна сіль нерозчинна основа + нова розчинна
+ розчинна сіль нерозчинна основа + нова розчинна
сіль
(реакція обміну )
![]() 2NaОН + СO2 = Na 2СO3 + Н2O
2NaОН + СO2 = Na 2СO3 + Н2O
+
Н2O
![]()
![]()
![]()
Н 2 СO3
IV. Мотивація навчальної діяльності.
Вчитель. Тож продовжуємо вивчати основи, досліджуючи їх властивості і порівняємо вкінці уроку подібні та відмінні властивості розчинних та нерозчинних основ, а також заслухаємо повідомлення про їх використання (Оголошення теми та мети уроку вчителем, запис учнями теми уроку у зошиті).
Відомий французький письменник Оноре́ де Бальза́к говорив « Ключем до будь - якої науки є знак питання » . Я хочу вам також поставити запитання :
- Для чого нам необхідно все це знати?
- Може якось можна обійтися без основ?
(Використання методики незакінчених речень:
"Гадаю, що...."
"Сподіваюся , що мені це … "
"Думаю це знати необхідно, тому що... ")
Вчитель. Діти у нас виникла невеличка проблема : у лабораторії закінчився купрум (ІІ) гідроксид , на прикладі якого ми мали дослідити хімічні властивості нерозчинних основ . Якщо ви мені допоможете підібрати потрібні речовини для його добування , то буду вам дуже вдячна і вивчення матеріалу ми продовжимо.
Робота у парах «Мозковий штурм»
Завдання . Є речовини: мідь, їдкий натр, купрум (ІІ) оксид, вода,
купрум (ІІ) сульфат, хлоридна кислота, купрум (ІІ) нітрат, кальцій гідроксид, які з них можна взяти, щоб добути купрум (ІІ) гідроксид найшвидше ?
Скласти рівняння реакцій.
Відповідь :
1.СuSO4 + 2NaОН = Nа2SO4 + Сu(ОН)2
2. Сu(NO3)2+ 2NaОН = 2 Nа NO3 + Сu(ОН)2
V. Формування вмінь і навичок.
• Колективне складання опорної схеми «Хімічні властивості нерозчинних основ»
Вчитель:
• Згадаймо, яких правил необхідно дотримуватися в хімічній лабораторії (Звертаємося до таблиці «Правила техніки безпеки в кабінеті хімії».) .
• Добудемо купрум (ІІ) гідроксид однією із запропонованих вами реакцій і розділимо його на три пробірки.
• Перевіримо:
- реагує він з кислотами чи ні , про що твердить підручник §33 ст.174 ,
- чи справді він може розкладатися під час нагрівання , як описано у
підручнику §33 ст.176)
Експериментальна робота у парах.
Взаємодія нерозчинних основ з кислотами.
Завдання . Візьміть дві пробірки з купрум (ІІ) гідроксидом. В одну пробірку долийте по краплинах розбавлену хлоридну кислоту, а в другу - розчину сульфатної кислоти. Запишіть свої спостереження та результати досліду до протоколу, вказавши тип хімічної реакції.
Розкладання нерозчинних основ під час нагрівання.
Завдання . Пробірку з купрум (ІІ) гідроксидом , закріпіть дерев’яним тримачем і обережно прогрійте у полум’ї спиртівки. Що спостерігаємо?
Запишемо рівняння реакції і зазначимо її тип:
t0C
Сu(ОН)2 = СuО +Н2О – реакція розкладу.
Бесіда
- Які зміни відбулися з купрум (ІІ) гідроксидом при взаємодії його з кислотами ? (Купрум (ІІ) гідроксид розчиняється у кислотах з утворенням солі і води)
- А яким є результат нагрівання купрум (ІІ) гідроксиду?( Купрум (ІІ) гідроксид розкладається з утворенням чорного осаду купрум (ІІ) оксиду і води )
- Як ви думаєте може ця основа змінювати колір індикаторів та взаємодіяти з кислотними оксидами?
Вчитель.
Складемо опорну схему «Хімічні властивості нерозчинних основ»
![]()
 + кислота сіль + Н2O
+ кислота сіль + Н2O
(реакція нейтралізації )
Нерозчинні
![]() основи
основи
t0C
![]() оксид + Н2O
оксид + Н2O
(реакція розкладу)
• Самостійна робота з перевіркою за допомогою підручника
Завдання . Використовуючи опорні схеми для лугів та нерозчинних основ, порівняйте їх властивості і заповніть таблицю.
|
Властивості |
Луги |
Нерозчинні основи |
|
Відмінні |
|
|
|
|
|
|
|
|
|
|
|
Спільні |
|
|
|
|
|
Вчитель.
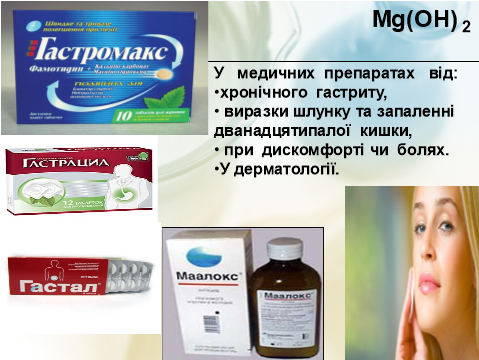
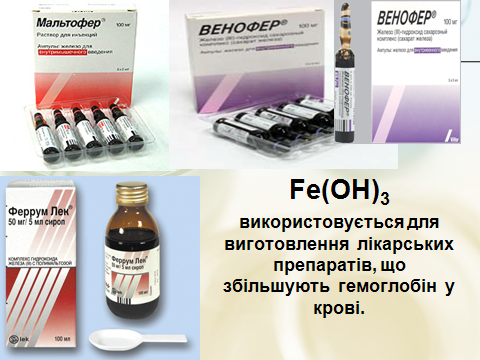
– Де ж використовують онови?
- Робота з підручником §32 (ст..170)
- Повідомлення учнів, коментар до схем, малюнків, презентація.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V. Закріплення вивченого матеріалу
- Керована практика
Завдання 1. Обчисліть кількість речовини води, що утвориться внаслідок нагрівання ферум (ІІІ) гідроксиду масою 5,35г.
|
Дано : m (Fe(OН)3 ) = 5,35г
|
|
|
|
Знайти : ν (Н2О) - ? |
||
|
Розв’язання
0,05 моль t0C x моль 2Fe(OН)3 = Fe 2 O3 + 3 H 2O
2 моль 3моль
Мr (Fe(OН)3)= 107 М (Fe(OН)3)= 107 г/моль m(Fe(OН)3 )= 107г |
||
|
Обчислюємо кількість речовини Fe(OН)3 за формулою ν = m / М |
ν (Fe(OН)3 ) = 5,35 /107 = 0,05 моль
|
|
|
За рівнянням реакції складаємо співвідношення кількостей речовин і обчислюємо кількість речовини води |
ν (Fe(OН)3 ) : ν (Н2О) = 2:3 0,05 моль : x моль = 2 моль : 3 моль x моль =0,05 • 3 / 2 x моль = 0,75 ν (Н2О) = 0,75 моль
|
|
|
Відповідь : ν (Н2О) = 0,75 моль
|
||
Завдання 2. Здійсніть перетворення:
Mg(ОН)2 MgО Mg Cl2 Mg (ОН)2
1) Mg (ОН)2 MgО + Н2O
2) MgО + 2НCl = Mg Cl 2+ Н2O
3) MgCl 2 + 2NаОН = Mg (ОН)2 + 2NаCl
VІ. Домашнє завдання
- Опрацювати §33підручника.
- Виконати завдання ст..180 № 4,8 (достатній рівень),
№11,12 (високий рівень).
- Творче завдання. Підготувати повідомлення про амфотерність .
VІІ. Рефлексія.
- Над чим замислювались протягом уроку?
- Що найбільше сподобалось, запам’яталось?
- Що могло б бути краще ?
VIІІ. Оцінювання роботи учнів .
-
Чудовий матеріал! Дякую


про публікацію авторської розробки
Додати розробку