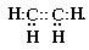Конспект уроку з хімії для 9 класу на тему: "Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів, їхні молекулярні і структурні формули".
|
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ЦЕНТРАЛЬНОУКРАЇНСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ ІМЕНІ ВОЛОДИМИРА ВИННИЧЕНКА
КОНСПЕКТ УРОКУ З хімії у 9 класі з теми: Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів, їхні молекулярні і структурні формули студента-практиканта IV курсу природничо-географічного факультету спеціальність: середня освіта. Хімія Прилипко Алли Олександрівни
|
Тема. Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів, їхні молекулярні і структурні формули. (Слайд 1)
Мета: Сформувати знання учнів про ненасичені вуглеводні на прикладі етилену і ацетилену; розглянути їхні молекулярні і структурні формули; розвивати навички і вміння складати структурні формули етену та етину , виховувати вміння аналізувати, мислити та робити висновки.
Формування ключових компетентностей: - інформаційно – цифрова;
- уміння вчитися впродовж життя;
- екологічна грамотність і здорове життя.
Тип уроку: засвоєння нових знань.
Форми роботи: пояснення вчителя з елементами бесіди з використанням ІКТ, вправа «Коректор», фронтальна бесіда, індивідуальна робота.
Обладнання: ММК, презентація до уроку, підручник О.В.Григорович
Хід уроку
І. Організація класу.
ІІ. Актуалізація опорних знань і практичного досвіду.
- Експрес –перевірка домашнього завдання.
- Вправа «Коректор» (запис на екрані ММК, слайд 2)
- Обов’язковою складовою всіх органічних сполук є Оксиген.
- У молекулі метану йонний тип зв’язку.
- Органічні речовини мають молекулярну кристалічну решітку.
- Більшість органічних речовин розчиняються лише в органічних розчинниках.
- Метан майже вдвічі легший за повітря.
- За звичайних умов метан світло-зелений газ з неприємним запахом.
- Із збільшенням відносної молекулярної маси алканів їхні температури кипіння зростають.
- Насичені вуглеводні складу С5-С17 перебувають за звичайних умов у газоподібному стані.
- Гомолог метану C2H6.
- Метан здатний вступати у реакції заміщення.
- Для алканів не можлива реакція приєднання.
- Галогенування відбувається за рахунок каталізатора Ni.
ІІІ. Мотивація навчальної діяльності.
Вуглеводні містять у своєму складі , як вам уже відомо, Карбон і Гідроген. Якщо речовина має склад СnH2n+2, то це насичений вуглеводень, алкан, а якщо ж загальні формули такі як CnH2n, Сn 2n-2 ,то як можна назвати класи даних речовин? Чому?
ІY. Повідомлення теми, мети та завдань уроку.
Y. Сприймання та усвідомлення нового навчального матеріалу.
(Пояснення вчителем нового матеріалу з використанням ММП)
- Ненасичені вуглеводні: алкени та алкіни. (Слайд 3)
Алкени (або етиленові вуглеводні) – вуглеводні із загальною формулою СnН2n, в молекулах яких між атомами Карбону є один подвійний зв’язок.
Щоб дати назву алкенам, у назві відповідного алкану суфікс -ан замінюють на –ен.
Алкіни (або ацетиленові вуглеводні) – вуглеводні із загальною формулою СnН2n-2, в молекулах яких між атомами Карбону є один потрійний зв’язок.
Щоб дати назву алкінам, у назві відповідного алкану суфікс -ан замінюють на –ин або –ін. Наприклад :
|
Алкани СnН2n +2 |
Алкени СnН2n |
Алкіни СnН2n ─2 |
|
СН4 метан С2Н6 етан . |
─ С2Н4 етен (етилен) |
─ С2Н2 етин (ацетилен) |
- Будова молекул етилену і ацетилену (Слайд 4)
|
Ознака |
Етилен (алкен) |
Ацетилен (алкін) |
|
Особливості будови |
Має 1 подвійний зв’язок -С=С- |
Має 1 потрійний зв’язок -С≡ С- |
|
Молекулярна формула |
С2Н4 |
С2Н2 |
|
Електронна формула |
|
Н:С:::С:Н
|
|
Структурна формула |
Н Н |
Н – С ≡ С - Н |
- Фізичні властивості етилену і ацетилену (Слайд 5, підручник,с.140 )
- Гази – прозорі. Безбарвні
- Майже без запаху (С2Н4 слабкий солодкуватий запах)
- Малорозчинні у воді
- Легші за повітря : М(С2Н4) = 28 г/моль
М (С2Н2) = 26 г/моль
М(повітря) = 29 г/моль
- Хімічні властивості етилену та ацетилену. Реакції приєднання
- Приєднання водню ( гідрування, гідрогенізація) (Слайд 5)
К
СН2 = СН2 + Н2 → СН3 – СН3
етен етан
К
СН ≡ СН + Н2 → СН2 = СН2
ацетилен етен
К
СН ≡ СН + 2 Н2 → СН3 – СН3
- Приєднання галогенів (галогенування)
СН2 = СН2 + Br2 → СН2Br – СН2Br
етен
СН ≡ СН + Br2 → СН2 Br = СН2 Br
ацетилен
СН ≡ СН + 2Br2→ СНBr2 – СНBr2
Якісна реакція на кратний зв’язок. Бурий колір брому знебарвлюється.
YІ. Узагальнення та систематизація знань.
6.1 Фронтальна бесіда за запитаннями із вивченої теми.
6.2 «І сам біля дошки» ( Слайд 6) (Двоє учнів працюють біля дошки)
- Визначте відносну молекулярну масу етиленового вуглеводню, знаючи, що 14 г його приєднують 32 г брому. Про який вуглеводень йдеться?
- Який об’єм водню необхідний для добування 268,8 л етану при реакції гідрування ацетилену?
6.3 Індивідуальна робота «Хто швидше?» (Слайд 7)
- Скільки грамів бромної води знебарвить етен об’ємом 4,48 л?
- Який об’єм водню можуть приєднати: а) 1,12 мл етену; б) 52 г етину.
- Вкажіть, яку масу хлору може приєднати етин кількістю речовини 0,01 моль.
VII. Підведення підсумків уроку
Домашнє завдання. (Слайд 8)
- §27 опрацювати
- Зробити задачу в зошиті ст.160 №318
- Написати схему застосування етену


про публікацію авторської розробки
Додати розробку