конспект уроку з хімії у 8 класі "Узагальнення знань з теми „ Періодичний закон і Періодична система хімічних елементів Д.І. Менделєєва. Будова атома”
[Введите текст]
8 клас. Урок № 17. Тема: Узагальнення знань з теми „ Періодичний закон і Періодична система хімічних елементів Д.І. Менделєєва. Будова атома”
Мета:
Навчальна: повторити і узагальнити основні поняття з теми, закріпити вміння за електронною формулою атома визначати хімічний символ елементу, положення його в ПСХЕ, закріпити навички розв’язування вправ.
Розвиваюча: розвити пізнавальну активність та логічне мислення, вміння на доступному рівні виконувати завдання творчого характеру ; розвивати вміння використовувати набуті знання на практиці; стимулювати пізнавальну активність учнів, інтерес до предмету.
Виховна: виховувати наполегливість та працелюбність, здатність обирати оптимальні рішення співпраці в групі, взаємоповагу та взаєморозуміння.
Тип уроку: урок узагальнення і систематизація знань .
Обладнання та матеріали: мультимедійна презентація, портрет Д.І.Менделєєва, періодична система хімічних елементів Д.І. Менделєєва, к убик, картки із завданнями .
Хід уроку:
І. Мотивація навчальної діяльності
На цьому уроці ми з вами повторимо все, що знаємо про будову атома, Періодичний закон і періодичну систему хімічних елементів Д.І.Менделєєва, також удосконалимо вміння складати електронні формули, визначати хімічний елемент за його характеристиками, розв'язувати вправи. На наступному уроці виконуємо контрольну роботу, тому потрібно з’ясувати все, що не зрозуміли, пропустили,або забули.
ІІ. Актуалізація опорних знань.
Повторення базових питань з теми (у формі гри з кубиком)
- Як побудований атом?
- Які частинки утворюють ядро?
- Що ви знаєте про електрон?
- Як побудована періодична система?
- Що називається періодом?
- Які періоди бувають?
- Що називається групою?
- Як поділяються елементи в кожній групі?
- На що в будові атома вказує порядковий номер?
- На що в будові атома вказує номер періоду?
- На що в будові атома вказує номер групи ?
- Що називають ізотопами? Із наведеного переліку виберіть ізотопи:
168О, 146С, 147N, 126C, 157N
- Як і чому змінюються хімічні властивості елементів в межах одного періоду?
- Як і чому змінюються хімічні властивості елементів в межах однієї групи, підгрупи?
ІІІ. Виконання тренувальних вправ (питання проектуються на екрані)
- Укажіть протонне число елемента, розміщеного в Періодичній системі:
|
І |
Б |
|
ІІ |
А |
|
ІІІ |
В |
|
ІV |
Г |
 І варіант у 2 періоді, ІІІ групі
І варіант у 2 періоді, ІІІ групі
ІІ варіант у 4 періоді, VІ групі,
головній підгрупі
ІІІ варіант у 5 періоді, І групі,
головній підгрупі
ІV варіант у 3 періоді, ІV групі,
- Укажіть протонне число елемента, який розміщується:
|
І |
А |
|
ІІ |
Г |
|
ІІІ |
В |
|
ІV |
Б |
 І варіант у 2 періоді, формула вищого
І варіант у 2 періоді, формула вищого
оксиду ЕО
ІІ варіант у 3 періоді, формула летко
сполуки з Гідрогеном ЕН4
ІІІ варіант у 2 періоді, формула вищого
оксиду Е2О3
ІV варіант у 3 періоді, формула леткої
сполуки з Гідрогеном Н2Е
- Укажіть елемент за такою характеристикою:
|
І |
N |
|
ІІ |
P |
|
ІІІ |
Li |
|
ІV |
Al |
І варіант розміщується у 2 періоді, гідрат його
вищого оксиду НЕО3
ІІ варіант розміщується у 3 періоді, гідрат його
вищого оксиду Н3ЕО4
ІІІ варіант розміщується у 2 періоді, гідрат його
вищого оксиду ЕОН
ІV варіант розміщується у 3 періоді, гідрат його
вищого оксиду Е(ОН)3
- Визначте протонне число елемента Е та назвіть його:
|
І |
26 |
|
ІІ |
43 |
|
ІІІ |
88 |
|
ІV |
85 |
І варіант 56Е, якщо в ядрі його атома міститься 30
нейтронів
ІІ варіант 99Е, якщо в ядрі його атома міститься 56
нейтронів
ІІІ варіант 226Е, якщо в ядрі його атома міститься
138 нейтронів
ІV варіант 211Е, якщо в ядрі його атома міститься
126 нейтронів
І. 56-30 = 26; ІІ. 99-56 =43; ІІІ. 226-138 = 88; ІV.211- 126=85
5. Розмістіть елементи в порядку зростання їх атомних радіусів:
І варіант С, О, Ве, Li ( О, С , Ве , Li)
ІІ варіант Na, Cs, К, Fr ( Na,K, Cs, Fr)
ІІІ варіант N, Li, O, F ( F, O, N, Li)
6. У якому рядку елементи розташовані в порядку збільшення їх атомних радіусів?
А Барій, Стронцій, Кальцій
Б Магній, Алюміній, Силіцій
В Берілій, Магній, Кальцій
Г Калій, Кальцій, Скандій
7. Атом якого елемента має електронну конфігурацію
|
I |
B |
|
II |
A |
|
III |
Г |
|
IV |
Б |
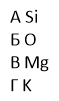 І варіант 1S22S22P63S2
І варіант 1S22S22P63S2
ІІ варіант 1S22S22P63S23P2
ІІІ варіант 1S22S22P63S23P64S1
ІV варіант 1S22S22P4
8. Установіть відповідність між хімічними елементами і будовою зовнішніх енергетичних рівнів їхніх атомів
І варіант
|
1 |
B |
|
2 |
Г |
|
3 |
Б |
|
4 |
А |
1 О А … 3S2
2 Na Б … 2S22P6
3 Ne В … 2S22P4
|
1 |
B |
|
2 |
А |
|
3 |
Б |
|
4 |
Г |
4 Mg Г … 3S1
ІІ варіант
1 Si А … 4S2
2 Ca Б … 3S23P5
3 Cl В … 3S23P2
4 B Г … 2S22P1
9. Розташуйте елементи в порядку збільшення числа неспарених електронів на завнішньому енергетичному рівні
|
1 |
АВБ (1,2,3) |
|
2 |
АБВ (1,2, 3) |
|
3 |
БАВ (1,2, 3) |
|
4 |
ВГБ (1,2, 3) |

10. Схарактеризуйте зазначений хімічний елемент:
Калій, Фосфор, Цинк, Силіцій
- його місце у ПСХЕ,
- склад атома,
- будову електронної оболонки,
- склад і властивості вищого оксиду й відповідного гідрату оксиду
11. Укажіть, який з елементів у кожній парі має більш виражені неметалічний або металічний характер:
І варіант а) Na чи Rb; б) P чи S а) Rb; б) S
ІІ варіант а) Mg чи Sr; б) C чи O а) Sr; б) O
ІІІ варіант а) Li чи Be; б) Cl чи Br а) Li; б) Cl
ІV варіант а) Mg чи Al; б) S чи O а) Mg; б) O
12. Напишіть формулу леткої сполуки з Гідрогеном елемента №16.
- Який вищий оксид утворює цей елемент?
- До яких оксидів відноситься цей оксид?
H2S, SO3 кислотний оксид
13. Назвіть елемент за такими даними:
№1 Атом елемента має на 7 електронів більше, ніж йон магнію. Назвіть елемент.
Mg2+ має 12 – 2 =10 електронів
R має 10 +7 = 17 електронів
Кількість електронів в атомі відповідає порядковому номеру елемента.
Це Cl (Хлор)
№2. Атом елемента має на 2 електрони більше, ніж йон літію. Назвіть елемент.
Li+ має 3 – 1 =2 електрона
R має 2 +2 = 4 електрона
Кількість електронів в атомі відповідає порядковому номеру елемента.
Це Ве(Берилій))
№3 Атом елемента має на 7 електронів більше, ніж йон натрію. Назвіть елемент.
Na+ має 11 – 1 =10 електронів
R має 10 +7 = 17 електронів
Кількість електронів в атомі відповідає порядковому номеру елемента.
Це Cl (Хлор)
14. Назвіть елемент за такими даними:
![]() №1. Назвати елемент за такими даними: знаходиться в VІ групі, відносна молекулярна маса водневої сполуки 34.
№1. Назвати елемент за такими даними: знаходиться в VІ групі, відносна молекулярна маса водневої сполуки 34.
Дано: Мr(RН2) = х + 2
Мr(RН2) =34 х+2= 34
![]() R - ? х = 32
R - ? х = 32
Аr(S) = 32 Відповідь: S - Сульфур
№2. Назвати елемент за такими даними: знаходиться в VІ групі, відносна молекулярна маса кислоти 145.
|
Мr(Н2RO4) =145
R - ? |
Мr(Н2RO4) = 1∙2 + х + 16∙4 = х + 66 х + 66 = 145 х = 79 Аr(Sе) = 79 Відповідь: Sе - Селен |
№3. Назвати елемент за такими даними: знаходиться в І групі, відносна молекулярна маса вищого оксиду дорівнює 62.
![]() Дано:
Дано:
|
R - ? |
Мr(R2 O) = 2х + 16 2х+16= 62 2х = 46 Х = 23 Аr(Na) = 23 Відповідь: Na - Натрій |
- №4. Назвати елемент за такими даними: знаходиться в V групі, відносна молекулярна маса вищого оксиду 108.
|
R - ? |
Мr(R2 O5) = 2х + 16∙5 2х+80= 108 2х = 28 Х = 14 Аr(N) = 14 Відповідь: N - Нітроген |
- Назвіть елемент за такими даними:
Елемент знаходиться в ІV групі , масова частка Оксигену у вищому оксиді дорівнює 21,23%. Який це елемент?
|
W(О) = 21,23%
Е - ?
|
nAr(О)
Mr (ЕО2)
2∙16
х +32 0,2123х + 6,6 7936 = 32
х = 119 Ar (Sn) = 119 Відповідь: Sn |
- Елемент, вищий оксид якого має склад RO2, утворює летку сполуку з Гідрогеном, що містить 12,5% Гідрогену. Який це елемент?
|
RO2 W(Н) = 12,5%
R - ?
|
Вищий оксид має склад RO2, летка сполука з Гідрогеном RH4 n Ar (H)
Mr (RH4)
0,125 = 0,125х +0,5 = 4 х = 28 Відповідь: Si (Силіцій) |
ІV. Підведення підсумку уроку
V. Домашнє завдання: повторити §1–12, приготуватися до контрольної роботи.


про публікацію авторської розробки
Додати розробку
