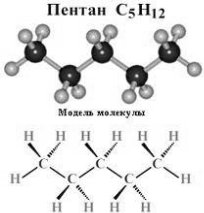
Конспекти лекцій 10 клас, рівень стандарту
ВСТУП
Пара 1.
Тема пари: Повторення початкових понять про органічні речовини
Мета пари:
навчальна: повторити склад, будову, особливості вуглеводнів, розглянутих під час вивчення хімії 9 класу; ознайомити учнів з принципами їх класифікації
розвиваюча: розвивати логічне мислення, вміння аналізувати, порівнювати, робити висновки
виховна: виховувати цілеспрямованість, самостійність
Очікувані результати навчання
Знаннєвий компонент
називає десять членів гомологічного ряду алканів
розуміє належність речовин за їхнім складом до вуглеводнів
Діяльнісний компонент
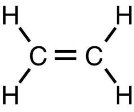
складає молекулярні, структурні і напівструктурні формули метану та дев’яти його гомологів, етену, етину; рівняння реакцій: горіння (повного окиснення) вуглеводнів; заміщення для метану (хлорування); приєднання для етену й етину (галогенування, гідрування).
Ціннісний компонент
обґрунтовує застосування метану, етану, етену, етину; роль органічних сполук у живій природі;
оцінює вплив на здоров’я і довкілля окремих органічних речовин;
висловлює судження щодо необхідності знань про органічні сполуки для їх безпечного застосування.
Тип пари: урок повторення і систематизації знань.
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: моделі молекул вуглеводнів, набір для складання кулестержневих моделей молекул.
Хід пари
- Організаційний етап
- Актуалізація опорних знань
Бесіда:

сполук?
![]()
Чому органічну хімію називають «хімією сполук Карбону»?
![]() Чому атоми Карбону можуть утворювати хімічні зв’язки один з одним?
Чому атоми Карбону можуть утворювати хімічні зв’язки один з одним?
![]() Які ще хімічні елементи лежать в основі будови органічних
Які ще хімічні елементи лежать в основі будови органічних
Як ви гадаєте, з чим це пов’язано?
- Повідомлення теми пари
- Узагальнення і систематизація знань
Бесіда:
- Чому органічних сполук більше, ніж неорганічних?
- Яке значення органічних речовин на нашій планеті?
- Які органічні речовини називаються вуглеводнями?
Робота в 4 групах (кожна група працює з певною речовиною)
Завдання 1. Зобразити молекулярну та структурну формули речовин
Завдання 2. Обчислити відносні молекулярні маси та масові частки елементів у даних речовинах, порівняти їх.
Завдання 3. Спрогнозувати фізичні властивості речовини за планом:
- агрегатний стан,
- розчинність у воді,
- легший чи важчий від повітря,
- приблизні температури кипіння
Завдання 4. Скласти рівняння реакцій:
- Горіння 2.Хлорування 3.Гідрування 4.Розкладу 5. Дегідрування
Результатом роботи в групах є заповнення таблиці
«Основні вуглеводні»
|
|
метан |
етан |
етен |
етин |
|
Склад (молекулярна та структурна формули) |
|
|
|
|
|
Відносна молекулярна маса |
|
|
|
|
|
Масові частки елементів |
|
|
|
|
|
Фізичні властивості |
|
|
|
|
|
Хімічні властивості |
|
|
|
|
|
Застосування |
|
|
|
|
«Хімічний практикум» (робота в парах)
І. Які з реакцій можливі? Закінчіть їх, назвіть тип реакції та її продукти:
C2H6 + H2 C2H2 + O2 C2H4 +Cl2
C2H2 + HBr CH4+ HBr
C2H2 + H2
ІІІ. Задача. Який об’єм кисню потрібний для спалювання 8 л етену? Який об’єм вуглекислого газу утвориться (24 л, 16 л)?
Самостійна тренувальна робота за варіантами (додаток 1)
6. Підсумки пари, домашнє завдання
Вивчити матеріал пари. Повторити основні класи органічних сполук.
Додаток 1.
Варіант 1
- Всі органічні сполуки містять:
- Карбон і Гідроген;
- Оксиген і Гідроген;
- Нітроген і Сульфур;
- Карбон і Фосфор
- Метан застосовують:
- як паливо,
- як ліки;
- для зварювання металів;
- як сировину для одержання інших органічних речовин
- До якого типу реакцій відноситься реакція хлору з метаном?
а) обміну; в) заміщення;
- Вуглеводні – це …. 5.Закінчіть рівняння реакцій:
г)розкладу.
б) приєднання;
a) C2H6 + Cl2 b)C2H2 + 2HBr c) C3H8 + O2
- Здійсніть перетворення: C2H6 – C2H2 – C2H4 – C2H5Br
- Який об’єм кисню потрібний для спалювання 4 л пропану (н.у.)? Який об’єм вуглекислого газу утвориться?
Варіант 2
- Яка валентність Карбону в органічних речовинах: А) 1; Б) 2; В) 3; Г) 4.
- Молекула метану має форму:
- піраміди
- трикутника,
- октаедра,
- тетраедра
- До якого типу реакцій належить відноситься реакція етилену з бромом ?
- обміну
- заміщення;
- приєднання
- розкладу.
Пара 2
Тема пари: Склад, властивості, застосування окремих представників вуглеводнів (метан, етен, гліцерол, етин) оксигеновмісні (метанол, етанол, гліцерол, етанова кислота) нітрогеновмісних (аміноетанова кислота) органічних речовин
Мета пари:
навчальна: узагальнити і систематизувати знання про властивості найважливіших оксигеновмісних органічних речовин на основі складу їх молекул та застосування – на основі властивостей, продовжувати формувати вміння складати рівняння хімічних реакцій та розв’язувати задачі на прикладі органічних речовин;
розвиваюча: розвивати вміння аналізувати, порівнювати, робити висновки; виховна: виховувати цілеспрямованість, самостійність, наполегливість Очікувані результати навчання
Знаннєвий компонент
учень розуміє належність речовин за їхнім складом до оксигеновмісних, нітрогеновмісних сполук
Діяльнісний компонент
учень складає молекулярні, структурні і напівструктурні формули метанолу, етанолу, гліцеролу, етанової та аміноетанової кислот;
рівняння реакцій: що описують хімічні властивості етанової кислоти (взаємодія з індикаторами, металами, лугами, солями з точки зору електролітичної дисоціації).
Ціннісний компонент
учень обґрунтовує застосування метанолу, етанолу, гліцеролу, етанової кислоти; роль органічних сполук у живій природі;
оцінює вплив на здоров’я і довкілля окремих органічних речовин;
висловлює судження щодо необхідності знань про органічні сполуки для їх безпечного застосування
Тип пари: урок формування вмінь та навичок;
Форми роботи: фронтальна робота, робота в групах, робота в парах, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: моделі молекул вуглеводнів, набір для складання кулестержневих моделей молекул, зразки оксигеновмісних органічних речовин, картки з завданнями.
Хід пари
- Організаційний етап
- Мотивація навчальної діяльності
Бліц «Впізнай речовину»
- Дуже отруйний спирт, 15 мл якого викликають сліпоту (метанол)
- Мономер білків (амінокислота)
- Застосовується у кремах для зволоження та пом’якшення шкіри
(гліцерол)
- Є незамінним продуктом при консервуванні овочів (оцтова кислота)
- Утворюється при бродінні глюкози (етанол)
Що спільного між цими речовинами? (є оксигеновмісними органічними сполуками)
Ми сьогодні пригадаємо про ці речовини те, що було раніше вивчене, і дізнаємося дещо нове.
- Повідомлення теми пари
- Узагальнення і систематизація знань
![]() Бесіда:
Бесіда:
- Як ви гадаєте, від чого залежать властивості органічних речовин?
- Що спільного у хімічних властивостях більшості органічних
речовин?
Розминка: «Термінологічний ланцюжок»
Пригадайте значення термінів:
- Спирт (одно- та багатоатомний)
- Органічна кислота
- Функціональна група
- Аміногрупа
- Амфотерність
Робота в парах з таблицею
Завдання 1. Зобразити молекулярну та структурну формули речовин
Завдання 2. Обчислити відносні молекулярні маси та масові частки елементів у даних речовинах, порівняти їх.
Завдання 3. Спрогнозувати фізичні властивості речовини за планом:
- агрегатний стан,
- розчинність у воді,
- легший чи важчий від води,
- приблизні температури кипіння
Завдання 4. Скласти рівняння реакцій:
- горіння (крім аміноетанової кислоти)
- взаємодії з натрієм
- реакції з натрій гідроксидом (для кислот)
|
|
метанол |
етанол |
гліцерол |
етанова кислота |
аміноетанова кислота |
|
Склад (молекулярна та структурна формула) |
|
|
|
|
|
|
Відносна молекулярна маса |
|
|
|
|
|
|
Масові частки елементів |
|
|
|
|
|
|
Фізичні властивості |
|
|
|
|
|
|
Хімічні властивості |
|
|
|
|
|
|
Застосування |
|
|
|
|
|
Завдання. «Хімічний практикум»
У пробірках без етикеток містяться наступні органічні сполуки:
- етиловий спирт та оцтова кислота
- розчин сахарози та розчин крохмалю Яким чином можна їх відрізнити?
Завдання . «Задача»
- Обчисліть, який об’єм кисню (н.у.) потрібен для спалювання: А) 23 г етанолу (33,6 л)
Б) 4 моль метанолу (134,4 л)
- Яка маса натрій гідроксиду потрібна для нейтралізації:
А) 60 г розчину оцтової кислоти з масовою часткою кислоти 10% (4 г)
Б) 240 г суміші аміноетанової кислоти та етанової кислоти, у якій масова частка етанової кислоти 37,5%? (140 г)
5. Підсумки пари і домашнє завдання
Вивчити матеріал пари.
Задача. Яка маса натрій ацетату утвориться, якщо на 150 г розчину оцтової кислоти (Wкислоти =20%) подіяли натрій карбонатом? (41 г)
Тема 1. Теорія будови органічних сполук
Пара 3
Тема пари: Теорія будови органічних сполук. Залежність властивостей речовин від складу і хімічної будови молекул. Поняття про явище ізомерії та ізомери. Ковалентні КАРбон-карбонові зв’язки у молекулах органічних сполук: простий, подвійний, потрійний.
Мета пари:
навчальна: ознайомити учнів з основними положеннями теорії хімічної будови органічних сполук О. Бутлерова, охарактеризувати сутність сучасної теорії будови органічних сполук, її значення; сформувати в учнів поняття про ізомерію; розглянути залежність властивостей речовин від складу і хімічної будови молекул на прикладі ізомерів, сформувати вміння складати структурні та напівструктурні формули органічних речовин; сприяти формуванню судження про роль теорії в системі наукових знань;
розвиваюча: розвивати вміння порівнювати, робити висновки;
виховна: виховувати цілеспрямованість, розширювати світогляд учнів.
Очікувані результати навчання
Знаннєвий компонент
учень пояснює суть явища ізомерії; залежність властивостей речовин від складу і будови їхніх молекул на основі положень теорії будови органічних сполук.
Діяльнісний компонент
учень характеризує суть теорії будови органічних сполук
Ціннісний компонент
учень висловлює судження про значення теорії будови органічних сполук для розвитку органічної хімії;
Тип пари: урок засвоєння нових знань;
Форми роботи: фронтальна робота, «Мікрофон», самостійна робота учнів
Методи навчання: словесні (бесіда, пояснення), демонстрація, практичні (виконання вправ), міні-гра «Вгадай мене», «Бліц-фініш»)
Обладнання: моделі молекул органічних речовин, зразки органічних речовин, набір для складання кулестержневих моделей молекул.
Хід пари
- Організаційний етап
- Актуалізація опорних знань
![]() Бесіда:
Бесіда:
![]()
![]() речовини? речовин?
речовини? речовин?
Яку інформацію ми можемо отримати, знаючи формулу Пригадайте, які особливості складу і будови органічних
Від чого залежать властивості органічних речовин?
- Мотивація навчальної діяльності
Перед вами невідома речовина органічного походження. Спробуйте її ідентифікувати за такими ознаками (хто швидше здогадається):
- рідина добре розчинна у воді
- має специфічний різкий запах
- забарвлює лакмус у рожевий колір
- активно реагує з основами, солями, особливо карбонатами (содою). Яким чином ви визначили, що перед вами за речовина?
Сьогодні ми з’ясуємо, яким чином пов’язані склад та властивості речовин.
- Повідомлення теми пари
- Вивчення нового матеріалу
Багато вчених-хіміків вивчали органічні речовини. Але головною метою був пошук шляхів синтезу нових речовин. Для цього була необхідна теорія, що до- зволила б пояснити вже відомі факти й нові відкриття. Такою теорією в органічній хімії є теорія хімічної будови, основні положення якої сформулював у своїх наукових працях 0. М. Бутлеров. Створення теорії хімічної будови органічних сполук О. М. Бутлеровим у 60-х роках XIX ст. було найвидатнішою подією в історії розвитку органічної хімії.
19 вересня 1861 року на з’їзді німецьких натуралістів і лікарів О. М. Бутлеров доповідав про нові теорії в органічній хімії. Він висунув нове поняття —
«структура», що відбивало послідовність будови атомів у молекулі. Так народилася структурна теорія, або теорія хімічної будови.
Суть теорії будови можна звести до таких положень:
- Атоми у молекулах сполучені один з одним у певній послідовності відповідно до їх валентності
В органічних сполуках органогенні елементи мають сталу валентність – (Карбон –IV, Гідроген – І, Оксиген – ІІ, Нітроген – ІІІ)
- Властивості речовин залежать не лише від того, які атоми і в якій кількості входять до складу молекул, а й від того, в якому порядку вони сполучені між собою, тобто від хімічної будови молекул.
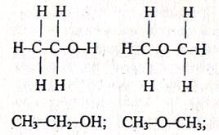
Наприклад, дві різні речовини етанол і диметиловий етер мають одну і ту ж саму молекулярну формулу С2Н6О, але послідовність сполучення їх атомів різна, що визначає відмінні властивості:
СН3-СН2-ОН етанол добре розчинний у воді, СН3-O-СН3 - диметиловий етер не розчинний
- Знаючи властивості органічних речовин, можна встановити їх хімічну будову і навпаки за будовою - спрогнозувати властивості .
ЗАВДАННЯ
полум’ям
Передбачте, до якого класу органічних речовин належать:
 вуглеводень, який знебарвлює бромну воду
вуглеводень, який знебарвлює бромну воду
летка речовина, що добре розчиняється у воді і горить блакитним
Спрогнозуйте, які фізичні та хімічні властивості будуть у:
- бутадієну СН2 = СН – СН = СН2
- масляної кислоти C3H7COOH
- Атоми або групи атомів, які утворюють молекулу, взаємно впливають один на одного, що й зумовлює реакційну здатність молекули.
СН4 – метан – хімічно інертний насичений вуглеводень CH3ОН – спирт метанол, хімічно активна сполука.
Гідроксогрупа підвищує активність вуглеводневого залишку, водночас вуглеводневий залишок послаблює основні властивості гідроксогрупи, тому спирт не є основою.
Таким чином, теорія хімічної будови органічних сполук — це вчення про взаємний зв’язок, розміщення і взаємний вплив атомів у молекулах органічних речовин.
З виникненням теорії хімічної будови органічна хімія вийшла із лабіринту типових формул. Завдяки цій теорії були знайдені шляхи до пізнання внутрішньої будови молекул, з'явилась теоретична основа для розуміння хімічних процесів. Теорія хімічної будови дозволила класифікувати не тільки весь нагромаджений на той час, але й новий експериментальний матеріал. Хіміки, користуючись цією теорією, могли передбачити як нові шляхи синтезу органічних речовин, так і можливу кількість органічних сполук певного складу.
О. М. Бутлеров увів уявлення про хімічну будову — точно визначений порядок розміщення атомів у молекулі. Він показав, що будову молекули можна з’ясувати експериментально, вивчаючи хімічні перетворення речовин.
Кожна речовина має лише одну формулу, яка відображає послідовність сполучення атомів у молекулі, порядок їх взаємозв’язку і взаємного вплину.
Згідно з теорією О. М. Бутлерова сполучення атомів у молекулі відбувається відповідно до їх валентності.
Якщо у сполуці два або більше атомів Карбону , то вони можуть сполучатися між собою у молекулі по-різному: утворювати відкриті ланцюги або замкнуті кільця (цикли). При цьому важливо, щоб зберігалась чотиривалентність атома Карбону: Хімічні формули, у яких відображений порядок сполучення атомів у молекулах, називаються структурними.
Структурні формули можна зображувати і в скороченій формі, зазначаючи лише зв’язки між атомами Карбону.
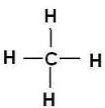
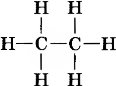
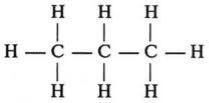
СН4 СН3— СН3 СН3—СН2—СН3
 До створення теорії будови вважалося, що властивості сполук визначаються тільки їх складом. Цим твердженням неможливо було пояснити явище ізомерії — прояв різних властивостей речовин, що мають
До створення теорії будови вважалося, що властивості сполук визначаються тільки їх складом. Цим твердженням неможливо було пояснити явище ізомерії — прояв різних властивостей речовин, що мають
однаковий склад. О. М. Бутлеров довів, що властивості речовин залежать від хімічної будови їх молекул. Так, склад етилового спирту і диметилового ефіру визначається однаковою емпіричною формулою С2Н6О. Проте властивості їх різні: етиловий спирт — рідина з температурою кипіння 78 °С, а диметиловий етер — газ, що
зріджується при температурі —23 °С. Це можна пояснити лише відмінністю у будові, тобто послідовностю сполучення атомів у молекулі. Ці речовини є міжкласовими ізомерами.
Ізомери – це речовини, які мають однаковий якісний і кількісний склад молекул, але різну будову, і тому різні фізичні та хімічні властивості.
 Різною будовою молекул, у чому ми пересвідчимося пізніше, пояснюються і різні хімічні властивості цих речовин.
Різною будовою молекул, у чому ми пересвідчимося пізніше, пояснюються і різні хімічні властивості цих речовин.
Ізомерія може бути кількох видів:
- структурна ізомерія карбонового ланцюга (кількість ізомерів зростає із збільшенням числа атомів Карбону:
бутан С4Н10 має два їзомери, вуглеводень С10Н22 — 75
-
за місцем кратного (подвійного, потрійного) зв’язку - за місцем функціональної групи
![]()

- міжкласова ізомерія
- просторова ізомерія

- Закріплення вивченого матеріалу
![]() «Мікрофон»
«Мікрофон»
Як би ви продовжили твердження:
Відкриття О.Бутлерова в органічній хімії можна порівняти
з …
«Екстрасенси»
- Невідомі речовини мають склад: С3Н6, С3Н8О, С4Н8О2.
Запропонуйте можливі їх структурні формули, вкажіть клас речовин, до якого
вони належать. Спробуйте передбачити властивості даних речовин.
-
 Чи можливе існування ізомерів для наступних речовин: С2Н6, С3Н8, С5Н10, СН3-СН=СН2, СН2=СН—СН2—СН3?
Чи можливе існування ізомерів для наступних речовин: С2Н6, С3Н8, С5Н10, СН3-СН=СН2, СН2=СН—СН2—СН3?
- Які з речовин будуть ізомерами?
 можливих ізомерів для речовин (робота в групах): 1 група - С5Н12
можливих ізомерів для речовин (робота в групах): 1 група - С5Н12
- група - С5Н10
- група - С4Н9ОН
«Бліц – фініш»
Так-ні
- Складіть формули
- Більшість органічних сполук тверді, тугоплавкі речовини.
- Органічні сполуки легкоплавкі, леткі
- Органічні речовини здебільшого не розчиняються у воді Закінчіть твердження:
- Основою органічних сполук є …
- До органогенних елементів належать….
- Валентність Карбону в органічних сполуках становить …
- Теорію будови органічних сполук сформулював ….
- Ізомери – це речовини з ….
- При згорянні органічних речовин утворюються ….
- Властивості органічних речовин залежать від …
- Знаючи будову речовини можна передбачити її ….
- Спробуйте порівняти сполуки С2Н6 і С3Н6. Що спільного і відмінного?
Пара 4
Тема пари: Класифікація органічних сполук
Мета уроку:
навчальна: розширити і поглибити знання учнів про класи вуглеводнів, ознайомити учнів з основними характеристиками ковалентного зв’язку, порівняти
за цими характеристиками одинарний, подвійний та потрійний зв'язок, показати взаємозв’язок будови та властивостей вуглеводнів;
розвиваюча: розвивати вміння порівнювати речовини, робити висновки про їх властивості на основі будови і навпаки, формувати навички самостійної роботи;
виховна: виховувати критичність мислення, цілеспрямованість.
Очікувані результати навчання
Знаннєвий компонент
учень наводить приклади органічних сполук із простими, подвійними, потрійними карбон-карбоновими зв’язками.
Діяльнісний компонент
учень розрізняє органічні сполуки за якісним складом: вуглеводні, оксигено- і нітрогеновмісні речовини; простий, подвійний, потрійний карбон-карбонові зв’язки.
Ціннісний компонент
Студент усвідомлює необхідність знання властивостей речовини для встановлення її впливу на власне здоров’я і довкілля;
учень робить висновки про багатоманітність органічних сполук на основі теорії хімічної будови
Тип пари: пара засвоєння нових знань
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: моделі молекул вуглеводнів різних класів (метану, етену, етину, бензену).
Хід пари
- Організаційний етап
- Актуалізація опорних знань
Бесіда:

![]() Які органічні речовини називають вуглеводнями? Назвіть їх гомологічні ряди?
Які органічні речовини називають вуглеводнями? Назвіть їх гомологічні ряди?
В чому полягає відмінність між ними? Які зв’язки характерні для вуглеводнів?
- Повідомлення теми уроку
- Вивчення нового матеріалу
Згідно з сучасними уявленнями усі особливості органічних сполук пов’язані з властивостями елемента Карбону: у нього на зовнішньому шарі 4 електрони, тому він не схильний активно приєднувати чи віддавати електрони, займає в цьому проміжне положення між металами та неметалами, здатний утворювати стійкі сполуки з ковалентним зв’язком.
Ковалентний зв'язок характеризується такими параметрами:
- кратністю – визначається числом спільних електронних пар між атомами Карбону, буває одинарний, подвійний, потрійний
- енергією – вказує на його міцність (кДж/моль)
- довжиною – визначається відстанню між центрами ядер атомів (1 нм)
- полярністю – зумовлена зміщенням електронної густини до більш електронегативного атома (δ- і δ+)
- просторовою напрямленістю – взаємне розташування зв’язків, кут між ними.
Особливості зв’язків
|
Характеристики зв’язку |
Одинарний |
Подвійний |
Потрійний |
|
Довжина Енергія Кут |
0,154 нм 343 кДж/моль 109º |
0,134 нм 611 кДж/моль 120 º |
0,120 нм 837 кДж/моль 180 º |
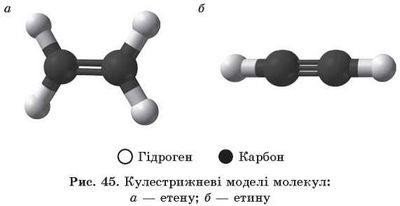
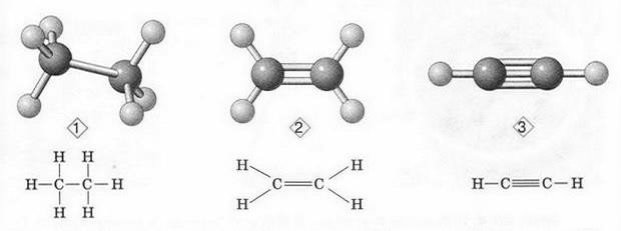
Кулестержневі моделі молекул та їх напівструктурні формули
1 - етану 2 - етену 3 - етину
На сьогодні існує близько 20 млн органічних сполук, хоча ще 10-15 років тому їх було вдвічі менше. Щороку створюють тисячі органічних речовин, які використовують як матеріали, лікарські препарати, розчинники. Неможливо передбачити, скільки ще появиться їх у найближчий час, проте виникла потреба класифікувати таку величезну різноманітність органічних сполук
Органічні речовини класифікують за різними ознаками:
- За будовою карбонового ланцюга:
- лінійні (ациклічні)
- циклічні
- За складом:
- вуглеводні
- оксигеновмісні
- галогеновмісні
- нітрогеновмісні
- За наявністю функціональних груп
- спирти
- карбонові кислоти
- амінокислоти та ін..
До складу більшості органічних сполук, крім атомів Карбону та Гідрогену, входять також атоми інших елементів (що не входять до карбонового скелету
молекули). Ці атоми, або їх групи, що визначають фізичні та хімічні властивості органічних сполук, називаються функціональними (характеристичними) групами.
Прикладами таких груп є:
- ОН - гідроксильна
- СООН - карбоксильна
−NН2 – аміногрупа та інші.
(Учні разом з вчителем заповнюють таблицю)
![]() Класифікація органічних сполук
Класифікація органічних сполук
|
група сполук |
Клас |
Особливість будови |
Загальна формула |
Приклади |
|
Алкани |
одинарні – С – С – зв’язки |
СnН2n+2 |
CН4 - метан |
|
|
Алкени |
подвійний – С=С – зв'язок |
СnН2n |
C2Н4 СН2 = СН2 - етен |
|
|
Алкіни |
потрійний - С≡С – зв'язок |
СnН2n-2 |
C2Н2 СН ≡ СН - етин |
|
|
Арени |
ароматичне кільце |
СnН2n-6 |
С6Н6 - бензен |
|
|
Спирти |
функціональна група – ОН (гідроксильна) |
R−ОН |
СН3-ОН - метанол |
|
|
Карбонові кислоти |
функціональна група – СООН (карбоксильна) |
R−СООН |
СН3-СООН – етанова кислота (оцтова) |
|
|
Вуглеводи |
функціональні групи – ОН (гідроксильна) і >С=O (карбонільна) |
Сn(Н2О)m |
С6Н12О6 - глюкоза С12Н22О11 - сахароза - (С6Н10О5)n - крохмаль |
|
|
Амінокис- лоти |
функціональні групи – СООН (карбоксильна) і −NН2 (аміногрупа) |
R−СООН | NН2 |
NН2 –СН −СООН – аміноетанова кислота |
|
|
Білки |
наявна пептидна група - СO – NH - з пептидним зв'язком |
(R−СОО -) n | NН- |
інсулін, кератин, актин, гемоглобін |
- Закріплення вивченого матеріалу
Бесіда
-
 Чому енергія подвійного зв’язку не у два рази більша, ніж в одинарного?
Чому енергія подвійного зв’язку не у два рази більша, ніж в одинарного?
- Яким чином пов’язана довжина зв’язку та його енергія?
- Як впливає тип зв’язку на властивості речовин?
- Для наступних речовин вкажіть особливості зв’язку: С4Н8, С2Н6, С5Н8.
![]() Диференційована самостійна робота «Хімічний практикум» з обговоренням результатів (учні виконують завдання і пояснюють їх).Завдання 1.
Диференційована самостійна робота «Хімічний практикум» з обговоренням результатів (учні виконують завдання і пояснюють їх).Завдання 1.
Визначте, до яких класів належать наступні сполуки:
- СН3−СООН
- СН3 – С ≡ СН
- С2Н5-ОН
- CН3– СН2 – СН2 – СН2 - CН3
- СН2 = СН – CН3
Завдання 2.
Обчисліть масові частки елементів у: а) пентані; б)етиловому спирті; в)оцтовій кислоті.
Захист навчальних проектів:
3D-моделі молекул органічних сполук.
- Домашнє завдання
Вивчити параграф, виконати вправи
Тема 2. Вуглеводні
Пара 5
Тема пари: Класифікація вуглеводнів. Алкани. Загальна формула алканів, структурна ізомерія, систематична номенклатура, хімічні властивості алканів
Мета пари:
навчальна: розширити і поглибити знання учнів про будову алканів, їх ізомерію, сформувати в учнів вміння називати алкани за систематичною номенклатурою та складати структурні формули за їх назвою, продовжувати розвивати навички написання структурних формул ізомерів;
розвиваюча: розвивати логічне мислення, просторову уяву;
виховна: виховувати цілеспрямованість, самостійність, критичність мислення,
Очікувані результати навчання
Знаннєвий компонент
називає алкани за систематичною номенклатурою; загальні формули алканів;
пояснює суть структурної ізомерії вуглеводнів;
розпізнає структурні ізомери певної речовини;
наводить приклади насичених вуглеводнів; структурних формул ізомерів алканів.
Діяльнісний компонент
розрізняє вуглеводні різних гомологічних рядів;
складає на основі загальної формули молекулярні формули вуглеводнів певного гомологічного ряду; структурні формули алканів; структурні формули ізомерів алканів за молекулярною формулою сполуки;
Тип пари: комбінований урок
Форми роботи: фронтальна робота, самостійна робота учнів, робота в парах
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (лабораторний дослід, виконання вправ).
Обладнання: моделі молекул вуглеводнів
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
Студент біля дошки розв’язує задачу. Письмове опитування (додаток 1.) Усне опитування:
-
 Назвіть класи вуглеводнів та коротко їх охарактеризуйте.
Назвіть класи вуглеводнів та коротко їх охарактеризуйте.
- Які особливості зв’язків у органічних сполуках?
- Чим характеризується ковалентний зв'язок?
- Порівняйте одинарний, подвійний та потрійний зв'язок за різними параметрами
- Як впливає тип зв’язку на властивості речовини?
- Актуалізація опорних знань
Бесіда:
![]() Чим характеризуються алкани? Яка їх загальна формула?
Чим характеризуються алкани? Яка їх загальна формула?
Які особливості будови алканів? Що таке ізомери?
4..Повідомлення теми уроку
5. Вивчення нового матеріалу
Алкани (парафіни) – насичені вуглеводні з загальною формулою СnН2n+2. У них атоми Карбону між собою сполучені одинарними зв’язками і максимально насичені атомами Гідрогену, тому більше їх приєднувати не здатні. Інша їх назва
«парафіни» - малодіяльні.
Особливості будови алканів:
- атоми Карбону сполучені простими одинарними звязками, між ними можливе вільне обертання
-
 ланцюг має зигзагоподібну форму з кутом
ланцюг має зигзагоподібну форму з кутом
109º.
Найпростіший представник – метан. Згідно з
однією з теорій, життя виникло тоді коли Земля була оточена атмосферою метану, води, амоніаку та водню. Під дією енергії Сонці ці молекули вступали у взаємодію,
утворивши складні органічні сполуки (білки). Цю теорію підтвердили експериментально.
Ізомерія алканів
Ізомерія – явище існування сполук з однаковим складом, але різною будовою та властивостями.
Ізомерія в алканів буває:
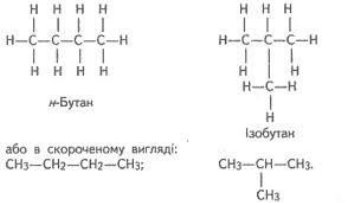
- структурна - пов’язана з послідовністю атомів
(алкани з нерозгалуженим ланцюгом називають нормальними, а з розгалуженим – ізобутан, ізопентан)
- просторова (стереоізомерія) – пов’язана з взаємним розташуванням атомів у просторі.
Номенклатура алканів Назви перших 4 представників склалися історично, а решта походить від грецьких числівників.
Гомологічний ряд метану Число ізомерів

 Пригадайте, що таке гомологи?
Пригадайте, що таке гомологи?
Що називають гомологічною різницею?
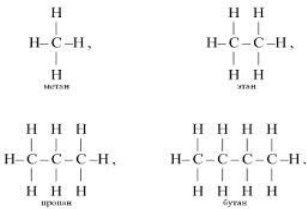
Складіть для перших представників алканів електронні, структурні та напівструктурні формули.
Коли потрібно назвати ізомери з розгалуженою будовою, то застосовують номенклатуру ІЮПАК.
Схема назви:
префікси (замісники в алф. пор.) + корінь (головний ланцюг алк-) + суфікс (-ан)
Замісник – залишок, утворений при відщепленні Гідрогену, в його назві замість –ан суфікс – ил.
СН3 – метил С2Н5 – етил С3Н7 – пропіл (ізопропіл) С4Н9 – бутил.
Порядок номенклатури:
- вибір найдовшого ланцюга,
- його нумерація за принципом найменшого локанта (номер атома Карбону, біля якого розташований замісник), якщо замісники розташовані на однаковій відстані, то враховують алфавітний порядок назв
- визначення замісників та їх локанта в алфавітному порядку, якщо кілька однакових замісників, то використовують префікси ди-, три-, тетра-;
- називання головного ланцюга. 2 1
СН2 – СН3
| 3 4 5 6
СН3 – СН – СН – СН2 – СН – СН3
| | 7 8
С2Н5 СН2 – СН3 4-етил-3,6-диметилоктан
![]() Назвіть всі ізомери пентану:
Назвіть всі ізомери пентану:
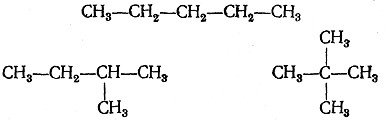
Атоми Карбону в органічних сполуках поділяють на:
- первинні – сполучені з одним Карбоном,
- вторинні – сполучені з двома атомами Карбону,
- третинні – сполучені з трьома атомами Карбону,
- четвертинні – сполучені з чотирма атомами Карбону.
![]() Визначте первинні, вторинні, третинні та четвертинні атоми Карбону у вуглеводні:
Визначте первинні, вторинні, третинні та четвертинні атоми Карбону у вуглеводні:
I
СН3
I II | III I
СН3 – СН – С(IV) – СН – СН3
I | І |
СН3 СН3
- Закріплення вивченого матеріалу
 Робота в парах:
Робота в парах:
-
Напишіть формулу алкану за назвою, вкажіть (I,II,III,IV)–ні атоми Карбону:
- 2,5-диметилгексан;
- 4-бром-2,2-диметилпентан
- 3-етил-2-метилгептан
- 2,2,3-триметилпентан.
- Серед наведених формул знайдіть:
- ізомери
- гомологи Назвіть їх
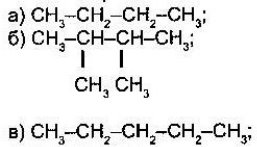
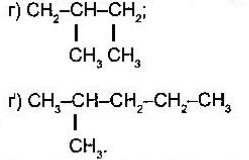
- Назвіть алкани з такими напівструктурними формулами, знайдіть серед них ізомери:
а 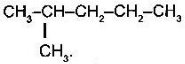 б
б 
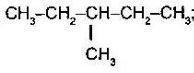 в
в 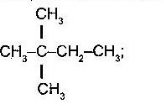 г
г
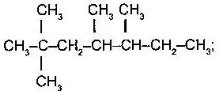
д 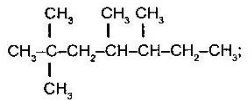 е
е 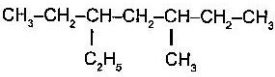
Робота в групах:
- група
- Напишіть формулу алкану за назвою:
- 2,2,3,4-тетраметилгексан;
- 4-етил-3,3 – диметил-4-пропілоктан
- Зобразіть напівструктурні формули 3 можливих ізомерів гептану
- Назвіть речовину, складіть напівструктурні формули 2 її ізомерів, дайте їм назви
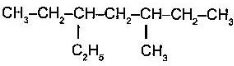
- група
- Напишіть формулу алкану за назвою:
- 3-етил-2,4-диметилгептан;
- 2-метил-3-ізопропілпентан
- Зобразіть напівструктурні формули 3 можливих ізомерів октану
- Назвіть речовину, складіть напівструктурні формули 2 її ізомерів, дайте їм назви
- група
- Напишіть формулу алкану за назвою:
- 2,2,4-триметил-3-хлорогексан
- 4-бутил-3,3-діетил-2,5,6-триметилнонан
- Зобразіть напівструктурні формули 3 можливих ізомерів гексану
- Назвіть речовину, складіть напівструктурні формули 2 її ізомерів, дайте їм назви
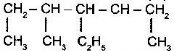
- Домашнє завдання
Вивчити параграф, виконати вправи.
Хімічні властивості алканів
![]() Які загальні фізичні властивості алканів?
Які загальні фізичні властивості алканів?
У які хімічні реакції вони вступають? До якого типу ці реакції
належать?
![]() Наскільки реакційно здатними є алкани, порівняно з іншими
Наскільки реакційно здатними є алкани, порівняно з іншими
вуглеводнями?
![]() Як пояснити властивості алканів, виходячи з їхньої будови?
Як пояснити властивості алканів, виходячи з їхньої будови?
- Мотивація навчальної діяльності
Вам відомо, що жодна операція без анестезії не проводиться. Основну анестезуючу речовину – хлороформ (трихлорметан) – добувають саме з метану.
Як вигадаєте, яким чином це відбувається?
Чи можна в лабораторних умовах добути хлороформ?
- Повідомлення теми уроку
- Вивчення нового матеріалу
Бесіда:
Пригадайте, як змінюються властивості алканів із збільшенням їх відносної молекулярної маси?
- Агрегатний стан
- Запах
- Температура плавлення і кипіння
- Розчинність у воді
- Густина С1 - С4 – гази
С5 – С15 – рідини
С16 і більше – тверді речовини.
Характерним є те, що розгалужені ізомери мають нижчі температури плавлення і кипіння.
Газоподібні і тверді алкани запаху не мають, а рідкі мають запах бензину.
Нерозчинні у воді, густина менше 1.
Алкани малореакційні сполуки, але представники з розгалуженою будовою більш активні, що пов’язано із більшим зміщенням електронної густини у вторинних та третинних атомах Карбону.
Хімічні властивості алканів
-
Окиснення
- повне (горіння): С3Н8 + 5О2 → 3СО2 + 4Н2О ∆Н‹ 0 – реакція екзотермічна
- неповне С3Н8 + 2О2 → 3С + 4Н2О
(kat MnO2) СnН2n+2 + [O] → R-ОН або R- СООН
- Галогенування (при освітленні) відбувається за ланцюговим радикальним механізмом:
Радикал – частинка, що містить неспарений електрон.
Cl : Cl → Cl∙ + Cl∙ - ініціювання ланцюга
радикали
СН3 : Н + Cl∙ → СH3 ∙ + НCl – ріст ланцюга
СН3 ∙ + Cl : Cl → СH3Cl + Cl∙
Cl∙+ Cl∙ → Cl:Cl - обрив ланцюга
- С3Н8 + Cl2 → С3H7Cl + НCl - хлоропропан
- С3Н7Cl + Cl2 → С3H6Cl2 + НCl - дихлоропропан
- С3Н6Cl2 + Cl2 → С3H5Cl3 + НCl - трихлоропропан і т.д.
Яка кількість атомів Гідрогену може заміститися у пропані? Як називається реакція такого типу?
-
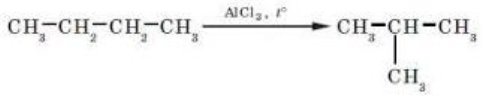
Ізомеризація (відбувається в присутності АlСl3): - Дегідрування – відщеплення водню: С4Н10 → С4Н8 + Н2
-
Крекінг – розщеплення алканів під впливом температури: С8Н18 → С4Н10 + С4Н8
- термічний крекінг - відбувається при t = 500-550º - продукт містить велику кількість ненасичених сполук
- каталітичний - при t = 450 - 500º - більший вміст насичених вуглеводнів
Цікаво про алкани
- До складу феромонів тварин входять деякі вищі алкани. Запах феромонів приваблює комах або їх відлякує. Наприклад, феромон тривоги в мурашок-древоточців містить насичений вуглеводень декан. Вуглеводи С16-С36, які є в поверхневому шарі кутикул рослин, запобігають їхньому висиханню. У ході еволюції насичені вуглеводні, які виробляють квітки орхідеї роду Оphrys (О. sphegodes), набули нової функції - приваблювання комах.
- На поверхні фруктів воскоподібна плівка містить гомологи метану.
- Парафін ( С18 – С35) – використовується в медицині (парафінотерапія)
- Вазелінова олія (до С25) - у медицині, парфумерії, косметології
- Вазелін (до С25) - у медицині для виготовлення мазей
- Спрей-заморозку «Doc Sprt» використовують для швидкого охолодження шкіри і м’язів при вивихах і розтягненнях. Містить зріджені пропан і бутан (раніше С2Н5Сl – токсичний)
- Спрей «Дин фріз» - зовнішній засіб для лікування болю в м’язах, попереку, ревматичного болю, болю від забиття, судом, розтягнення зв’язок. Головна його складова – С5Н12 (на шкірі випаровується, поглинаючи тепло, охолоджує ділянку шкіри.)
- Закріплення вивченого матеріалу
 Робота в парах:
Робота в парах:
І. Скласти рівняння реакцій:
- горіння пентану
- хлорування пропану
- дегідрування етану
- крекінгу гептану
- ізомеризації пентану
ІІ. Закінчити рівняння реакцій:
1. С3Н8 + Cl2 →
2. С5Н12 + О2→
3. С3Н8 + Cl2→
4. СН3-СН2-СН2-СН2-СН3→
ІІІ. На прикладі гептану проілюструвати хімічні властивості алканів ІV. Задача
- Який обєм кисню і повітря витратиться при згорянні бутану обємом 10 л (н.у.)?
- Який об’єм хлору (н.у.) потрібний для повного хлорування метану кількістю речовини 1,5 моль? Яка маса тетрахлорометану при цьому утвориться?
8. Домашнє завдання
Вивчити параграф, виконати вправи.
Додаток 1.
Варіант 1.
-
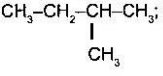 Назвіть речовини:
Назвіть речовини:
а) б) 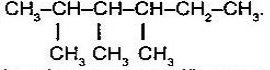
- Складіть формулу алканів за назвою:
- 2,4 -диметилпентан;
- 4-етил-2,2-дихлорогептан;
Варіант 2.
-
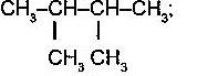 Назвіть речовини:
Назвіть речовини:
а) 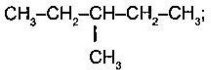 б)
б)
- Складіть формулу алканів за назвою:
- 3,3 -диметилгексан;
- 4-етил-2-хлорооктан;
Варіант 3.
- Назвіть речовини:

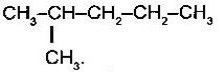 А)
А)
- Складіть формулу алканів за назвою:
- 3-етил-2 -метилпентан;
- 4-метил-2,3-дихлорогептан;
Варіант 4
- Назвіть речовини:
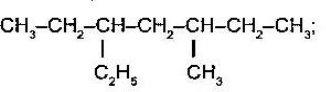 а)
а) 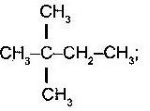 б)
б)
-
Складіть формулу алканів за назвою:
- 2-бром-3-метилоктан
- 3,4,5-триетилгептан
Варіант 5
-
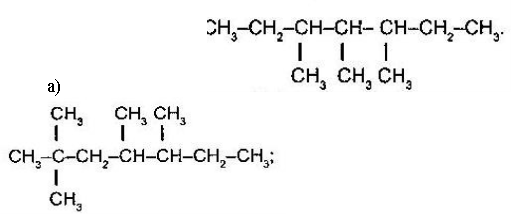 Назвіть алкани:
Назвіть алкани:
b)
- Написати напівструктурну формулу алканів за назвою:
- 2,2,3,4-тетрахлорогексан;
- 4-етил-3,3 – диметилоктан
Варіант 6
- Назвіть алкани:
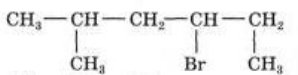 a) b)
a) b) 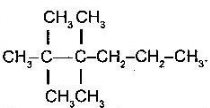
- Написати напівструктурну формулу алканів за назвою:
- 2,2,3-триметилпентан.
- 3-етил-2,4-диметилгептан;
Пара 6
Тема пари: Алкени і алкіни. Загальні та молекулярні формули алкенів і алкінів, структурна ізомерія, систематична номенклатура. Хімічні властивості етену та етину
Мета пари:
навчальна: розширити і поглибити знання учнів про будову алкенів та алкінів, їх структурну ізомерію, ознайомити учнів з систематичною номенклатурою алкенів та алкінів, сформувати вміння називати алкени та алкіни, складати структурні формули за їх назвою, продовжувати формувати вміння розв’язувати задачі на знаходження формули за густиною або відносною густтиною, розвивати навички написання структурних формул ізомерів;
розвиваюча: розвивати просторове мислення та уяву, вміння порівнювати, узагальнювати, робити висновки
виховна: виховувати самостійність, критичність мислення.
Очікувані результати навчання
Знаннєвий компонент
учень називає алкени і алкіни за систематичною номенклатурою; загальні формули алкенів, алкінів;
пояснює суть структурної ізомерії вуглеводнів; розпізнає структурні ізомери певної речовини; наводить приклади ненасичених вуглеводнів; структурних формул ізомерів алкенів і алкінів.
Діяльнісний компонент
Студент розрізняє вуглеводні різних гомологічних рядів;
складає на основі загальної формули молекулярні формули вуглеводнів певного гомологічного ряду; структурні формули алкенів і алкінів; структурні формули ізомерів алкенів і алкінів за молекулярною формулою сполуки;
класифікує вуглеводні різних гомологічних рядів.
Тип пари: пара засвоєння нових знань
Форми роботи: фронтальна робота, робота в парах, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: моделі молекул вуглеводнів, набір для складання кулестержневих моделей молекул.
Хід пари
- Організаційний етап
- Актуалізація опорних знань
 Бесіда:
Бесіда:
![]() Що таке гомологічний ряд?
Що таке гомологічний ряд?
Чим характеризуються алкени? Що відрізняє їх від алканів? Яка загальна формула алкенів?
![]() Що характерно для алкінів? Які їх особливості будови?
Що характерно для алкінів? Які їх особливості будови?
- Мотивація навчальної діяльності
Двоє учнів посперечалися: один стверджував, що речовина складу С4Н8 належить до насичених вуглеводнів, а інший доводив, що до ненасичених. Хто з учнів був правий?
- Повідомлення теми уроку
- Вивчення нового матеріалу
|
Алкени (олефіни від лат.oleum – рослинна олія) – ненасичені вуглеводні, у яких відкритий карбоновий ланцюг має один подвійний зв'язок. |
Алкіни – ненасичені вуглеводні, у яких відкритий карбоновий ланцюг має один потрійний зв'язок. |
|
|
Особливості будови : (демонстрація моделей молекул) |
||
|
між двома атомами Карбону є подвійний зв'язок (σ - зв'язок, 1 π – зв'язок) |
між двома атомами Карбону є потрійний зв'язок (σ - зв'язок, 2 π – зв'язки) |
|
|
кут між зв’язками 120º. |
кут між зв’язками 180º. |
|
|
довжина зв’язку С=С 0,134 нм, а енергія – 620 кДж |
довжина зв’язку -С≡С- 0,120 нм, а енергія – 810 кДж |
|
|
Загальна формула СnН2n |
Загальна формула СnН2n-2 |
|
|
Найпростіший представник – етен С2Н4 - молекулярна формула СН2=СН2 - напівструктурна формула
формула |
Найпростіший представник – етин С2Н2 - молекулярна формула СН≡СН - напівструктурна формула
структурна формула |
|
|
|
||
|
Гомологічний ряд етену: С2Н4 – етен С3Н6 – пропен С4Н8 - бутен. С5Н10 - пентен С6Н12 – гексен С7Н16 - гептен і т.д. |
Гомологічний ряд етину: С2Н2 – етин С3Н4 –пропін С4Н6 - бутин. С5Н8 - пентин С6Н10 –гексин С7Н12 - гептин і т.д. |
|
|
Структурна ізомерія алкенів та алкінів обумовлена наявністю кратного зв’язку і пов’язана: а) з місцем кратного зв’язку С-С=С-С або С=С-С-С (С-С≡С-С або С≡С-С-С) б) з різною будовою карбонового ланцюга (С=С-С-С або С=С- С) │ С |
||
Із збільшенням числа атомів Карбону кількість ізомерів зростає (в бутену 4).
![]() Складіть структурну і напівструктурну формули усіх
Складіть структурну і напівструктурну формули усіх
ізомерів
А) бутену Б) бутину
- Де більше ізомерів: у алкенів чи алкінів?
Номенклатура алкенів та алкінів Схема назви:
префікси (замісники в алф. пор.) + корінь (головний ланцюг алк-) + суфікс (-ен) або (-ін, -ин)
Порядок номенклатури:
- вибір найдовшого ланцюга (з кратним зв’язком)
- його нумерація з кінця, де ближче кратний зв’язок
- визначення замісників та їх локантів в алфавітному порядку
- назва головного ланцюга, визначення місця подвійного зв’язку + суфікс
–ен (-ін, -ин)
![]()
|
бутену |
бутину |
|
1 2 3 4 СН3 = СН - СН – СН3 – бут-1-ен |
1 2 3 4 СН3 ≡ С - СН – СН3 – бут-1-ин |
|
1 2 3 4 СН3 – СН = СН – СН3 – бут-2-ен |
1 2 3 4 СН3 – С ≡ С – СН3 – бут-2-ин |
|
2 – метилпропен |
Чому для бутину такий ізомер не існує? |
|
Зобразіть та назвіть усі можливі ізомери А) пентену |
Б) пентину |
|
4 3 2 1 СН3 – СН = С– СН3 - 2- метилбут-2-ен | СН3 |
1 2 3 4 СН ≡ С - СН– СН3 - 3-метилбут- 1-ин | СН3 |
 При наявності згину ланцюга його нумерацію проводять з їх врахуванням 1 2 3 4 5
При наявності згину ланцюга його нумерацію проводять з їх врахуванням 1 2 3 4 5
СН3 – СН =СН – СН2 – СН – СН3
| |6 7
СН3 СН2 – СН3 - 4,5-диметилгепт-2-ен
- Закріплення вивченого матеріалу
 Проблемне питання:
Проблемне питання:
- Чому у алкенів більше ізомерів, ніж у алканів, а у алкінів менше, ніж у алкенів?
Завдання (робота по варіантах)
- Виберіть з переліку вуглеводнів
С5Н10; С4Н6, С8Н18; С6Н12; С7Н12; С4Н10 С2Н4; С8Н14; С6Н14; С18Н36
І варіант: представників ряду алкенів:
ІІ варіант: представників ряду алкінів:
- Напишіть формулу за назвою
І варіант:
- 3-метилпент-1-ен
- 3,3-диетил-2,5,6-триметилокт-1-ен
- 4,5-диметилгепт-1-ин
ІІ варіант:
- 4-метилгепт–2-ен
- 3-етил-4,4-диметилгекс-1-ен
- 3-метилпент-1-ин
- Назвіть сполуки:
І варіант:
СН3 СН3
| |
А) СН3 – СН - СН– СН = СН2
Б) СН3 – СН2 – СН – СН2 – С = СН2 В)СН3 – СН = С – СН2 – СН - СН3
| | | |
С2Н5 СН3 С3Н7 С2Н5
ІІ варіант:
СН3 СН3
| |
А) СН3 – СН - СН– С≡ СН
Б) СН3 – С ≡ С – СН– СН - СН3 В)СН3 – СН - С ≡ С – СН - СН2 - СН3
| | | |
С2Н5 СН3 СН 3 С2Н5
- Розв’язати задачу:
І варіант:
Відносна густина за воднем алкіну - 34. Яка його формула? (С5Н8)
ІІ варіант:
Відомо, що 1,12 л алкену мають масу 2,8 г. Яка його молекулярна і структурна формула. (С4Н8)
Алкени та алкіни через наявність кратного зв’язку мають високу хімічну активність, здебільшого у них руйнується цей зв'язок і за рахунок цього вони можуть приєднувати по 2 (або 4) атоми.
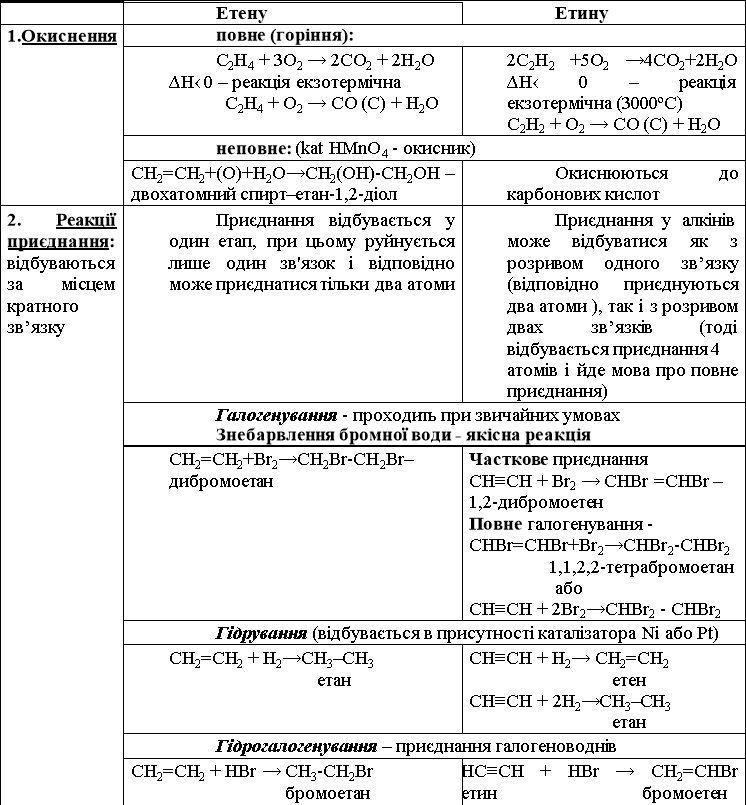 Хімічні властивості
Хімічні властивості
|
|
|
етин дибромоетан |
|
Гідратація – приєднання води в присутності каталізатора - сульфатної кислоти |
||
|
СН2= СН2 + Н-ОН → СН3-СН2ОН етанол |
СН≡СН + НОН → СН3-СОН оцтовий альдегід (вивчатиметься пізніше) |
|
- Закріплення вивченого матеріалу
 Робота в парах:
Робота в парах:
- У двох посудинах пропан і пропен, як їх можна розрізнити?
- Скласти рівняння реакцій, в які вступає
- бутен,
-
пропін.
- Закінчити рівняння реакцій:
- С4Н8 + НBr → …
b. С3Н4 + 2Н2 →…
-
С2Н2 + …→ C2H2Cl4
- Здійснити перетворення: А) C2H2 – C2H6 – C2H4 – C2H4Cl2
│
С2Н5ОН
Б) CО2 С2Н4Cl2
↑ ↑
С2Н2 → С2Н4 → С2Н6 →СО2
↓ ↓
С2Н2Br4 С2Н5Cl
- С4Н6 + 2НCl →…
- С3Н6 + …→ С3Н7Br
- С3Н4 + …→ С3Н6Cl2
Задача.
- Яку масу брому може приєднати:
А) етен об’ємом 44,8 л (320 г)
Б) етин кількістю речовини 3 моль (960 г)
В) суміш етану та етину масою 80 г з масовою часткою етину 65%? (640 г)
- Чи вистачить 67,2 л хлороводню для повного гідрогалогенування етину кількістю речовини 2 моль? (ні, потрібно 89,6 л)
8. Домашнє завдання
Вивчити параграф, виконати вправи.
Задача. Чи вистачить 142 г хлору для хлорування етену масою 40 г? (так, бо потрібно 101 г)
Додаток 1.
Варіант 1
- Скласти формули речовин за назвами:
- 2-метилпент-1-ен;
- 5-етил-4,4-дихлоргепт-2-ин
- 3,3-диетил-4-метилгепт-2-ен;
- Назвати речовини:
а) 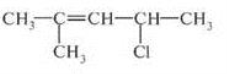 б)
б) 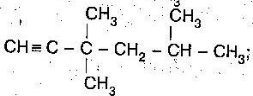
Варіант 2
- Скласти формули речовин за назвами:
- 4,4-диметилгепт-2-ин
- 3,3-диметилбут-1-ен;
- 4-етил-2-метилгекс-2-ен
- Назвати речовини:
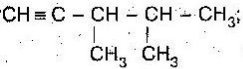 а)
а) 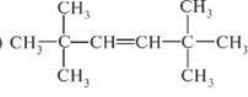 б)
б)
Варіант 3
-
Скласти формули речовин за назвами:
- 2-метилгекс-3-ен;
- 4,5,5-триетилокт-2-ин
- 3,5-диетилгепт-2-ен;
2. Назвати речовини:
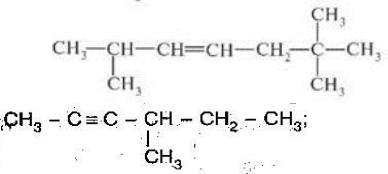
Варіант 4
-
Скласти формули речовин за назвами:
- 3,3-диетил-4-метилнон-1-ин;
- 5-метилгепт-3-ен
- 4-етил-3,4-диметилокт-1-ен.
2. Назвати речовини:
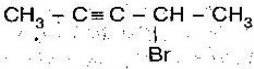 А)
А) 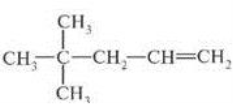 Б)
Б)
Варіант 5
- Скласти формулу за назвою:
- 4,5-диетилокт-2-ин;
- 3,3-диметилпент-1-ен;
- 4,4,5-триметилгепт-2-ин;
- Назвати речовини:
А) 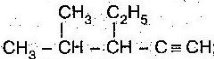 Б)
Б) 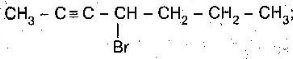
Вивчити параграф, виконати вправи
Задача
- Відносна густина за гелієм алкіну 24. Виконайте наступні завдання:
- визначити його молекулярну формулу,
- скласти напівструктурні формули 3-4 можливих ізомерів та назвати їх написати рівняння реакцій, властивих для цього алкіну. (С7Н12)
- Густина алкену 3,75 г/л. Виконайте наступні завдання:
- визначити його молекулярну формулу,
- скласти напівструктурні формули 3-4 можливих ізомерів та назвати їх написати рівняння реакцій, властивих для цього алкену. (С6Н12)
Пара 7
Тема практичного заняття: Розв’язування задач на виведення молекулярної формули речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції.
Мета пари:
навчальна: розширити і поглибити знання учнів про фізичні та хімічні властивості алканів, продовжувати формувати вміння складати рівняння хімічних реакцій, в які вступають алкани, сформувати вміння розв’язувати задачі на виведення молекулярної формули газу за за масою, об’ємом або кількістю речовини реагентів або продуктів реакції.
розвиваюча: розвивати вміння порівнювати, робити висновки, узагальнювати;
виховна: виховувати цілеспрямованість, самостійність
Очікувані результати навчання
Діяльнісний компонент
студент розв’язує задачі на виведення молекулярної формули речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції, обґрунтовуючи обраний спосіб розв’язання.
Тип пари: пара формування вмінь та навичок
Форми роботи: фронтальна робота, самостійна робота учнів, робота в парах Методи навчання: словесні (бесіда, пояснення), практичні (виконання вправ). Обладнання: моделі молекул вуглеводнів, картки із заданнями
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
Учні пояснюють домашні вправи Комбіноване опитування: Письмові завдання
|
Варіант 1 Скласти рівняння реакцій, вкажіть умови перебігу реакцій:
|
Варіант 2 Закінчити рівняння реакцій, вказати умови перебігу реакцій: 1. С3Н4 + 2Br2 → 2. С5Н10 + НCl → 3. С3Н4 + О2 → 4. СН≡СН + 2НCl→ 5. С4Н8+ Н2 → |
|
Варіант 3. Задача Густина алкіну 2,4 г/л. Визначте його формулу, складіть формули ізомерів. |
Тест – контроль .
- Серед наведених реакцій вкажіть реакцію гідрування: А) С3Н6 + НСl → ; В) С3Н6 + Н2О→;
Б) С3Н6 + Н2 → ; Г) С3Н6 + Br2 → .
- Серед наведених реакцій вкажіть реакцію галогенування: А) СН2 ═ СН2 + Cl2 → ; В) СН2 ═ СН2 + НСl → ;
Б) СН2 ═ СН2 + О2 → ; Г) СН2 ═ СН2 + Н2 → .
- . Серед наведених реакцій вкажіть реакцію гідрогенгалогенування: А) СН4 + Cl2 → ; В) СН ≡ СН + НСl → ;
Б) С2Н2 + О2 → ; Г) ) С2Н2 + Н2 →.
- Які з наведених речовин знебарвлюють бромну воду:
А) СН3 ─ СН2 ─СН3; В) СН ≡ СН; Д) ) СН3 ─ С ═СН2 ;
│ СН3
Б) СН3 ─ СН ═ СН2; Г) СН3 ─ СН2 ─ СН3 ;
- Якими речовинами можна скористатися, щоб виявити сполуки з кратними (подвійними та потрійними) зв’язками:
А) Н2; Б) Br2; В) КМпО4; Г) НСl .
- Вкажіть тип реакції, спільний для насичених і ненасичених вуглеводнів: А) приєднання; Б) заміщення; В) горіння; Г) обміну.
- Які особливості будови зумовлюють характерні властивості етену: А) простий (ординарний) зв’язок; В) потрійний зв’язок;
Б) подвійний зв’язок; Г) два подвійні зв’язки.
- Які особливості будови зумовлюють характерні властивості етину: А) простий (ординарний) зв’язок; В) потрійний зв’язок;
Б) подвійний зв’язок; Г) два подвійні зв’язки.
- Вкажіть продукт повного хлорування етину:
А) С2Н4Br2 Б) С2Н2Br4 В) С2Н5Br Г) С2Н6Br2
- В результаті гідратації етену утворюється:
А) СО2 і Н2О Б) С2Н5ОН В) С2Н5Br Г) С2Н6
- Повідомлення теми уроку
- Вивчення нового матеріалу
В органічній хімії часто виникають труднощі із встановленням істинної формули речовини, адже різниці у фізичних та хімічних властивостях близьких гомологів майже немає. Крім того, якщо неорганічних речовин з подібним складом мало, то в органічних сполуках лише вуглеводнів є тисячі.
Для того, щоб встановити склад органічної речовини, найчастіше аналізують продукти згоряння цієї речовини і за їх співвідношенням роблять висновки про склад вихідної сполуки.
Приклад 1.
При спалюванні вуглеводню масою 4,4 г одержали 13,2 г вуглекислого газу і 7,2 г води. Відносна густина його парів за воднем 22. Визначте його істинну формулу.
- Складаємо схему рівняння реакції: СxНy + О2 → xСО2 + y/2Н2О
- За відносною густиною обчислюємо молярну масу вуглеводню М=22·2=44 г/моль
- Зі схеми видно, що атоми Карбону з вуглеводню переходять у вуглекислий газ, а Гідрогену – у воду. Порівнявши кількості цих речовин, ми отримаємо відповідно співвідношення атомів Карбону та Гідрогену у вуглеводні.
ν(СxНy)= 4,4г/44г/моль=0,1 моль ν(СО2)= 13,2г/44г/моль=0,3 моль ν(Н2О)= 7,2г/18г/моль=0,4 моль
0,1моль 0,3 моль 0,4моль СxНy + (x+y/4)О2 → xСО2 + y/2Н2О
1 моль 3 моль 4 моль х=3 y/2=4 y =8
С3Н8 – пропан
- Перевіряємо, чи дана формула є істинною: М(С3Н8) = 44г/моль.
Отже, визначити формулу органічної речовини можна, порівнюючи кількості речовин, маси чи об’єми реагентів та продуктів реакції. І це стосується не лише реакцій горіння, а й рекцій приєднання, заміщення та ін.
Приклад 2.
Задача. Алкен масою 14 г знебарвлює бромну воду, в якій міститься 32 г брому. Визначте формулу алкену, складіть напівструктурні формули його ізомерів
Дано: m(CnH2n)=14г m(Br2) = 32 г
![]()
CnH2n - ?
Розв’язання
Складаємо рівняння реакції 14 г 32 г
CnH2n + Br2 = CnH2nBr2 М 160 г/моль
14г алкену знебарвлює 32 г брому, відповідно х прореагує з 160 г.
Складаємо пропорцію: 14 – 32
М - 160
М(CnH2n)= (160·14)/32= 70 г/моль 12n + 2n = 70
14n=70
n=5 С5Н10 - пентен
- Розв’язування тренувальних вправ (робота в парах)
- При спалюванні 0,1 моль вуглеводню утворилося 0,4 моль вуглекислого газу і 0,5 моль води. Знайдіть формулу сполуки. (С4Н10)
- При спалюванні 10 мл газуватого вуглеводню утворилося по 40 мл вуглекислого газу і водяної пари. Знайдіть формулу сполуки (С4Н8)
- При спалюванні 112 мл газуватого вуглеводню утворилося 448 мл вуглекислого газу і 0,45 г води, густина речовини за воднем 29. Знайдіть формулу сполуки (С4Н10)
- Алкен масою 28 г приєднує хлороводень об’ємом 11,2 л. Визначте молекулярну та напівструктурну формулу алкену (С4Н8)
- Алкін масою 7 г приєднує бромоводень, об’єм якого рівний об’єму метану масою 4,15 г. Визначте формулу алкіну (С4Н6)
Робота в групах:
І група
При спалюванні 1,84 г вуглеводню утворилося 3,136 л вуглекислого газу і 1,44 г води, молярна маса речовини 92 г/моль. Знайдіть формулу сполуки (С7Н8)
ІІ група
При спалюванні 4,2 г вуглеводню утворилося 13,2 г вуглекислого газу, відносна густина за воднем сполуки – 42. Знайдіть формулу сполуки (С3Н6)
ІІІ група
При спалюванні 2,24 л вуглеводню утворилося 4,48 л вуглекислого газу, густина речовини становить 1,1607 г/л. Знайдіть формулу сполуки (С2Н2)
ІV група
При спалюванні 1 моль вуглеводню утворилося 132 г вуглекислого газу, густина речовини становить 1,961 г/л. Знайдіть формулу сполуки (С3Н8)
- Домашнє завдання
Повторити параграф, виконати вправи.
Задача. Алкен масою 7 г знебарвлює бромну воду, в якій міститься 16 г брому. Визначте формулу алкену, складіть напівструктурні формули його ізомерів (C5H10,)
Пара 8
Тема пари: Арени. Бензен: молекулярна і структурна формули, фізичні властивості. Хімічні властивості бензену., методи одержання алканів, етену, етину, бензену. Застосування вуглеводнів. Застосування вуглеводнів.
Мета пари:
навчальна: ознайомити учнів з новим гомологічним рядом вуглеводнів – ароматичними сполуками, сформувати поняття про бензольне ядро, з’ясувати
фізичні та хімічні властивості бензену, встановити причинно-наслідкові зв’язки між будовою та властивостями бензену, сформувати вміння складати рівняння хімічних реакцій, в які вступає бензин, ознайомити учнів з основними галузями застосування аренів, зокрема з хімічними засобами захисту рослин на їх основі;
розвиваюча: розвивати вміння порівнювати, робити висновки, узагальнювати,
виховна: виховувати самостійність, наполегливість.
Очікувані результати навчання
Знаннєвий компонент
студент називає фізичні властивості бензену;
наводить приклади ароматичних вуглеводнів.
Діяльнісний компонент
Студент складає молекулярну і структурну формули бензену; рівняння реакцій, які описують хімічні властивості бензену (горіння, галогенування, гідрування).
характеризує хімічні властивості бензену;
дотримується правил безпечного поводження з вуглеводнями і їхніми похідними у побуті.
Ціннісний компонент
студент робить висновки щодо властивостей речовин на підставі їхньої будови і про будову речовин на підставі їхніх властивостей;
оцінює пожежну небезпечність вуглеводнів.
Тип пари: пара засвоєння нових знань
Форми роботи: фронтальна робота, самостійна робота студентів, робота в парах
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: моделі молекул вуглеводнів
Хід пари
- Організаційний етап
- Актуалізація опорних знань
 Бесіда:
Бесіда:
![]() Пригадайте загальну формулу алкенів. У реакції якого типу вони вступають?
Пригадайте загальну формулу алкенів. У реакції якого типу вони вступають?
Порівняйте їхню активність з активністю алканів: який більш реакційно здатний?
-
 Мотивація навчальної діяльності
Мотивація навчальної діяльності
У 1825 році Майкл Фарадей у світильному газі відкрив дивну речовину, вона була безбарвна, летка, з характерним запахом, нерозчинна у воді, але розчинна в органічних розчинниках і дуже отруйна. Це був бензен (бензол). Спробуйте передбачити її склад
- Повідомлення теми уроку 5.Вивчення нового матеріалу
Назва наступного класу вуглеводнів пов’язана з тим, що раніше ці сполуки добували з природних духмяних смол, проте для більшості з них запах не є характеристичною ознакою.
Складною проблемою виявилося встановлення будови бензену. Вчені припускали, що сполука складу С6Н6 має бути ненасиченою,
легко приєднувати і взаємодіяти з бромною водою. Однак бензен в реакції приєднання практично не вступав, а от заміщення відбувалося.
Німецький вчений Кекуле у 1865 р запропонував формулу, яка частково пояснювала властивості бензену.
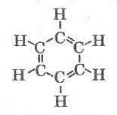
Арени (ароматичні вуглеводні) – вуглеводні, у молекулі яких міститься бензольне кільце.
Просторова будова бензольного кільця: (демонстрація)
Кути між атомами Карбону 120º, а довжина зв’язку 0,14 нм (0,154 нм – довжина одинарного, 0,134 нм – подвійного).
 Насправді в молекулі немає простих і подвійних зв’язків, всі зв’язки рівноцінні. Таким чином, неможливо чітко встановити місце подвійного зв’язку і більш реально відображає будову бензену така формула.
Насправді в молекулі немає простих і подвійних зв’язків, всі зв’язки рівноцінні. Таким чином, неможливо чітко встановити місце подвійного зв’язку і більш реально відображає будову бензену така формула.
Загальна формула аренів СnН2n-6
Властивості бензену Бесіда:
- Спробуйте передбачити фізичні властивості бензену (t плавлення = 5,5º, tкипіння=80º, розчинний в органічних розчинниках).
![]()
 Бензен – безбарвна рідина з сильним запахом. Дуже отруйний – при його концентрації в повітрі 10-25 мг/л настає гостре отруєння, що викликає запаморочення, судоми та непритомність. Хронічне отруєння уражує нирки, кістковий мозок, призводить до зменшення кількості еритроцитів у кістковому мозку (анемії), навіть до лейкемії.
Бензен – безбарвна рідина з сильним запахом. Дуже отруйний – при його концентрації в повітрі 10-25 мг/л настає гостре отруєння, що викликає запаморочення, судоми та непритомність. Хронічне отруєння уражує нирки, кістковий мозок, призводить до зменшення кількості еритроцитів у кістковому мозку (анемії), навіть до лейкемії.
Хімічні властивості бензену
1. Окиснення (повне): 2С6Н6 + 15О2 → 12СО2 + 6Н2О
Чи відбувається в бензену неповне окиснення?
|
Реакції заміщення |
Реакції приєднання |
|
1.Галогенування (каталізатор FeCl3) С6Н6 + Сl2 = С6Н5Cl + HCl – Хлоробензен
С6Н6 + 6Сl2 = С6Cl6 + 6HCl – гексахлоробензен |
електронної хмари
Гексахлорциклогексан (гексахлоран) |
Однією з важливих галузей застосування бензену та його похідних є сільське господарство. Тут використовуються речовини, що захищають рослини від комах— шкідників, грибів—паразитів, бур’янів. Ці речовини називають пестицидами.
- Закріплення вивченого матеріалу
Фронтальна бесіда:
- Які відмінності у властивостях аренів та алкенів, аренів та алканів?
- Поясніть взаємозв’язок будови та властивостей бензену.
- Чи можна за допомогою якісної реакції відрізнити бензен від алканів? А від алкенів?
Робота в парах:
- З переліку виберіть формули аренів: С5Н10; С8Н10; С7Н14; С4Н6, С7Н8; С9Н12; С8Н14
- Масова частка Карбону у складі арену – 90,57%. Густина пари речовини за карбон (IV) оксидом – 2,41. знайдіть молекулярну формулу сполуки, напишіть напівструктурну формулу. (С8Н10)
Індивідуальні завдання:
Здійсніть перетворення:
С2Н2 – С6Н6 – С6Н6Cl6
| C6H5Cl
8.Домашнє завдання
Вивчити параграф, виконати вправи.
Задача. Густина арену 5,36 г/л. Визначте його склад, складіть формули можливих ізомерів, назвіть їх. (С9Н12)
Усне опитування:
-
 Порівняйте арени з алканами та алкенами: що подібного і які відмінності?
Порівняйте арени з алканами та алкенами: що подібного і які відмінності?
- Охарактеризуйте просторову будову молекули бензену.
- На яких підставах арени виділили в окремий клас вуглеводнів?
- Які відмінності у властивостях аренів та алкенів, аренів та алканів?
- Поясніть взаємозв’язок будови та властивостей бензену.
- Чи можна за допомогою якісної реакції відрізнити бензен від алканів? А від алкенів?
Письмове завдання біля дошки:
Здійсніть перетворення:
С2Н2 – С6Н6 – С6Н6Cl6
| C6H5Cl
- Актуалізація опорних знань
Бесіда:
- Що спільного у всіх вуглеводнів?
- Які класи вуглеводнів ми вивчали?
- Яким чином пов’язані між собою вивчені нами класи вуглеводнів? Чи можливо здійснювати перетворення речовини одного класу в інший?
- Мотивація навчальної діяльності
Що спільного у пластикової пляшки, поліетиленової обкладинки для зошита і пластмасової ручки?
Ці предмети виготовлені з полімерів, сировиною для яких є саме вуглеводні, зокрема алкени. Щодня людство потребує мільйони тонн полімерів. Звідки ж їх добувають і якими методами?
Це ми з’ясуємо сьогодні на уроці.
- Повідомлення теми уроку
- Вивчення нового матеріалуДобування алканів:
Добування алканів:
В основному алкани добувають з природної сировини: нафти, природного газу, вугілля. Проте є і промислові та лабораторні методи.
Добування:
- метану:
- дія водню на вугілля ( t = 500, тиск, кат – Nі, Fе): С + 2Н2 → СН4
-
взаємодія алюміній карбіду з водою: Аl4С3 +12НОН → 3СН4 + 4Аl(ОН)3
-
інших представників:
- гідрування ненасичених вуглеводнів:
-
інших представників:
- алкенів С4Н8 + Н2 → С4Н10
- алкінів С4Н6 + 2Н2 → С4Н10
Застосування алканів:
- СH4 – паливо, сировина для добування ацетилену, водню
- СHCl3 – анестезуюча речовина (хлороформ)
- С6H14 -С9H20 – моторне паливо (бензин), хороші розчинники
- вазелінове масло (С15H32) – косметика, медицина
- парафін (С30H62) – виготовлення свічок, медичні компреси.
Добування алкенів:
Алкени добувають кількома способами, причому з різних класів органічних сполук: алканів, алкінів, спиртів. Значну частину алкенів отримують переробляючи нафтопродукти.
- Дегідрування алканів (в присутності каталізатора Ni): С2Н6 → С2Н4 + Н2
- Гідрування алкінів(в присутності каталізатора Pd): С2Н2 + Н2→ С2Н4
- Дегідратація спиртів (в присутності концентрованої сульфатної кислоти):
С2Н5ОН → С2Н4 + Н2О
Застосування алкенів
- Добування оцтової кислоти, етилового спирту
- Добування полімерів (поліетилену, поліпропілену, полівінілхлориду)
- Добування хлорпохідних (розчинники, анестезуючі речовини, засоби боротьби з хворобами рослин)
- Для прискорення достигання плодів (етилен)
Застосування алкінів
- Добування оцтової кислоти, етилового спирту, розчинників
- Зварювання та різання металів
- Добування смол, каучуків
Добування бензену:
- у промисловості – з нафти і кам’яновугільної смоли
- дегідрування н-гексану - каталізатор Pt, Pd С6Н14 = С6Н6 + 4Н2
-
 тримеризація ацетилену (t=600º, нагріте вугілля):
тримеризація ацетилену (t=600º, нагріте вугілля):
або 3С2Н2 = С6Н6
Застосування бензену його похідних
(Презентація повідомлень учнів)
- Гексахлоробензен – кристалічна речовина, застосовується для протруювання насіння пшениці проти сажки, а також для консервування деревини.
- Гексахлорциклогексан – сильний засіб для знищення комах.
- Нітробензен є сировиною для аніліну, з якого виготовляють барвники, ліки, вибухові речовини.
- Виготовлення пластмас,
- Виробництво отрутохімікатів
- Розчинники
- Добавка до моторного палива
7.Закріплення вивченого матеріалу
Як бачимо, між класами вуглеводнів можливі перетворення: з одного класу речовин можна отримати кілька інших.
Завдання
Спробуйте проілюструвати кожне перетворення рівнянням реакції.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Робота в групах:
-
група
-
 Закінчити рівняння реакцій:
Закінчити рівняння реакцій:
-
a) … + Н2 → С5Н10
b) С3Н7ОН → … + …
c) С3Н8 → …+ Н2
d) С6Н6 + …. → С6Н6Сl6
-
Скласти рівняння реакцій (не менше 2) добування:
- етану
- пропіну
- Скласти рівняння реакцій наступних перетворень:
C3H8 – C3H6 –C3H7OH – C3H6 – C3H6Br2
- Задача. Алкен масою 4,2 г може приєднати 2,24 л хлору. Що це за алкен? Який об’єм кисню потрібний для спалювання 10 м3 цього вуглеводню? (С3Н6, 45 м3)
- група
- Закінчити рівняння реакцій:
a) С5Н8 + 2Н2 →
- С2Н2 + …→ C2H2Cl4
- С4Н6 + 2НCl →
- С3Н4 + …→ С3Н5Сl
-
Скласти рівняння реакцій (не менше 2) добування:
- пропану
- бутену
- Скласти рівняння реакцій наступних перетворень: C2H6 - C2H4 – C2H5Cl – C2H5OH – C2H4 – CO2
- Задача. Алкін масою 13,6 г прореагував з бромоводнем масою 32,4 г. Визначте формулу алкіну. Який продукт реакції утворився і яка його маса? (C5H8, C5H10Br2, 46 г)
8. Домашнє завдання
Вивчити параграф. Виконати вправи.
Пара 10 практичне заняття №1
Тема пари: Розв’язування розрахункових задач
Мета пари:
навчальна: розширити і поглибити знання учнів про фізичні та хімічні властивості вуглеводнів, продовжувати формувати вміння складати рівняння реакцій хімічних перетворень органічних речовин та розв’язувати розрахункові задачі за їх участю;
розвиваюча: розвивати вміння порівнювати, узагальнювати, систематизувати;
виховна: виховувати самостійність, ініціативність, колективізм.
Очікувані результати навчання
Діяльнісний компонент
студент розв’язує задачі на виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною;масою, об’ємом або кількістю речовини реагентів або продуктів реакції, обґрунтовуючи обраний спосіб розв’язання.
Тип пари: пара формування вмінь та навичок
Форми роботи: фронтальна робота, самостійна робота студентівз підручником, робота в групах
Методи навчання: словесні (бесіда, пояснення), практичні (виконання вправ).
Обладнання: моделі молекул вуглеводнів.
Хід уроку
- Організаційний етап
- Актуалізація опорних знань
Бесіда
- Які гомологічні ряди вуглеводнів ви вивчали?
- Які елементи входять до складу всіх вуглеводнів?
- Що спільного в будові всіх вуглеводнів?
- Чи можливі перетворення вуглеводнів одного ряду на інші
-
Укажіть ознаки що характерні для гомологів.
- Повідомлення теми уроку
- Узагальнення і систематизація знань Властивості гомологічних рядів вуглеводнів. Бесіда
- Назвіть реакції, у які вступають усі вуглеводні
- Які специфічні властивості характерні для кожного гомологічного
ряду?
Учні заповнюють таблицю.
|
Хімічні властивості |
Вуглеводні |
||
|
Насичені |
Ненасичені |
Ароматичні |
|
|
Горючість |
|
|
|
|
Реакції заміщення |
|
|
|
|
Термічний розклад |
|
|
|
|
Приєднання водню |
|
|
|
|
Приєднання галогенів |
|
|
|
|
Взаємодія з бромною водою |
|
|
|
|
Якісні реакції |
|
|
|
6. Виконання тренувальних вправ
Робота в групах
Завдання 1
Виберіть з переліку окремо
- алкани, алкени, алкіни, арени
- гази, рідини, тверді речовини
|
1. |
С |
4. |
С |
7. |
С |
10. |
С |
|
С5Н10; |
|
С2Н2; |
|
С5Н10; |
|
С3Н4; |
|
|
2. |
С |
5. |
С |
8. |
С |
11. |
С |
|
С9Н16; |
|
С6Н6; |
|
С8Н14; |
|
С7Н16; |
|
|
3. |
С |
6. |
С |
9. |
С |
12. |
С |
|
С4Н10 |
|
С18Н36 |
|
С4Н6 |
|
С4Н8 |
|
Завдання 2.
1. Здійсніть перетворення, назвіть продукти реакції:
- C2H2 – C2H4 - C2H5Br – C4H10 - C4H9Cl – C4H8
- C2H4 – C2H5Cl – C2H5OH – C2H4 - C2H2 - CO2
- СаСО3→ А → СаС2 → Б → C2H2Br4
- хлоропропан – пропен – пропін – пропан - вуглекислий газ
Завдання 3.
-
Напишіть формули сполук за їх назвами
- 3-метил-1-пентин;
- 3,3-диетил-4-метилнон-1-ен;
- 5,5-диметилокт-2-ин;
- 4,4,5-триметилгепт-2-ен;
- 4-етил-3,4-диметил-1-гексин.
- Напишіть не менше 4 ізомерів октену, назвіть їх.
Завдання 4. Задачі
- Яку кількість речовини водню потрібно взяти для реакції з етином масою 0,26 кг, щоб утворився насичений вуглеводень? (20 моль)
- Який об’єм кисню потрібний для спалювання суміші 50 л пропіну і 30 л етану? (305 л)
- Суміш етину і метану об’ємом 89,6 л з об’ємною часткою метану 0,25 спалили. Обчисліть об’єм вуглекислого газу, що при цьому виділився. (156,8 л)
- Суміш етану і етину обємом 1,6 л знебарвила 400 г бромної води з масовою часткою брому 1,6%. Визначте обємні частки газів у суміші. (відповідно 72%, 28%)
- Яку масу брому може приєднати 5,4 г алкіну, густина якого 2,41 г/л?
(32 г)
- Об’ємна частка метану в природному газі 88%. Який об’єм етину (н.у.)
можна добути з 400 м3 такого газу? (176 м3)
Робота в групах за окремими завданнями:
І група
- Здійснити перетворення:
C2H4 – C2H5OH - C2H5Br – C4H10 - C4H9Cl – C8H18
- Алкін масою 3,4 г повністю прореагував з 2,24 л хлороводню. Визначте формулу алкіну. Складіть формули його ізомерів. (С5Н8)До суміші гексану і гексену масою 5 г приєднується бром масою 8 г. Визначте масові частки вуглеводнів у суміші. (16% і 84% відповідно)
ІІ група
- Здійснити перетворення:
бутан – бутен – дибромобутан
| хлоробутан
- При спалюванні 2 г речовини утворилося 6,6 г карбон оксиду і 1,8 г води. Густина пари речовини за повітрям становить 1,38 г. Знайдіть молекулярну формулу речовини (С3Н4)
- Через бензен масою 39 г пропустили надлишок водню в присутності каталізатора. Утворений вуглеводень спалили, а вуглекислий газ пропустили через вапняну воду. Яка маса осаду утворилася? (300г)
ІІІ група
- Здійснити перетворення:
Кальцій карбід – етин –– бензен - гексахлорциклогексан
| трибромбензен
- Арен масою 10,6 г спалили. Утворилось 35,2 г вуглекислого газу. Відносна густина пари арену за повітрям 3,66. Знайдіть молекулярну формулу арену. Напишіть формули можливих ізомерів. (С8Н10)
- Задача. Який об’єм кисню і повітря потрібний для спалювання суміші 4 л пропену і 2 л етину? (23 л, 115 л.)
7. Домашнє завдання
Повторити розділ «Вуглеводні». Виконати вправи. Здійснити перетворення:
Метан → етин → бензен → вуглекислий газ
↓ ↓
хлорометан етан
Тема 3. Оксигеновмісні органічні сполуки
Пара 9
Тема пари: Спирти. Поняття про характеристичну (функціональну)групу. Гідроксильна характеристична (функціональна)група. Насичені одноатомні спирти: загальна та структурні формули, ізомерія (пропанолів і бутанолів), систематична номенклатура. Водневий зв’язок, його вплив на фізичні властивості спиртів.
Мета пари:
навчальна: сформувати в учнів уявлення про різноманітність оксигеновмісних органічних сполук, розширити поняття «функціональна група» на прикладі функціональної групи спиртів, сформувати знання учнів про гомологічний ряд спиртів, ознайомити з їх номенклатурою та ізомерією; поглибити знання про водневий зв’язок, показати його вплив на властивості спиртів; сформувати вміння називати спирти за систематичною номенклатурою та складати структурні формули за їх назвою;
розвиваюча: розвивати логічне мислення, просторову уяву;
виховна: виховувати наполегливість. Очікувані результати навчання Знаннєвий компонент
учень називає загальну формулу та характеристичну (функціональну) групу спиртів за систематичною номенклатурою спирти;
пояснює вплив характеристичної (функціональної) групи на фізичні властивості оксигеновмісних органічних сполук; водневого зв’язку на фізичні властивості оксигеновмісних органічних сполук;
наводить приклади спиртів і їхні тривіальні назви.
Діяльнісний компонент
учень класифікує оксигеновмісні органічні сполуки за характеристичними групами;
складає молекулярні і структурні формули спиртів (за назвами і загальною формулою відповідного гомологічного ряду);
дотримується правил безпечного поводження з органічними речовинами.
Тип уроку: урок засвоєння нових знань.
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: таблиця «Типи хімічного зв’язку», набір для складання кулестержневих моделей молекул.
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
Учень біля дошки виконує домашні вправи.
 Усне опитування:
Усне опитування:
- Порівняйте хімічний склад вугілля різних видів
- В чому переваги і недоліки вугілля як вуглеводневої сировини?
- Які методи хімічної переробки вугілля вам відомі?
- На основі яких процесів: фізичних чи хімічних ці методи ґрунтуються?
- Мотивація навчальної діяльності
У вас на столі три предмети: спиртівка, розчин йоду, парфуми. Що спільного у них? (розчинник – спирт)
Яке значення має дана речовина у кожному випадку? На яких властивостях ґрунтується її використання?
На ці та багато інших питань ми знайдемо відповідь протягом уроку.
- Повідомлення теми пари
- Вивчення нового матеріалу
Розгляньте схему в підручнику «Оксигеновмісні речовини» і пригадайте, які з них ми вивчали у 9 класі.
Чим вони відрізнялися?
Така їх послідовність не випадкова: ці речовини саме в такому порядку можуть перетворюватися одні в одних. Першою ж ланкою є спирти.
Склад спиртів було з’ясовано значно раніше, ніж виведено структурну формулу:
С2Н6О, але цій молекулярній формулі відповідає дві структурних: СН3-О-СН3 і СН3-СН2-ОН.
Проведені експерименти довели, що у хімічних реакціях бере участь лише один атом Гідрогену, відповідно він не є рівноцінним, тому саме друга формула є вірною.
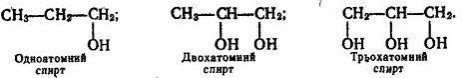
Спирти – органічні речовини, молекули яких складаються з вуглеводневого залишку та однієї чи кількох гідроксильних груп – ОН
В залежності від кількості гідроксильних груп спирти бувають:
- одноатомні (R-ОН)
- багатоатомні (R-(ОН)2, R-(ОН)3)
За типом хімічних зв’язків:
- насичені
- ненасичені
- ароматичні
Загальна формула насичених одноатомних спиртів:
СnН2n+1ОН або R-ОН
вуглеводневий залишок гідроксильна група Будова функціональної групи
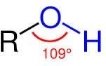 δ- δ+
δ- δ+
СН3-СН2 →О←Н зв'язок поляризується, стає більш слабкий, тому атом Гідрогену гідроксильної групи легко відривається.
Особливості будови функціональної групи спричиняють можливість утворення водневого зв’язку:
О-Н …О-Н…О-Н
| | |
R R R
Ці зв’язки не міцні (20 кДж/моль), але в результаті цього молекули ніби прилипають одна до одної, цим пояснюються вищі температури плавлення і кипіння спиртів, а також їх розчинність у воді.
За номенклатурою ІЮПАК спирти називають алканоли або алкоголі.
Гомологічний ряд спиртів:
СН3ОН – метанол
С2Н5ОН – етанол С3Н7ОН – пропанол і т. д.
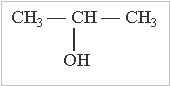
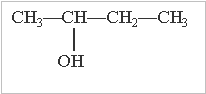
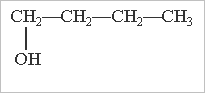
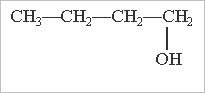
Ізомерія спиртів обумовлена:
будовою карбонового скелету місцем гідроксильної групи
Спрогнозуйте, яка буде кількість ізомерів у спиртів порівняно з алканами: більша чи менша?
У бутану – 2 ізомери, у бутанолу аж 4. Чому?Назви їх складають як у алканів з уточненнями:
- нумерацію починають з кінця, до якого ближча група –ОН
- називаючи головний ланцюг, вказують місце групи –ОН
- додають закінчення – ол
![]() Назвіть спирт
Назвіть спирт
 2,3-диметилбутан-1-ол
2,3-диметилбутан-1-ол
В залежності від того, з скількома вуглеводневими залишками сполучений атом Карбону, що містить гідроксильну групу, спирти поділяють на:
- первинні,
- вторинні,
- третинні.
- Закріплення вивченого матеріалу
-
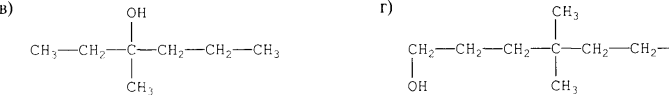

Назвіть спирти і прокласифікуйте їх:
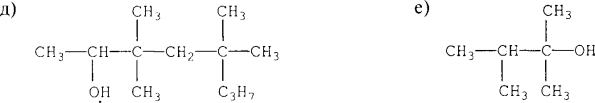
- СН3 – СН – СН – СН2 – СН – СН3
| | |
ОН С2Н5 СН3
- СН3 – СН – СН – СН2 –СН2
| | |
СН3 СН3 ОН
- СН3 –– СН – СН(ОН) – СН – СН - СН2 – СН3
| | |
СН3 – СН2 С3Н7 С2Н5
- Напишіть напівструктурні формули спиртів за назвами:
- 2-метилбутан-1-ол
- 3,3-диетилпентан-2-ол
- 2,3,4-триметилгексан -3-ол
- Виведіть формулу насиченого одноатомного спирту, в якому масова частка Оксигену 15,7% (С6Н13ОН)
7. Домашнє завдання
Вивчити параграф. Виконати вправи.
Задача. Яка сполука має відносну густину пари за повітрям 1,1 і масові частки Карбону, Оксигену і Гідрогену відповідно 37,5%, 50%, 12,5%? (СН3ОН)
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу.
- Вивчення нового матеріалу
Від чого, на вашу думку, залежатимуть властивості спиртів?
Фізичні властивості спиртів
Газоподібних спиртів немає. Чому?
Температури кипіння спиртів вищі, ніж у відповідних вуглеводнів: метанол + 64,5º, етанол +78º, із збільшенням відносної молекулярної маси ці температури підвищуються.Незначно зростає густина - 0,79 – 0,82г/мл. Рідкі спирти леткі, мають специфічний запах.
Перші представники розчинні у воді, а від бутанолу розчинність зменшується. Температури плавлення і кипіння залежать від просторової будови спирту –
спирти лінійної будови киплять при вищій температурі, ніж розгалужені.
Хімічні властивості:
Спирти більш реакційно здатні сполуки, ніж алкани. Чому?
У реакціях бере участь функціональна гідроксильна група.
- окиснення: повне (горіння): С2Н5ОН + 3О2 = 2CO2 + 3H2O неповне (до альдегідів)
- взаємодія з лужними металами: (відбувається за принципом заміщення)
2СН3ОН + 2К = 2СН3ОК + Н2↑
калій етилат
- взаємодія з галогеноводнями:
С3Н7ОН + HBr = С3Н7Br + HОН
бромопропан
- дегідратація:
- внутрішньомолекулярна: (концентрована сульфатна кислота, 180º):
С3Н7ОН = С3Н6 + НОН
пропен
- міжмолекулярна: (концентрована сульфатна кислота, 140º):
СН3ОН + СН3 ОН= СН3ОСН3 + НОН
метоксиметан (діметиловий етер)
Добування спиртів:
- Етанол добувають бродінням глюкози:
С6Н12О6 = 2С2Н5ОН + 2СО2
- Загальні методи добування спиртів:
1. Гідратація алкенів
![]()
6. Закріплення вивченого матеріалу
«Знайди помилку»:
- Спирти мають значно нижчі температури кипіння, ніж відповідні вуглеводні.
- Продукти горіння спиртів – вуглекислий газ і вода.
- Усі спирти добре розчинні у воді.
- Спирти більш активні в хімічних реакціях ніж алкани.
- Спирти легко вступають в реакції з усіма металами.
- Функціональна гідроксильна група визначає більшість властивостей спиртів
Робота в групах
Закінчити рівняння:
1. СН3ОН + О2 =
2. С2Н5ОН + К =
- С4Н9ОН + HBr =
- С3Н7ОН =
-
 Складіть рівняння хімічної реакцій:
Складіть рівняння хімічної реакцій:
- пропан-1-ол + натрій =
- пропан-2-ол + бромоводень =
- внутрішньомолекулярна дегідратація бутанолу
- горіння пентанолу
- При взаємодії насиченого одноатомного спирту масою 7,4 г з натрієм утворилося 1,12 л водню, визначіть формулу спирту. (С4Н9ОН)
- Спирт масою 13 г згорів, утворилося 35,2 вуглекислого газу і 16,2 г води. Густина парів спирту за метаном 8,125. Визначте його формулу, складіть напівструктурні формули 2-3 ізомерів. (С8Н17ОН)
7. Домашнє завдання
Вивчити параграф, виконати вправи.
Випереджаюче завдання. Підготувати повідомлення про застосування гліцеролу
Додаток 1
Варіант 1.
- Назвати спирт, напівструктурна формула якого:
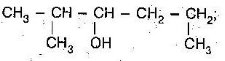
- Скласти напівструктурні формули спиртів за назвою:
- 2,3-диетилгептан -2-ол
- 4-етил-2-метилоктан -3-ол
Варіант 2.
- Назвати спирти, напівструктурні формули яких:
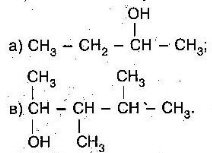
- Скласти напівструктурну формулу спирту за назвою: 2,3-диметилгептан -1-олВаріант 3.
- Назвати спирти, напівструктурні формули яких:
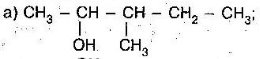
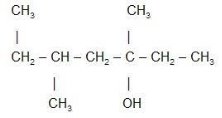
- Скласти напівструктурну формулу спирту за назвою: 3-етил-2-метилпентан -3-ол
Варіант 4.
- Назвати спирти, напівструктурні формули яких:
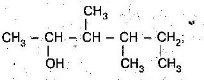
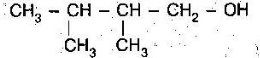
- Скласти напівструктурну формулу спирту за назвою: 3,3-диетилгексан -2-ол
: Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості.
Вивчення нового матеріалу
Існує досить велика кількість спиртів, до складу яких входить дві й більше гідроксильних груп. Їх називають багатоатомними. Характерними представниками багатоатомних спиртів є етиленгліколь і гліцерол.
Етиленгліколь – двохатомний спирт. Гліцерол – представник трьохатомних спиртів.
![]() Зобразіть можливі структурні формули, що відповідають складу етиленгліколюС2Н6О2 та гліцеролу
Зобразіть можливі структурні формули, що відповідають складу етиленгліколюС2Н6О2 та гліцеролу
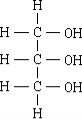 С3Н8О3.
С3Н8О3.
 За систематичною номенклатурою, етиленгліколь має назву етан-1,2-діол, а гліцерол –
За систематичною номенклатурою, етиленгліколь має назву етан-1,2-діол, а гліцерол –
пропан-1,2,3-тріол. У їх молекулах кожний атом Карбону пов’язаний із гідроксильною групою.
Фізичні властивості (самостійна робота з підручником)
За фізичними властивостями гліцерол – це густа сиропоподібна рідина без запаху і кольору, солодка на смак, добре розчинна у воді. Властивості гліцеролу відображає його назва «олійний цукор», вживана у VIII ст., коли гліцерол було вперше добуто з маслинової олії. Гліцерол має високу температуру кипіння 290 °С.
Гліцерол не отруйний, етиленгліколь – сильна отрута.
-
 Чому температури кипіння етиленгліколю та гліцеролу такі високі?
Чому температури кипіння етиленгліколю та гліцеролу такі високі?
- Чим пояснити те, що ці в’язкі органічні речовини
добре розчинні у воді?
Хімічні властивості
Гліцерол вступає у реакції, характерні для одноатомних спиртів.
- Він горить з утвореннямCO2 і води,
![]()
- Взаємодіє з активними металами, утворюючи натрій гліцерат:
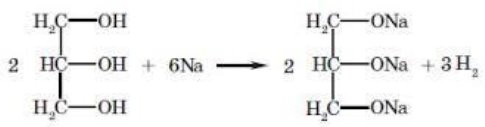
При цьому спостерігається бурхливе виділення водню, який може самозайматися.
- Реагує з галогеноводнями.
СН2ОН – СНОН – СН2ОН + НBr = СН2ОН – СНОН – СН2 Br +
Н2О
- Взаємодіє з нітратною кислотою:
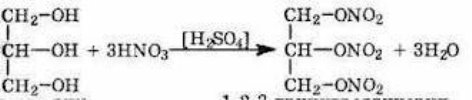
При взаємодії гліцеролу з нітратною кислотою утворюється важка масляниста, сильно вибухова речовина – тринітрогліцерол:
- Характерною реакцією гліцеролу є утворення синього розчину при
взаємодії з купрум(ІІ) гідроксидом Cu(OH)2.
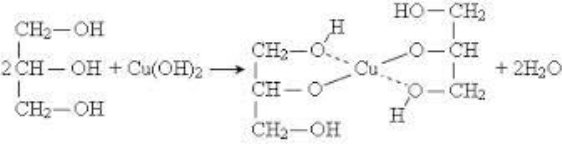
При цьому утворюється блакитний купрум (ІІ) гліцерат
Застосування багатоатомних спиртів
Повідомлення учнів про застосування гліцерину у різних галузях
Гліцерол має широке застосування. Завдяки гігроскопічності він використовується у парфумерії та фармації як зм’якшувальний засіб, основа для мазей, добавка до мила.
У харчовій промисловості – як добавка до напоїв.
У шкіряному виробництві та текстильній промисловості гліцерол використовують для обробки пряжі та шкіри, щоб надати їм м’якості, еластичності.
Гліцерол застосовують для виробництва синтетичних смол і вибухових речовин, наприклад, нітрогліцерину. Нітрогліцерин використовується для виготовлення динаміту.
Спиртовий розчин нітрогліцерину має судинорозширювальну дію. Його використовують як ліки при захворюванні серця.
- Закріплення вивченого матеріалу
Гра «Слабка ланка». Закінчити речення:
-
 Багатоатомними називають спирти, які мають…
Багатоатомними називають спирти, які мають…
- Представником трьохатомних спиртів є…
- При горіння багатоатомних спиртів утворюються….
- Гліцерол у воді …
- Реактивом на багатоатомні спирти є …
Задача. Який об’єм водню можна добути при взаємодії 4 моль гліцерину з надлишком натрію? (134,4 л)
- Домашнє завдання
Вивчити параграф. Виконати вправи.
Підготувати повідомлення про застосування та отруйність спиртів.
Пара 11
Тема пари: Фенол: склад і будова молекули, фізичні та хімічні властивості.
Мета пари:
навчальна: розглянути склад, будову, властивості фенолу, пояснити взаємний вплив атомів на прикладі фенолу, розширити знання учнів про номенклатуру органічних сполук, дати уявлення про охорону навколишнього середовища від відходів, що містять фенол;
розвиваюча: розвивати вміння порівнювати, узагальнювати;
виховна: виховувати відповідальне ставлення свого здоров’я, бережливе ставлення до природи.
Очікувані результати навчання
Знаннєвий компонент
Студент пояснює вплив характеристичної (функціональної) групи на фізичні і хімічні властивості оксигеновмісних органічних сполук.
Діяльнісний компонент
студент складає молекулярні і структурні формули фенолу; рівняння реакцій, які описують хімічні властивості фенолу (взаємодія з лужними металами, лугами, бромною водою);
порівнює будову і властивості сполук з різними характеристичними групами, одноатомних спиртів і фенолу;
прогнозує хімічні властивості оксигеновмісних органічних сполук на основі знань про властивості характеристичних (функціональних) груп;
установлює причинно-наслідкові зв’язки між складом, будовою, властивостями, застосуванням і впливом на довкілля оксигеновмісних органічних сполук;
дотримується правил безпечного поводження з органічними речовинами.
Ціннісний компонент
студент робить висновки щодо властивостей оксигеновмісних органічних речовин на підставі їхньої будови і про будову оксигеновмісних речовин на підставі їхніх властивостей; на основі спостережень;усвідомлює взаємозв’язок складу, будови, властивостей, застосування оксигеновмісних органічних речовин і їхнього впливу на довкілля; необхідність охорони довкілля від промислових відходів, що містять фенол;
оцінює безпечність органічних речовин і приймає обґрунтоване рішення щодо їхнього використання.
Тип пари: пара засвоєння нових знань
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: модель молекули фенолу.
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
 Письмове опитування за різними варіантами (додаток 1.) Усне опитування:
Письмове опитування за різними варіантами (додаток 1.) Усне опитування:
- Порівняйте одноатомні та багатоатомні спирти: що подібного та відмінного у будові та властивостях?
- Яким чином експериментально розрізнити воду, етанол, гліцерин?
- Які властивості: кислотні чи основні, виявляють спирти?
- Мотивація навчальної діяльності
Речовина, про яку ми сьогодні поговоримо, може бути і другом, лікуючи та будучи сировиною для пластмас, фарб, і водночас страшним ворогом, отруюючи все живе. Що ж це?
- Повідомлення теми уроку
- Вивчення нового матеріалу
Феноли – органічні речовини, в молекулах яких гідроксильні групи сполучені з бензольним кільцем.
Як і спирти, феноли залежно від кількості гідроксогруп бувають:одноатомні
- двоатомні
- багатоатомні.
 Одноатомний фенол або гідроксибензол:
Одноатомний фенол або гідроксибензол:
С6Н5ОН - молекулярна формула
- напівструктурна формула
В молекулі фенолу відбувається втягування електрону Оксигену у спільну π-електронну хмару
 бензенового кільця, за рахунок чого зв'язок С-О стає міцніший. Водночас атом Оксигену, компенсуючи цю втрату електрона, сильніше притягує до себе електронну пару від Гідрогену, тому зв'язок О-Н стає більш полярним і може розриватися. Цим можна пояснити прояв слабких кислотних властивостей, через які розчин фенолу ще називають карболовою кислотою.Гідроксильна група, в свою чергу, змінює бензенове кільце, підвищуючи його електронну густину в орто- і пара-положеннях, де легше відбуваються реакції заміщення.
бензенового кільця, за рахунок чого зв'язок С-О стає міцніший. Водночас атом Оксигену, компенсуючи цю втрату електрона, сильніше притягує до себе електронну пару від Гідрогену, тому зв'язок О-Н стає більш полярним і може розриватися. Цим можна пояснити прояв слабких кислотних властивостей, через які розчин фенолу ще називають карболовою кислотою.Гідроксильна група, в свою чергу, змінює бензенове кільце, підвищуючи його електронну густину в орто- і пара-положеннях, де легше відбуваються реакції заміщення.
Фізичні властивості фенолу:
спрогнозуйте самі:
- агрегатний стан
-
розчинність у воді
-
 температури плавлення і кипіння (+41º і +182º)
температури плавлення і кипіння (+41º і +182º)
-
Фенол дуже отруйний
Спричиняє опіки шкіри, органів дихання, ураження травного тракту, нервової системи, особливо чутливі печінка та нирки
Як ви гадаєте, яким чином вплине будова фенолу на його властивості? З ким фенол виявлятиме подібність у хімічних властивостях?
Хімічні властивості фенолу
|
Реакції за участю гідроксогрупи |
Реакції бензольного кільця |
|
Взаємодія з металами С6Н5ОН + Na = С6Н5ОNa + H2 – натрій фенолят Взаємодія з лугами С6Н5ОН + NaОН = С6Н5ОNa + H2О |
1. Взаємодія з бромною водою (якісна реакція)
(С6Н5ОН + 3Br2 =С6Н2Br3ОН↓ + 3HBr) (білий осад) |
Добування фенолу:
- етап: хлорування бензену ( FeCl3) С6Н6 + Cl2 = С6Н5Cl + HCl
- етап: реакція з концентрованим розчином лугу при тиску і нагріванні С6Н5Cl + NaОН(конц) = С6Н5ОН + NaCl
Застосування фенолу:
- виробництво пластмас,
- лікарських засобів (дезинфікатори - 5% - розчин – карболова кислота)
- синтетичних волокон
- барвників
- вибухових речовин
Широке використання фенолу призводить до його викидів у довкілля, а отже до отруєння тваринного і рослинного світу.
Заходи щодо зменшення впливу фенолу на довкілля:
- біохімічний метод – процес розкладу за участю мікроорганізмів
- адсорбційний метод – використовується активоване вугілля
- нейтралізація лугами
- окиснення в нешкідливі речовини
- Закріплення вивченого матеріалу
Фронтальна бесіда:
- Які відмінності у властивостях фенолу і спиртів, фенолу і бензену?
- Поясніть взаємозв’язок будови та властивостей фенолу. Чому його назва карболова кислота?
- Яким чином відрізнити речовини: гліцерин, фенол, етанол?
Самостійна робота
![]() Задачі
Задачі
- Яку масу розчину натрій гідроксиду з масовою часткою лугу 20% потрібно взяти для нейтралізації розчину фенолу масою 200 г, масова частка фенолу у якому 23,5%? (100 г)
- Домашнє завдання
Вивчити параграф, виконати вправи
Додаток 1
Варіант 1.
1.Напишіть формулу спирту:
a) 3,3 – диетилпентан-2-ол b) бутан–1,3-діол 2.Закінчіть рівняння, назвіть продукти реакції:
- С2Н5ОН + О2 =
- С4Н9ОН + К =
- С3Н7ОН =
3.При взаємодії 40,8 г насиченого одноатомного спирту з натрієм виділилось 4,48 л водню, визначте формулу спирту
- ол
Варіант 2
- Напишіть формулу спирту:
a) 4-етил-2-метилгексан-
- Закінчіть рівняння:
- СН3ОН + О2 =
- С2Н5ОН + Na =
- пропан–1,2 -діол
- С4Н9ОН =
- При взаємодії 0,46 г насиченого одноатомного спирту з натрієм виділилось 0,112 л водню, визначте формулу спирту.
|
|
Варіант |
|
3. |
|
1. |
Напишіть формулу спирту: |
|
|
|
a) |
2,3 – диметилпентан-1,2-діол |
|
|
|
b) |
2,2 – диетил-3-пропілгексан–1-ол |
|
|
|
2. |
Напишіть рівняння реакцій: |
|
|
|
a) |
етанол + кисень = |
|
|
|
b) |
бутанол + хлороводень= |
|
|
|
c) |
гліцерол + калій = |
|
|
|
d) |
внутрішньомолекулярна |
дегідратація |
пентанолу |
3. При взаємодії насиченого одноатомного спирту масою 59,2 г з металічним калієм утворилося 8,96 л водню. Визначте формулу спирту та обчисліть, яку масу алкену можна добути при його дегідратації.
Варіант 4.
- Напишіть формулу спирту:
- 4,4 – диетил-3-метилгептантан-2-ол
- 3-пропілгексан–1,2,4-тріол
- Напишіть рівняння реакцій:
- гліцерин + натрій=
- гідроген хлорид + бутанол =
- міжмолекулярна дегідратація бутанолу
- пропанол + хлороводень =
- При взаємодії 7,4 г насиченого одноатомного спирту з натрієм виділилось 1,12 л водню. Визначте формулу спирту, складіть формули його ізомерів, назвіть їх.
Пара 12
Тема пари: Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна)група. Загальна та структурні формули, систематична номенклатура і фізичні властивості альдегідів.
Мета пари:
навчальна: сформувати в учнів уявлення про розмаїтість оксигеновмісних органічних сполук на прикладі альдегідів, розширити поняття «функціональна група» на прикладі карбонільної функціональної групи, розглянути склад, електронну і структурну формулу альдегідів, сформувати в учнів знання про гомологічний ряд альдегідів, ознайомити їх з номенклатурою та фізичними властивостями, сформувати вміння називати альдегіди за систематичною номенклатурою та складати структурні формули за їх назвою;
розвиваюча: розвивати логічне мислення, вміння порівнювати, узагальнювати;
виховна: виховувати цілеспрямованість, наполегливість.
Очікувані результати навчання
Знаннєвий компонент
Студент називає загальну формулу та характеристичну (функціональну) групу альдегідів; за систематичною номенклатурою альдегіди;
пояснює вплив характеристичної (функціональної) групи на фізичні властивості оксигеновмісних органічних сполук; водневого зв’язку на фізичні властивості оксигеновмісних органічних сполук;
наводить приклади альдегідів і їхні тривіальні назви.
Діяльнісний компонентстудент класифікує оксигеновмісні органічні сполуки за характеристичними групами;
складає молекулярні і структурні формули альдегідів (за назвами і загальною формулою відповідного гомологічного ряду);
дотримується правил безпечного поводження з органічними речовинами.
Тип пари: пара засвоєння нових зань
Форми роботи: фронтальна робота, самостійна робота студенти.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: набір для складання кулеcтержневих моделей молекул.
Хід пари
- Організаційний етап
- Актуалізація опорних знань
 Бесіда:
Бесіда:
- Які особливості спиртів порівняно з вуглеводнями?
- Чим це обумовлено?
- Що таке функціональна група?
- Мотивація навчальної діяльності
Вам відомо, що багато вологих біологічних об’єктів зберігають законсервованими. У чому ж їх зберігають? Чому вони не псуються? Відповідь криється у речовинах, які ми сьогодні розпочнемо вивчати.
- Повідомлення теми уроку
- Вивчення нового матеріалу
Сама назва «альдегіди» означає «алкоголь дегідрований», тобто без кількох атомів Гідрогену.
Наприклад,
СН3-СН2-ОН → СН3-СОН
спирт альдегід
Альдегіди – органічні речовини, в яких карбонільна група –СОН сполучена з вуглеводневим радикалом.
СН3-СОН
вуглеводневий радикал карбонільна група
R-СОН, СnH2n+1COH - загальні формули альдегідів
Будова карбонільної групи:
δ+ δ- Н – С=О
| Н
- Чим відрізняється подвійний зв'язок у алкенів і альдегідів?Подвійний зв'язок у альдегідів розміщений нерівномірно, електронна густина зміщена до атома Оксигену, атом Карбону набуває позитивного заряду, саме це обумовлює підвищену активність карбонільної групи.
Гомологічний ряд альдегідів
Назви альдегідів походять від назв насичених вуглеводнів + аль, перші представники мають також історичні назви.
Метаналь - НСОН - мурашиний альдегід (формальдегід, 40%-й розчин - формалін)
Етаналь - СН3СОН – оцтовий альдегід Пропаналь - С2Н5СОН – пропіоновий альдегід Бутаналь - С3Н7СОН – масляний альдегід Пентаналь - С4Н9СОН – валеріановий Гексаналь - С5Н11СОН
Гептаналь - С6Н13СОН Октаналь - С7Н15СОН Нонаналь - С8Н17СОН Деканаль - С9Н19СОН
Зверніть увагу: назва альдегідів включає в себе також атоми Карбону карбонільної групи
Ізомерія в альдегідів буває лише за: СН3
| будовою карбонового скелету СН3–СН2–СН2–СОН або СН3 – СН– СОН. Чому?
Номенклатура альдегідів
Назви альдегідів складають як у спиртів з уточненнями:
- нумерацію починають з кінця, до якого ближча група –СОН, і цей атом Карбону нумерують першим
- перелічують локанти (місця) і назви замісників в алфавітному порядку
- при назві головного ланцюга додають закінчення –аль
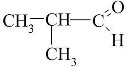 2 - метилпропаналь
2 - метилпропаналь
![]() Чи потрібно вказувати місце групи –СОН?
Чи потрібно вказувати місце групи –СОН?
Більше чи менше ізомерів буде в альдегідів, порівняно з спиртами? Доведіть.
![]() Бесіда:
Бесіда:
Як ви гадаєте, як зміняться фізичні властивості альдегідів порівняно з спиртами?
- агрегатний стан (метаналь газ, решта леткі)
- густина
- запах (різкий, неприємний у газів і рідин)
- температури плавлення і кипіння (нижчі, тому що відсутні водневі зв’язки)
- розчинність у воді (лише перші представники розчинні)Закріплення вивченого матеріалу
Фронтальна робота:
-
 Які особливості в будові альдегідів порівняно з спиртами?
Які особливості в будові альдегідів порівняно з спиртами?
- Назвіть речовини:
а) 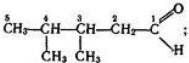 б)
б) 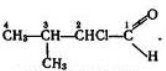
в)СН3 – СН – СН – СН2 – СН – СОН
| | |
СН3 С2Н5 СН3
г)СН3 –– СН – СН – СН – СН - СН2 – СОН
| | | | СН3 – СН2 СН3 С3Н7 С2Н5
- Напишіть напівструктурні формули за назвами:
- 2,3,3-триметилбутаналь
- 3,3-диетилпентаналь
c) 2,3,3-триетил-4,4- дипропілоктаналь
- Зобразіть можливі ізомери, склад яких С5Н10О. До якого класу належить дана сполука?
7. Домашнє завдання
Вивчити параграф, виконати вправи.
Хімічні властивості етаналю, його одержання.
Вивчення нового матеріалу
Більшість альдегідів – отруйні речовини (особливо метаналь)
Хімічні властивості:
- горіння
2СН3-СОН + 5О2 = 4СО2 + 4Н2О
- гідрування (відновлення) до спиртів:
Ni
СН3СОН + Н2 → СН3-СН2-ОН
- окиснення (якісні реакції) (демонстрація)
- «срібного дзеркала»
СН3-СОН + Ag2O → СН3-СООН + 2Ag↓
- «мідного дзеркала»
СН3-СОН + 2Cu(OH)2 → СН3-СООН + 2CuOH↓ + H2O
жовтий осад (Cu2O↓ + H2O)
червоний осад
Добування альдегідів:
- Окиснення етилену (етаналь): PdCl2
СН2=СН2 + [О]→ СН3-СОН
- Реакція Кучерова (в присутності солей ртуті) –добувають етаналь: Hg2+
СН≡СН + НОН → [Н2С=СН-ОН] → СН3-СОН
- Дегідрування спиртів:
t, Cu
СН3-СН2-ОН → СН3-СОН + Н2
- Окиснення спиртів:
СН3-СН2-ОН + CuO → СН3-СОН + Н2O + Cu
Застосування альдегідів
![]() (самостійна робота учнів з підручником)
(самостійна робота учнів з підручником)
Бесіда за результатами роботи: Виділіть найголовніші галузі застосування альдегідів
- З якими властивостями альдегідів пов’язане їх застосування?
- Проаналізуйте корисні властивості альдегідів і їх негативний вплив на організм людини.
- Закріплення вивченого матеріалу
 Робота за індивідуальними завданнями:
Робота за індивідуальними завданнями:
- Здійснити перетворення:
СаС2 - C2H2 - CH3COH - C2H5OH – C2H4 - CO2
- Добути двома способами:
- пропаналь
-
бутаналь
- Альдегід масою 2,15 г окиснили амоніачним розчином арґентум (І) оксиду, утворилося 5,4 г срібла. Визначте формулу альдегіду і відповідної кислоти. (С4Н9СОН)
- До складу органічної речовини входять: 54,54% Карбону, 9,1 % - Гідрогену і Оксиген. Відносна густина парів за киснем 2,75. Визначте молекулярну формулу, складіть формули можливих ізомерів. (С3Н7СОН)
7. Домашнє завдання
Вивчити параграф, виконати вправи
Пара 14 практичне заняття №2
Розрахункові задачі. 4. Обчислення за хімічними рівняннями кількості речовини, маси або об’єму за кількістю речовини, масою або об’ємом реагенту, що містить певну частку домішок.
Мета пари:
навчальна: сформувати вміння та навички розв’язування задач за рівняннями хімічних реакцій, у яких реагенти містять домішки.
розвиваюча: розвивати вміння порівнювати, робити висновки, узагальнювати;
виховна: виховувати цілеспрямованість, самостійність.
Очікувані результати навчання
Діяльнісний компонент
учень обчислює за хімічними рівняннями кількість речовини, масу або об’єм за кількістю речовини, масою або об’ємом реагенту, що містить певну частку домішок, обґрунтовуючи обраний спосіб розв’язання.
Тип пари: пара формування вмінь та навичок
Форми роботи: фронтальна робота, самостійна робота учнів, робота в групах Методи навчання: словесні (бесіда, пояснення), практичні (виконання вправ). Обладнання: моделі молекул вуглеводнів, картки із завданнями
Хід пари
- Організаційний етап
- Перевірка домашнього завданняПисьмове опитування (Додаток 1.)
- Мотивація навчальної діяльності
Чистих речовин у природі практично немає. Речовини дуже часто містять домішки, тому, під час обчислень маси, кількості речовини та об’єму продукту реакції необхідно враховувати кількість домішок у вихідних речовинах. Навчимося розв’язувати такі задачі.
- Повідомлення теми уроку
- Вивчення нового матеріалу
Особливість задач на домішки полягає в тому, що в умові задачі вказується маса вихідної речовини, що містить певну масову частку домішок. Отже вихідна речовини є суміш. Для розв’язування задачі спочатку потрібно обчислити масу домішок і масу чистої речовини.
Математичний вираз масової частки домішок:
![]()

![]() m(домішок)*100%
m(домішок)*100%
![]() доміш =
доміш =
m(суміші)
Для обчислень також можна скористатися виразом:
W(чистої речовини) = 100% - W(домішок)
І. Розрахунки за хімічними рівняннями, де вихідна речовина містить певну частку домішок.
Приклад 1.
Задача . Визначити масу оцтового альдегіду, який можна добути з 2 кг технічного етилового спирту, що містить 15% домішок.
Дано: Розв’язання:
m (спирту) = 2 кг 1. Зясовуємо масову частку чистого спирту у технічному зразку
W(дом.) = 8% W(спирту) = 100% - 8% = 92% (0,92)
Знайти: Обчислюємо його масу
m (СН3СОН) -? m(спирту) = m(суміші) . W(спирту) == 2 кг . 0,92 = 1,84 кг
=1840 г
2. За рівнянням розраховуємо масу отриманого альдегіду 1840 г х г
СН3-СН2-ОН + CuO → СН3-СОН + Н2O + Cu
ν= 1 моль ν =1 моль
М =46 г/моль М=44 г/моль
m= 46 г m= 44 г
З 1840 г спирту утвориться Х г альдегіду з 46 г спирту утвориться 44 г альдегіду
Х = (1840 . 44) : 46 = 1760 г
Відповідь: m (СН3СОН) = 1760 г
ІІ. Визначення масової частки домішок у речовині
Приклад 2.
Технічний етаналь масою 2,5 г окиснили амоніачним розчином арґентум (І) оксиду. При цьому утворилося 10,8 г металічного срібла. Обчисліть масову частку домішок у технічному альдегіді.
Дано: Розв’язання:
m (етаналю з дом.) = 2,5 г 1. Обчислюємо за рівнянням масу чистого етаналю у зразку
m(Аg) = 10,8 г Х г 10,8 г
Знайти: СН3-СОН + Ag2O → СН3-СООН + 2Ag↓
W (домішок) -? ν= 1 моль ν =2 моль
М =44 г/моль М=108 г/моль m= 44 г m= 216 г
З Х г альдегіду утвориться 10,8 г срібла
з 44 г альдегіду утвориться 216 г срібла Х = (10,8. 44) : 216 = 2,2 г
- Оскільки маса етаналю 2,2 г, то маса домішок становить:
m (домішок) = m(суміші) - m (чистої речовини) = 2,5 г – 2,2 г = 0,3 г
- Обчислюємо масову частку домішок за формулою:
W(дом.) = m(дом.) : m(суміші);
W(домішок) = 0,3/2,5 = 0,12 = 12%
Відповідь: W (домішок) = 12 %
ІІІ. Обчислення маси реагентів з певним вмістом домішок, необхідних для отримання вказаної кількості продукту реакції
Приклад 3.
Яку масу технічного етаналю з вмістом домішок 10% потрібно взяти для реакції
«срібного дзеркала», щоб отримати 54 г металічного срібла
Дано: Розв’язання:
m(Аg) = 54 г 1. Обчислюємо за рівнянням масу чистого етаналю
W(дом.) = 10% Х г 54 г
Знайти: СН3-СОН + Ag2O → СН3-СООН + 2Ag↓
m (етаналю) -? ν= 1 моль ν =2 моль
М =44 г/моль М=108 г/моль m= 44 г m= 216 г
З Х г альдегіду утвориться 54 г срібла
з 44 г альдегіду утвориться 216 г срібла Х = (54. 44) : 216 = 11 г
Оскільки масова частка домішок 10%, то вміст етаналю становитиме 90%.
Відповідно масу його з домішками можна обчислоти, виходячи з наступної пропорції: 11 г чистого етаналю становить 90%
Х г технічного етаналю з домішками становитиме 100% Х = (11. 100) : 90 = 12,2 г
Відповідь: m (технічного етаналю) = 12,2 г
6. Розв’язування тренувальних вправ (робота в парах)
- Яку масу натрій феноляту можна отримати в результаті взаємодії технічного фенолу масою 20 г, що містить 6% домішок, з натрій гідроксидом? (23,2 г)
- Який об’єм етену можна отримати при дегідратації 50 г спирту, що містить 8% домішок? (22,4 л)
- На окиснення технічного етаналю масою 10 г витратили амоніачний розчин, що містив 46,4 г арґентум (І) оксиду. Обчисліть вміст домішок у альдегіді (12%)
- Технічний фенол масою 10 г повністю прореагував з натрієм. При цьому утворилося 1,12 л газу. Обчисліть масову частку домішок у технічному фенолі. (6%)
- Яку масу технічного оцтового альдегіду з вмістом домішок 20% потрібно відновити воднем для отримання 230 г етилового спирту? (275 г)
- Яку масу технічного етилового спирту (вміст домішок 15%) потрібно окиснити для добування 8,8 г етаналю? (10,1 г)
- Домашнє завдання
Вивчити параграф, виконати вправи.
Яку масу етаналю можна отримати з 1368 г етину, що містить 5 % домішок ?
(2200г)
Додаток 1
Варіант 1
- Вкажіть формулу пропаналю:
С3Н8О С2Н5СОН НСОН С3Н7СОН
- Альдегіди складаються з таких груп:
- вуглеводневого радикалу і карбонільної групи
- вуглеводневого радикалу і гідроксильної групи
- гідроксильної і карбонільної групи
- вуглеводневого радикалу і карбоксильної групи
- Метаналь використовують:
- для виготовлення вибухівки
- для консервування біологічних препаратів
- для дезінфекції медичних інструментів
- для виготовлення поліетилену;
- Розташуйте речовини із зростанням їх розчинності у воді:
- пропаналь
- метаналь
- Складіть формули сполук за назвою:
- 2-метил-3-хлорбутаналь
- 3,3-диметилбутаналь
- бутаналь
- пентаналь
- Відносна густина альдегіду за киснем 3,125. Визначте його формулу.
Варіант 2
- Які з перелічених сполук добре розчинні у воді (кілька відповідей):
- етанол
- етаналь
- Альдегіди застосовують:
- як паливо
- у медицині;
- метаналь
- октаналь
e) гептаналь
- для виготовлення меблів;
- для виготовлення
c) для добування спиртів штучного волокна
- Як називається функціональна група альдегідів
- гідроксильна
- карбонільна
- карбоксильна
- альдегідна
- Розташуйте сполуки їх збільшенням їх температури кипіння:
пентаналь етаналь
метаналь гексаналь
- Напишіть формули сполук за назвою:
- 4-етил-3-метилгексаналь
- 2,3,3-трихлорбутаналь
- Відносна густина альдегіду за воднем 57. Визначте його формулу.
Варіант3
- Речовина, якою можна виявити альдегід, це:
a) бром, b) водень, c) натрій, d) купрум (ІІ) гідроксид
- З якими речовинами реагуватимуть альдегіди (кілька відповідей):
- Na;
- Ag2O
- Сu(OH)2
- CH3OH;
- Н2
- Розташуйте альдегіди із зростанням їх відносних молекулярних мас:
a) октаналь b) гептаналь
|
c) 4. |
пентаналь Напишіть формули сполук за назвами: |
d) |
пропаналь |
|
a) |
3-етил-4,4-диметилгептаналь |
|
|
|
b) |
4-бром-3,3-диметилпентаналь |
|
|
|
5. a) b) |
Закінчіть рівняння реакцій: CH3COH + H2 = C2H5COH + Аg2O= |
c) |
CH3COH + O2 |
6. Відносна густина за воднем альдегіду 29. Визначте його формулу.
Варіант 4
- Виберіть формулу бутаналю:
- C3H7OH
- C3H7COOH
- С3Н7СОН
- CH3COH
- З якими речовинами реагуватиме оцтовий альдегід:
- сульфур (VI) оксид
- арґентум (І) оксид
- метиловий спирт
- кисень
- нітратна кислота
- водень
- Яким чином можна відрізнити мурашиний альдегід, етанол, гліцерин?
- Розташуйте речовини в генетичний ланцюжок для добування альдегіду:
- етен
- етаналь
- Напишіть формули сполук за назвою:
- 2,4-диетил-2-хлорпентаналь
- 4,4 – диетил-2,3,5-триметилгексаналь
- Закінчіть рівняння реакцій :
- CH3COH + Ag2O =
- C2H5COH + О2 =
- етанол
- етан
- HCOH + H2 =
Пара 13
Тема пари: Карбонові кислоти, їх поширення в природі та класифікація. Карбоксильна характеристична (функціональна)група. Склад, будова молекул насичених одноосновних карбонових кислот, їхня загальна та структурні формули, ізомерія, систематична номенклатура і фізичні властивості.
Мета пари:
навчальна: ознайомити зі складом, будовою номенклатурою нового класу органічних речовин – карбоновими кислотами, з’ясувати будову карбоксильної групи, розкрити взаємний вплив карбоксильної та вуглеводневої групи, сформувати в учнів знання про гомологічний ряд насичених одноосновних карбонових кислот, ознайомити їх з номенклатурою та фізичними властивостями;
розвиваюча: розвивати логічне мислення, вміння порівнювати;виховна: виховувати самостійність учнів. Очікувані результати навчання Знаннєвий компонент
студент називає загальну формулу та характеристичну (функціональну) групу карбонових кислот; за систематичною номенклатурою насичені одноосновні карбонові кислоти;
пояснює вплив характеристичної (функціональної) групи на фізичні властивості оксигеновмісних органічних сполук; водневого зв’язку на фізичні властивості оксигеновмісних органічних сполук;
наводить приклади насичених одноосновних карбонових кислот і їхні тривіальні назви; поширення оксигеновмісних органічних сполук у природі і харчових продуктах
Діяльнісний компонент
пари класифікує оксигеновмісні органічні сполуки за характеристичними групами;
складає молекулярні і структурні формули насичених одноосновних карбонових кислот (за назвами і загальними формулами відповідних гомологічних рядів);
дотримується правил безпечного поводження з органічними речовинами.
Ціннісний компонент
студент оцінює безпечність органічних речовин і приймає обґрунтоване рішення щодо їхнього використання.
Тип пари: пара засвоєння нових знань
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: зразки продуктів, що містять органічні кислоти
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
Розв’язати задачі:
- Яка маса кислоти утвориться при окисненні арґентум (І) оксидом технічного етаналю масою 25 г , якщо вміст домішок у ньому становить 12%? (30 г)
- З технічного етанолу масою 5 г отримали етаналь кількістю речовини 0,1 моль. Обчисліть вміст домішок у етанолі (8%)
- Актуалізація опорних знань
![]() Бесіда:
Бесіда:
- Пригадайте вивчені класи оксигеновмісних сполук
- Назвіть їх функціональні групи.
- Як вони впливають на властивості речовин?
- Мотивація навчальної діяльності
Сьогодні ми розпочинаємо вивчення речовин, яких можна назвати «Знайомі незнайомці»
Здогадайтесь, про кого мова.
Для цього перед вами набір продуктів: лимон, столовий оцет, кефір, яблуко. Що в них спільного?
- Повідомлення теми уроку
- Вивчення нового матеріалу
Карбоновими кислотами називаються органічні речовини, молекули яких містять одну або кілька карбоксильних груп ![]() , сполучених з вуглеводневим радикалом.
, сполучених з вуглеводневим радикалом.
Назва карбоксил походить від двох слів: «карбоніл» і «гідроксил» так як кислотну групу можна розглядати як поєднання цих двох груп.
![]()
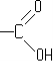
![]()
карбоніл- -карбоксил -гідроксил
 Класифікація карбонових кислот
Класифікація карбонових кислот
За числом карбоксильних груп:
За типом зв’язків
За кількістю атомів Карбону
- одноосновні СН3–COOH
- двохосновні
COOH—COOH і т.д.
- насичені СН3—СООН
- ненасичені
СН2 = СН—СООН
- нижчі (до 10 атомів Карбону) СН3–COOH
- вищі (більше 10) С17Н35СООН
Основність кислот визначається числом в них карбоксильних груп. Так, наприклад, одноосновні кислоти містять одну карбоксильну групу, двохосновні - дві карбоксильні групи.
Ми розглянемо карбонові кислоти, у молекулах яких міститься одна карбоксильна група і насичений вуглеводневий радикал. Такі кислоти називаються насиченими одноосновними.
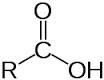 CnH2n+1COOH або R–COOH - загальна формула насичених одноосновних кислот
CnH2n+1COOH або R–COOH - загальна формула насичених одноосновних кислот
Склад насичених одноосновних карбонових кислот можна ще виразити так: CnH2nO2
Будова карбоксильної групи
![]() Порівняйте електронегативність елементів, що утворюють карбоксильну групу: як відбудеться перерозподіл електронної
Порівняйте електронегативність елементів, що утворюють карбоксильну групу: як відбудеться перерозподіл електронної
густини?
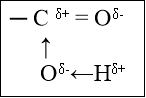 В карбоксильній групі електронна густина зміщена до атома Оксигену у зв’язку –С=О, за рахунок цього на атомі Карбону виникає надлишок позитивного заряду, тому сюди зміщується послідовно електронна густина атома Оксигену і Гідрогену групи –ОН. В результаті зв'язок –ОН стає більш полярний і легко відривається, що визначає кислотні властивості карбоксильної групи.
В карбоксильній групі електронна густина зміщена до атома Оксигену у зв’язку –С=О, за рахунок цього на атомі Карбону виникає надлишок позитивного заряду, тому сюди зміщується послідовно електронна густина атома Оксигену і Гідрогену групи –ОН. В результаті зв'язок –ОН стає більш полярний і легко відривається, що визначає кислотні властивості карбоксильної групи.
Гомологічний ряд карбонових кислот. Номенклатура та ізомерія.
Для найпоширеніших карбонових кислот часто використовують такі історичні назви як мурашина, масляна, валеріанова тощо. Ці назви пов’язані переважно з тими джерелами, з яких була виділена та чи інша кислота: мурина – з мурашок, оцтова – з оцту, масляна – з масла. За систематичною номенклатурою, назву кислот утворюють із назв відповідних насичених вуглеводнів, додаючи до них суфікс і закінчення - ова і слово кислота.
Зверніть увагу: назва кислот включає в себе також атоми Карбону карбоксильної групи
НСООН - мурашина (метанова кислота); ![]()
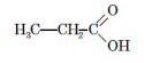 СН3СООН - оцтова (етанова кислота);
СН3СООН - оцтова (етанова кислота); ![]()
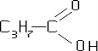
С2Н5СООН - пропіонова (пропанова кислота); С3Н 7 СООН - масляна (бутанова кислота) і т .д.
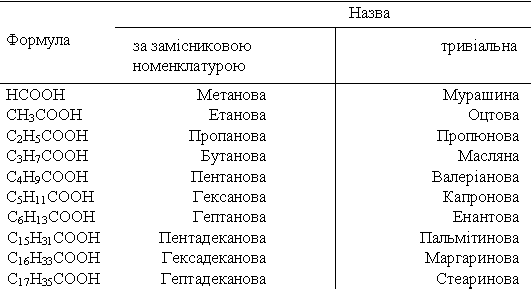
Ізомерія карбонових кислот, як і у випадку альдегідів, обумовлена ізомерією вуглеводневих радикалів.
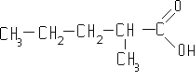 2-метилпентанова кислота
2-метилпентанова кислота
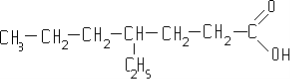 4-етилгептановая кислота
4-етилгептановая кислота
Чому у кислот немає ізомерії розташування функціональної групи?
Фізичні властивості карбонових кислот
(самостійна робота з підручником з наступним обговоренням)
Як ви гадаєте, як зміняться фізичні властивості кислот порівняно з альдегідами:
- агрегатний стан (нижчі представники насичених одноосновних кислот (до пропіонової кислоти включно) представляють собою при звичайних умовах дуже рухливі рідини з різким запахом)
- температури плавлення і кипіння (оцтова кислота кипить при 118,5 º С. При температурі нижче +16,6ºС (температура плавлення) безводна оцтова кислота твердне у вигляді кристалів, схожих на лід; внаслідок цього безводна оцтова кислота отримала назву льодяної оцтової кислоти)
-
розчинність у воді (перші три представники змішуються з водою в будь-яких співвідношеннях, наступні - маслянисті рідини з неприємним запахом, обмежено розчинні у воді, вищі кислоти - тверді речовини, нерозчинні у воді)
-
 Метаналь – газ, чому ж метанова кислота – рідина, а оцтова кислота при +16 ºС кристалізується?
Метаналь – газ, чому ж метанова кислота – рідина, а оцтова кислота при +16 ºС кристалізується?
- Більшість органічних сполук у воді нерозчинні. З чим пов’язана висока розчинність у воді перших представників кислот і
-
нерозчинність вищих кислот?
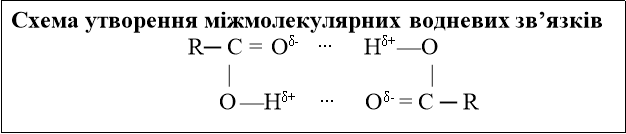 На властивості кислот визначальний вплив має карбоксильна група.
На властивості кислот визначальний вплив має карбоксильна група.
У яких сполуках спостерігалося подібне явище?
- Закріплення вивченого матеріалу
Індивідуальна робота
-
 Назвіть речовини:
Назвіть речовини:
- СН3 – СН(СН3)– СН2 – СООН
- СН3 – СН – СН – СН2 – СН – СООН
| | |
СН3 С2Н5 СН3
- СН3 –– СН – СН – СН – СН - СН2 – СООН
| | | | СН3 СН3 С3Н7 С2Н5
- Напишіть напівструктурні формули за назвами:
2,3,3-триметилбутанова кислота 3,3-диетилпентанова кислота
2,3,3-триетил-4,4-дипропілоктанова кислота
- Зобразіть можливі ізомери, склад яких С5Н10О2. До якого класу належить дана сполука?
- Задача. Виведіть формулу одноосновної насиченої кислоти, в якій: а) масова частка Оксигену 31,37%. (С4Н9СООН)
б) відносна густина парів за киснем 3,625 (С5Н11СООН)
Якщо можливо, складіть формули її ізомерів.
8. Домашнє завдання
Вивчити параграф, виконати вправи.
Підготувати повідомлення про застосування карбонових кислот у різних галузях.
Задача Органічна сполука має відносну густину пари за метаном 2,875 і масові частки Карбону, Гідрогену відповідно 26,09%, 4,35 %, а також містить Оксиген. Визначте її формулу. (СН3СООН)
Вивчення нового матеріалу
Усі карбонові кислоти – слабкі електроліти, винятком є метанова кислота, яка є електролітом середньої сили. Із збільшенням вуглеводневого радикала сила кислот знижується: чим більший радикал , тим менш рухливий атом Гідрогену карбоксильної групи і тим слабша кислота.
Хімічні властивості
Загальні - за якими карбонові кислоти подібні до мінеральних кислот.
- дисоціюють на йони у водних розчинах і відповідно діють на індикатори
CH3COOH → CH3COO– + H+.
- взаємодіють з металами (активними і середньої активності): 2HCOOH + Mg → (HCOO)2Mg + H2↑ – магній форміат (метаноат)
- основними оксидами:
2CH3COOH + CaO→ (CH3COO)2Ca + H2O – кальцій ацетат (етаноат)
- лугами:
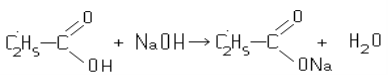 натрій пропаноат
натрій пропаноат
- солями (утвореними слабшими кислотами):
2CH3COOH + Na2CO3→ 2CH3COONa + H2O + CO2↑ - натрій ацетат (етаноат)
Ацетати – історична назва солей оцтової кислоти, форміати – мурашиної.
Як представник класу карбонових кислот оцтова кислота має свої специфічні властивості.
- Безводна оцтова кислота може горіти:
CH3COOH + 2O2→ 2CO2↑ + 2H2O
- Вона реагує зі спиртами з утворенням естерів – реакція естерифікації
6.Закріплення вивченого матеріалу
- HCOOH + NaOH Виберіть речовини, з якими реагуватиме оцтова кислота і складіть рівняння реакцій: мідь, магній оксид, сульфур (ІV) оксид, метанол, цинк.
-
Напишіть рівняння реакції:
- мурашина кислота + кальцій
- оцтова кислота + пропанол
- пропанова кислота + калій гідроксид
- Одноосновна карбонова кислота масою 65 г прореагувала з 6 г магнію. Визначте формулу кислоти, обчисліть, який об’єм водню виділився. (С6Н13СООН, 5,6 л )
- Визначити формулу одноосновної карбонової кислоти, якщо на нейтралізацію 7,04 г її витратили 20 г розчину калій гідроксиду з масовою часткою лугу 0,224. (С3Н7СООН)
- При взаємодії оцтової кислоти з 100 г вапняку, що містить 10% домішок, виділився газ. Обчисліть його об’єм (20,1л)
Робота за індивідуальними завданнями:
- Здійснити перетворення:
C2H6 – C2H5Cl – C2H5OH–CH3COOC2H5 – CH3COONa
- Закінчити рівняння реакцій, назвати продукти реакції:
- C2H5COOH + CH3OH =
- НСООН + NaOH =
- CH3COOH + K2CO3=
- НСООН + С2Н5ОН =
- C2H5COOH + Zn =
- Яку масу 20% -го розчину натрій гідроксиду потрібно взяти для нейтралізації 50 г 7,4% - го розчину пропанової кислоти? (10 г)
7.Домашнє завдання
Вивчити параграф. Виконати вправи.
Задача*. На нейтралізацію одноосновної насиченої карбонової кислоти масою 4,4 г витратили 8,17 мл розчину натрій гідроксиду (густина 1,225 г/мл) з масовою часткою лугу 0,2. Яка це кислота? Обчисліть масу утвореної солі ((С3Н7СООН, 5,5 г)
Пара 14
Тема пари: Естери, загальна та структурні формули, систематична номенклатура, фізичні властивості. Гідроліз естерів.
Мета пари:
навчальна: сформувати в учнів поняття про естери, розширити і поглибити знання учнів про хімічні властивості кислот та спиртів на прикладі реакції естерифікації, показати значення цієї реакції, розглянути практичне значення естерів та їх поширення в природі, продовжувати формувати вміння називати естери, а також розв’язувати розрахункові задачі за їх участю; на прикладі естерів розглянути міжкласову ізомерію органічних речовин;
розвиваюча: розвивати вміння порівнювати, робити висновки, узагальнювати;
виховна: виховувати критичність мислення, розширювати світогляд учнів.
Очікувані результати навчання
Знаннєвий компонент
студент називає загальну формулу та характеристичну (функціональну) групу естерів; за систематичною номенклатурою естери;
наводить приклади естерів і їхні тривіальні назви; поширення оксигеновмісних органічних сполук у природі і харчових продуктах.
Діяльнісний компонент
студент класифікує оксигеновмісні органічні сполуки за характеристичними групами;
складає молекулярні і структурні формули естерів (за назвами і загальною формулою відповідного гомологічного ряду); рівняння реакцій, які описують хімічні властивості естерів (гідроліз);
характеризує хімічні властивості естерів;
прогнозує хімічні властивості оксигеновмісних органічних сполук на основі знань про властивості характеристичних (функціональних) груп;
установлює причинно-наслідкові зв’язки між складом, будовою, властивостями, застосуванням; генетичні зв’язки між оксигеновмісними органічними сполуками;
дотримується правил безпечного поводження з органічними речовинами.
Ціннісний компонент
студент робить висновки щодо властивостей оксигеновмісних органічних речовин на підставі їхньої будови і про будову оксигеновмісних речовин на підставі їхніх властивостей; на основі спостережень;
усвідомлює взаємозв’язок складу, будови, властивостей, застосування оксигеновмісних органічних речовин;
оцінює безпечність органічних речовин і приймає обґрунтоване рішення щодо їхнього використання.
Тип пари:пара засвоєння нових знань
Форми роботи: фронтальна робота, самостійна робота учнів, робота в парах
Методи навчання: словесні (бесіда, пояснення, «Бліц»-опитування), наочні (демонстрація), практичні (виконання вправ, «Практикум»).
Обладнання: зразки продуктів, отриманих з естерів (парфуми, харчові ароматизатори).
Хід пари
- Організаційний етап
-
 Перевірка домашнього завданняКомбіноване опитування:
Перевірка домашнього завданняКомбіноване опитування:
- Пояснення домашнього завдання біля дошки
- Письмові завдання:
Здійснити перетворення:
- бутан – хлоробутан – бутанол – бутаналь – бутанова кислота – етилбутаноат
- пропаналь – пропанол – пропілацетат
↓
Пропанова кислота
- Усне опитування (Бліц)
- Відчуття опіку після укусу мурашки спричиняє ….
- Без якої кислоти не приготуєш консерви….
- Кислота цитрусових плодів….
- При скисання молока утворюється …
- У зеленому борщі міститься…
- Основа рідких жирів…
- При псуванні масла утворюється…
- Основа ацетатного волокна…
- При скисанні вина утворюється …
- Актуалізація опорних знань
Бесіда:
- В чому суть реакції естерифікації?
- За яких умов вона відбувається?
- Які функціональні групи беруть у ній участь?
- Мотивація навчальної діяльності
Всі з нас полюбляють парфуми. Вважають, що саме їх запах визначає те, як нас сприймають оточуючі. На сьогодні відкрито чимало речовин афродизіаків – ароматичних сполук, запах яких приваблює, хвилює, спокушає. Наприклад, запах жасмину, троянд, бузку, м’яти, лаванди діє на гіпофіз і сприяє виробленню ендорфінів – гормонів щастя.
Про ці чарівні речовини ми сьогодні й поговоримо.
- Повідомлення теми уроку
- Вивчення нового матеріалу
Естери – похідні органічних кислот, в яких атом Гідрогену карбоксильної групи заміщений вуглеводневим залишком.
R1 – COO –R2 - загальна формула естерів або СnH2nO2 - в молекулярному вигляді
Зверніть увагу, така ж загальна формула насичених карбонових кислот Наприклад,
СН3СООН і НСООСН3 - приклади міжкласової ізомерії
- COO – функціональна група естерів
Добування естерів (вихідні речовини – кислота та спирт)
СН3СООН + НО-С2Н5 = СН3СООС2Н5 + Н2О (в присутності конц. сульфатної кислоти)
етиловий естер оцтової кислоти, етилацетат, етилетаноат
НСООН + НО-С2Н5 = НСООС2Н5 + Н2О – етилформіат, етилметаноат С2Н5СООН + НО-СН3 = С2Н5СООСН3 + Н2О – метилпропаноат Номенклатура естерів:
замісник + алкан + оат (метил +пропан+оат)
Властивості естерів
Бесіда:
Спробуйте спрогнозувати фізичні властивості естерів:
- агрегатний стан (леткі рідини, С більше 10 – тверді)
- запах
етилформіат – ром метилбутаноат – яблуко, етилбутаноат – ананас, ізобутилбутаноат – абрикос, бутилбутаноат – банан
ізобутилацетат – груша бензилацетат – жасмин,
а також мед, троянди, хризантеми
Демонстрація 7. Ознайомлення зі зразками естерів.
? Чому сильний запах має велика кількість естерів, а серед кислот лише оцтова?
- розчинність (нерозчинні у воді).
- температури плавлення і кипіння (нижчі, ніж у відповідних кислот).
Проблемне питання:
-
 Чому при однаковій загальній формулі спостерігається значна відмінність у фізичних властивостях кислот та естерів? (відсутність водневого зв’язку)
Чому при однаковій загальній формулі спостерігається значна відмінність у фізичних властивостях кислот та естерів? (відсутність водневого зв’язку)
- Яким чином це відображається на властивостях естерів?
(розчинність, нижчі температури плавлення кипіння, запах, агрегатний стан)
Хімічні властивості естерів
- Окиснення (спалахують легко) НСООСН3 + 2О2 → 2СО2 + 2Н2О
- Реакція гідролізу – взаємодія з водою (в лужному середовищі) СН3СООС2Н5 + Н2О = СН3СООН + НО-С2Н5
СН3СООС2Н5 + NaОH = СН3СООNa + НО-С2Н5 – необоротна реакція
Застосування естерів:
(демонстрація зразків продукції з естерів)
- В парфумерії
- Харчова промисловість
- Виробництво ліків, вітамінів
- Розчинники, клей
- Закріплення вивченого матеріалу
Робота в парах:
- Назвати сполуки, скласти рівняння реакцій їх добування:
- СН3СООС2Н5
- С3Н7СООСН3
-
С2Н5СООС3Н7
- Напишіть формули: метилетаноат, пропілметаноат, етилпропаноат.
- Напишіть формули можливих ізомерів складу С5Н10О2, назвіть їх
«Практикум». Знайдіть у продукті естер, складіть його формулу (учням видано лак для нігтів, освіжувач повітря, парфуми)
Задача. Які маси етанолу та оцтової кислоти потрібно взяти для добування етилацетату масою 396 г? (207 г і 270 г))
8. Домашнє завдання
Вивчити параграф, виконати вправи.
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості.
6.Вивчення нового матеріалу
1. Історичні дати.
У 1779 р. шведський хімік Карл Вільгельм Шеєле виявив: один з продуктів гідролізу (розкладання під дією води) жирів – гліцерин
1817 р. його співвітчизник Шеврель добув з жирів уже відому «солодку олію Шеєле», яку назвав гліцерином. Непересічне значення мало також відкриття ним у продуктах дії водних розчинів лугів і кислот на різноманітні жири раніше невідомих сполук. Ними виявилися вищі карбонові кислоти – стеаринова, пальмітинова, олеїнова
Тобто за результатами аналізу продуктів гідролізу Шеврель зміг зробити певні висновки про склад жирів. Сорок років потому Марселен Бертло встановив структуру гліцерину і з нього та вищих карбонових кислот синтезував жир. Отже, склад і структуру природних жирів було доведено експериментально.
Жири - природна сировина, з якої шляхом хімічних перетворень вперше добули вищі карбонові кислоти. Найвідоміші поміж них - насичені пальмітинова С15Н31СООН та стеаринова С17Н35СООН кислоти й ненасичена олеїнова кислота С17Н33СООН. Вони входять до складу стеарину, косметичних засобів. За стандартних умов пальмітинова й стеаринова кислоти перебувають у твердому агрегатному стані й зовні нагадують парафін. Олеїнова кислота - рідина.
Утворення жиру
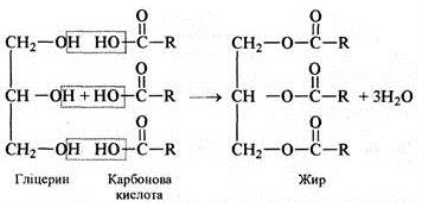
Фізичні властивості жирів. Деякі жири при звичайній температурі – тверді речовини, бараняче, свиняче; Інші рідкі, так звані олії(соняшникова, кукурудзяна, лляна…). Жири в яких переважають насичені кислоти – тверді; Олеїнова кислота – основний компонент оливкової олії при звичайних температурах є рідкою, бо її температура плавлення – 13,4 градуси цельсія. Тоді як пальмітинова і стеаринова відповідно – 63,1 і 69,6 градусів. Жири погано розчиняються у воді, але добре розчинні у бензині, спирті і інших розчинниках.
Демонстрація 8. Відношення жирів до води та органічних розчинників.
Чи мають жири смак, запах, колір?
Температури плавлення і кипіння різні. Жири утворені гліцерином і насиченими кислотами мають вищі температури плавлення.
Класифікація жирів
|
Жири |
|||
|
Рослинні (ненасичені) |
Тваринні (насичені) |
||
|
Тверді (пальмова олія) |
Рідкі (більшість – соняшникова, |
Тверді (більшість – свинячий |
Рідкі (рибячий жир) |
|
|
оливкова, лляна) |
жир, масло) |
|
-
 Знаючи, що жири - це естери, скажіть, якою основною властивістю вони повинні володіти? (гідроліз)
Знаючи, що жири - це естери, скажіть, якою основною властивістю вони повинні володіти? (гідроліз)
- Що таке гідроліз? (обмін речовин з водою)
- Процес гідролізу жирів відбувається й в організмі людини. Як і де це відбувається? (Жири під дією ферменту ліпази розщеплюються в 12-перстной кишці й тонкому кишечнику).
Хімічні властивості жирів:
Гідроліз
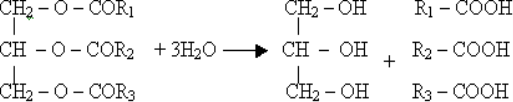
У шлунково-кишковому тракті тваринних організмів відбувається гідроліз спожитих жирів. З утвореного гліцерину й вищих карбонових кислот організм синтезує специфічні для нього жири.
Лужний гідроліз:
Унаслідок лужного гідролізу жирів добувають гліцерин і мила - натрієві та калієві солі вищих карбонових кислот
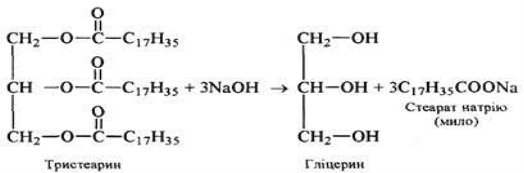
Тепер зрозуміло, що свого часу Жоффруа дією сильної кислоти на мило - сіль слабкої органічної кислоти - добув суміш вищих карбонових кислот:
Для жирів рослинного походження, крім гідролізу, характерні також реакції ненасичених карбонових кислот. Які специфічні реакції цих речовин ви знаєте?
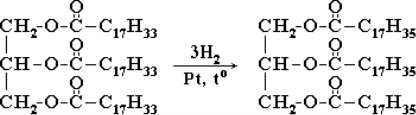
Гідрування жирів
Бромування (якісна реакція на ненасичені жири)
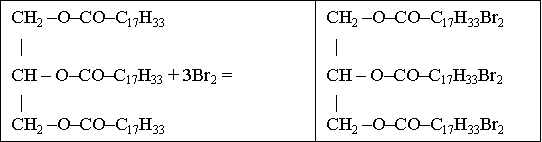
 115
115
Демонстрація 9. Доведення ненасиченого характеру рідких жирів (віртуально).
Добування жирів у промисловості.
Синтез жирів на даний час економічно не вигідний. Практично жири одержують із природних джерел. При цьому використовують такі способи:
А) втоплювання – нагрівання тваринних тканин;
Б) відтискання – пресування нагрітих рослинних насінин під тиским; тобто олію виготовляють з подрібненого насіння, з якого попередньо вилучили значну частину твердої оболонки. Процес проводять при нагріванні. потім олію фільтрують Це нерафінована олія. Якщо олію обробляють лугом, то вона – рафінована. Її використовують для обсмажування.
В) екстрагування – розчинення жиру у хімічних розчинниках з наступним його витягом. Це низка послідовних операцій: очищення, сущіння, видалення оболонки, подрібнення насіння, витягування з нього за допомогою спеціальних розчинників олії та наступного видалення розчинника.
Застосування жирів
(презентації та розповіді учнів)
- харчова промисловість;
- маргарин;
- у домашніх умовах;
- мило;
Біологічна роль жирів
- гліцерин;
- медицина;
- оліфа;
- косметичні засоби.
У рослинах жири утворюються з вуглеводів. Цей процес найінтенсивніше відбувається в насінні дозріваючих олійних культур і плодах. Під час проростання насіння жири, навпаки, розщеплюються (за участю ферментів) на вищі карбонові кислоти і гліцерин, з якого утворюються вуглеводи.
Жири входять до складу тканин тварин, рослин. Вегетативнi частини рослин накопичують не бiльше 5% лiпiдiв, насiння – до 50% i бiльше. В органiзмi людини в нормi мiститься 10-20% жиру, але при наявностi деяких порушень жирового обмiну його кiлькiсть може змiнюватися.
Функції жирів наступні:
- енергетична - окиснення 1г жиру спричиняє виділенню 39 кДж енергії;
- запасаюча - жири - резервні речовини (нормальної комплекції доросла людина має у своєму організмі 9-12 кг жиру, що відповідає 251000-377000 кДж (60000-90000 ккал) і становить запас енергії на цілий місяць);
- теплоізоляційна - охороняють організм від теплових втрат, тому що є поганим провідником тепла (у китів, які живуть у холодних морях, шар підшкірного жиру досягає 1 м)
- є джерелом води – 100 г жиру при окисненні дає 110-140 г води, завдяки чому верблюди можуть у не пити у пустині 10-12 діб.
- захисна - жир захищає органи (печінку, нирки) від механічних впливів, завдяки пружності.
- регуляторна – жири беруть участь в утворенні гормонів і засвоєнні вітамінів D, A, E.
- Закріплення вивченого матеріалу
Завдання в групах
-
 Скласти формулу жиру:
Скласти формулу жиру:
Олеїнодистеарат, триолеат, дипальмітостеарат.
Вказати його агрегатний стан і тип (простий, змішаний).
- Назвіть жир:

- Заповнити пропуски в твердженнях
Жири утворюються з … і …
Жири за агрегатним станом поділяються на: … і …, а за походженням на … і
…
Змішані жири містять залишки ……… вищих карбонових кислот
Гідролізом називають реакцію жиру з ……, внаслідок якої утворюються…… і
…Гідроліз відбувається при температурі …….
Якщо гідроліз здійснювати за наявності лугу, то крім гліцерину утворюються
..….
Якщо рідкі жири приєднують…….., то вони перетворюються на …… Цей процес називається…
Маргарин – це……….. Його виробляють із……. Внаслідок окиснення жирів на повітрі утворюються ….. Повне окиснення жирів – це…….
Фронтальна робота з класом:
Закінчіть твердження («Слабка ланка»):
- Функції жирів - …
- Жири бувають ….. ;
- Тверді жири утворені……., олії утворені……;
- Жири належать до класу…;
- Для жирів характерні реакції …..;
- У повсякденному житті протікають реакції …..
- Жири – джерело ……
- Жири застосовують у …..
У світі літератури:
- «Височенні хвилі здіймались перед судном, обминути їх здавалося неможливим. І раптом Джон вигукнув до матросів:
- Хлопці, біжіть по лій. Мерщій.
Команда вмить зрозуміла капітана. Матроси перевернули барила з лоєм, масна пелена немов скувала поверхню моря і судно проскочило над втихомиреними хвилями, які за мить знову розбушувалися…». Поясніть дії капітана.
- Про який хімічний процес йде мова? Впізнайте всі речовини:
«Наб і Пенкрофт зрізали весь жир з туші дюгоня, склали у великі посудини, потім додали попіл спалених водоростей і деякий час варили…». В результаті
отримали два корисних на безлюдному острові продукти, один став основою вибухівки, а інший пригодився в побуті. Назвіть їх.
- Підсумки уроку і повідомлення домашнього завдання
 Саморефлексія: (так - не дуже – ні)
Саморефлексія: (так - не дуже – ні)
- Чи сподобався вам урок?
- Вам тема зрозуміла?
- Чи активно ви працювали?
- Як ви гадаєте, пригодиться вивчене сьогодні вам у житті? Вивчити параграф, вправа.
Творче завдання: скласти сенкан, де ключове слово жири.
Додаток 1.
Варіант 1.
- Розташуйте речовини за збільшенням числа атомів Карбону в них:
- бутилацетат
-
пропілметаноат
- Встановіть відповідність:
- HCOOC4H9
- C2H5COO C3H7
- CH3COOC2H5
- С3Н7СОО C3H7
- CH3COOCH3
- бутилпропаноат
- метилацетат
- метилацетат
- пропілбутаноат
- пропілпропаноат
- етилацетат
- бутилформіат
- Складіть формули естерів, що мають запах:
- етилформіат – ром
- метилбутаноат – яблуко,
- бутилбутаноат – абрикос,
- Закінчіть рівняння реакцій :
- C2H5COOH+CH3OH =
- HCOOC3H7 + H2O =
- С4Н9COOCH3 + NaOH=
- Відносна густина за воднем естеру 51. Визначте його склад і можливі ізомери.
Варіант 2.
- Розташуйте естери із збільшенням температур їх кипіння:
- етилацетат
- пропілбутаноат
- бутилацетат
- метилформіат
- Встановіть відповідність між естерами і продуктами гідролізу:
- метилпропаноат
- етилацетат
- метилформіат
- пропілбутаноат
- метиловий спирт, мурашина кислота
- пропіловий спирт, бутанова кислота
- етиловий спирт, оцтова кислота
- метиловий спирт, пропанова кислота
- Складіть формули естерів, що мають запах:
- етилбутаноат – ананас,
- бутилбутаноат – банан
- бутилацетат – груша
- Закінчіть рівняння реакцій:
- CH3COOC2H5 + H2O
- C3H7COOCH3 + H2O
- НСООН + С3Н7ОН =
- Масова частка Оксигену в естері 36,36%. Визначте його склад і можливі ізомери.
Пара 15
Тема пари: Вуглеводи. Класифікація вуглеводів, їх утворення й поширення у природі.
Мета пари:
навчальна: дати загальне поняття про вуглеводи, їх класифікацію, розглянути механізм утворення їх уц природі, ознайомити учнів з поширенням вуглеводів у природі та їх біологічним значенням,
розвиваюча: розвивати вміння порівнювати, робити висновки;
виховна: розширювати світогляд учнів Очікувані результати навчання Знаннєвий компонент
учень називає характеристичні (функціональні) групи спиртів, альдегідів;
пояснює вплив характеристичної (функціональної) групи на фізичні і хімічні властивості оксигеновмісних органічних сполук;
наводить приклади вуглеводів і їхні тривіальні назви; поширення оксигеновмісних органічних сполук у природі і харчових продуктах.
Діяльнісний компонент
Студент розрізняє моно-, ди-, полісахариди;
складає молекулярні і структурні формули вуглеводів; рівняння реакцій фотосинтезу, утворення сахарози, крохмалю і целюлози у природі.
Ціннісний компонент
студент усвідомлює взаємозв’язок складу, будови, властивостей, застосування оксигеновмісних органічних речовин;
висловлює судження щодо впливу продуктів органічного синтезу на здоров’я людини;
розв’язує проблему власного раціонального харчування на основі знань про вуглеводи;
оцінює біологічне значення вуглеводів для харчування людини.
Тип пари: пара засвоєння нових знань
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (розв’язування вправ).
Обладнання: зразки моно-, ди- та полісахаридів, продукти, що їх містять.
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
Комбіноване опитування:
Пояснення біля дошки домашнього завдання
Тестові завдання (Додаток 1) Письмові завдання .
- Скласти формули:
- триолеат,
- олеїнопальмітиностеарат
- олеїнодипальмітат,
гліцерину.
- Здійснити гідрування дипальмітоолеату
- Здійснити лужний гідроліз стеародипальмітату
- Задача. Яку масу тристеарину можна отримати з 442 кг триолеїну?
(445кг)
Усне опитування
-
 Які речовини належать до жирів? Якими кислотами жири утворені?
Які речовини належать до жирів? Якими кислотами жири утворені?
- Які бувають жири? Порівняйте тверді та рідкі жири (склад, властивості, значення)
- Яке значення жирів для організмів рослин та тварин?
- Навіщо проводять гідрування жирів?
- В чому полягає шкода окиснення жирів?
3. Актуалізація опорних знань
Бесіда:
- Які вам відомі групи органічних речовин, що мають життєво необхідне значення для людського організму?
- Яка з даних груп речовин повинна переважати у раціоні і чому?
4. Вивчення нового матеріалу
1. Назва «вуглеводи» склалася історично, оскільки перші з вивчених сполук цього класу містили в молекулах, крім атомів Карбону (вуглецю), атоми Гідрогену та Оксигену у співвідношенні 2 до 1, тобто як у воді, – звідси назва «вуглеводи».
Загальна формула вуглеводів – Сn(H2O)m,
але це не означає, що вуглеводи складаються з Карбону й окремих молекул води. Ця формула відбиває лише співвідношення атомів Карбону, Гідрогену й Оксигену в молекулах вуглеводів. Пізніше були знайдені вуглеводи, в яких дане співвідношення не дотримується, проте назва залишилася.
Класифікація вуглеводів
 ВУГЛЕВОДИ
ВУГЛЕВОДИ
моносахаради дисахаради полісахаради
Пентози:
- рибоза С5Н10О5,
- дезокси- рибоза
С5Н10О4
Гексози:
- глюкоза,
- фруктоза С6Н12О6
- сахароза
- лактоза
- мальтоза C12H22 O11
- крохмаль,
- целюлоза
- (С6Н10О5)n -
Зверніть увагу: формули різних гексоз і полісахаридів однакові. Як таке можливо?
Утворення вуглеводів:
Утворення глюкози в природі (Фронтальна бесіда)
- Пригадайте із курсу біології, що ви знаєте про фотосинтез?
- Які умови потрібні для фотосинтезу?
В процесі фотосинтезу відбувається синтез органічних речовин (глюкози) із неорганічних:
![]() 6CO2 + 6H2O C6H12O6 + 6O2.
6CO2 + 6H2O C6H12O6 + 6O2.
А вже з неї шляхом об’єднання кількох ланок синтезуються ди- та полісахариди
Утворення полісахаридів:
nС6Н12О6 → - (С6Н10О5)n - + nН2О
Поширення вуглеводів у природі
|
Вуглевод |
Поширення у природі |
Біологічна роль |
|
Глюкоза |
Багато її є у винограді, цукровій тростині, цукрових буряках, солодких фруктах, ягодах. Глюкоза входить до складу тваринних організмів. Її масова частка у крові людини становить близько 0,1 %. |
Основне джерело енергії, структурна одиниця для побудови складних вуглеводів |
|
Рибоза і |
Входять до складу РНК та ДНК |
Забезпечують |
|
дезоксирибоза |
клітин усіх живих організмів організмів |
збереження та передачу спадкової інформації |
|
Сахароза |
Сахароза міститься в цукрових буряках (16-20%), стеблах цукрових тростин (14-16%), соці берези, багатьох плодах і овочах. |
Є резервним вуглеводом, головна функція - запасаюча |
|
Крохмаль |
Крохмаль – найпоширеніший у рослинному світі вуглевод, який відкладається в корінні, бульбах і зернах. Масова частка крохмалю в бульбах картоплі становить близько 20 %, у зернах пшениці та кукурудзи – 70%, рису – близько 80 %. |
Відкладається у рослинах, забезпечуючи їх запасом поживних речовин |
|
Целюлоза |
Целюлоза є головною складовою частиною оболонок клітин вищих рослин. її масова частка в деревині становить близько 50 %, у волокнах бавовни – до 98, у корі джута – до 75 %. |
Будівельний матеріал для рослин, структурна і опорна функція |
- Закріплення вивченого матеріалу
 Бесіда:
Бесіда:
- Чому клас речовин називається «вуглеводи»?
- На які класи поділяються вуглеводи?
- В чому подібність та відмінність між різними групами вуглеводів?
- Чи можна значно обмежувати споживання вуглеводів, використовуючи різні дієти?
- Обчисліть, яку масу цукру можна отримати з 50 кг цукрового буряка, якщо середній вміст сахарози у ньому 18% (9 кг)
- Згоріла органічна речовина масою 6,84 г. Утворилося 5,376 л вуглекислого газу і 3,96 г води. Відносна молекулярна маса речовини в 1,9 рази більша від маси глюкози. Визначте формулу сполуки. (C12H22O11)
6. Домашнє завдання
Вивчити параграф, виконати вправи.
Додаток 1
ТЕСТ ПО ТЕМІ: “ЖИРИ”.
- ЖИРИ - ЦЕ...
а) багатоатомні спирти б)складні естери гліцерину та карбонових кислот в) карбонові кислоти.
- ЯКІ РЕЧОВИНИ ВХОДЯТЬ ДО СКЛАДУ ТВАРИННИХ ЖИРІВ?
а)гліцерин. б)етанол
в)пальмітинова кислота
д)стеаринова кислота
е) лінолева кислота.
- Які реакції не характерні для рослинних жирів?
а)гідроліз б)заміщення
в)гідрування
г) дегідрування
- Які речовини можуть утворитись при гідролізі рослинних жирів?
а)лінолева кислота б)гліцерин
в)мурашина кислота
г)олеїнова кислота д)стеаринова кислота
- Які реакції характерні для тваринних жирів?
а)водний гідроліз б)гідрування
- Хто вперше синтезував жири? а)Бутлеров
б)Бертло
в)приєднання г) омилення
д) окиснення
в)Шеелє
г) Шеврель
- Як називається процес розщеплення жирів?
а)горіння б)гідроліз
- Які з цих жирів є змішаними? а)триолеїн
б)пальмітодиолеїн
в)гідрування г)омилення
в)диолеїностеарин г) трипальмітин
- Як називається процес перетворення рідких жирів у тверді?
|
а)омилення б)гідроліз в)гідрування 10. Як називається жир? |
г)окиснення д) |
|
горіння |
|
СН2–ОСОС17Н31 СН–ОСОС17Н31 СН2ОСОС17Н31 в) трипальмітин 11.Назвіть |
|
а) б) |
триолеїн тристеарин
жир |
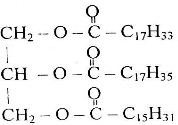
Глюкоза: молекулярна формула та її відкрита форма. Хімічні властивості глюкози.
Вивчення нового матеріалу
Глюкоза широко поширена в природі. Вона міститься у великих кількостях у виноградному соку (тому глюкозу ще називають виноградним цукром), входить до складу меду, дозрілих фруктів, ягід. Це біла кристалічна речовина, добре розчинна у воді, солодка на смак.
Утворення глюкози в природі (Фронтальна бесіда) Пригадайте із курсу біології, що ви знаєте про фотосинтез? Які умови потрібні для фотосинтезу?
В процесі фотосинтезу відбувається синтез органічних речовин (глюкози) із неорганічних:
![]() 6СО2 + 6Н2О світло, хлорофіл С6Н12О6 + 6 О2↑
6СО2 + 6Н2О світло, хлорофіл С6Н12О6 + 6 О2↑
С6Н12О6 – молекулярна формула глюкози
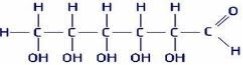
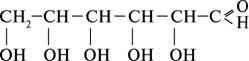
Структурна формула Напівструктурна формула глюкози
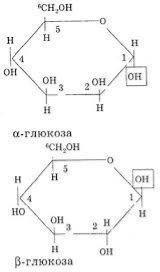 Ця формула не показує, як у просторі розміщуються функціональні групи. Глюкоза може існувати в циклічних формах, які відрізняються розміщенням гідроксильних груп відносно площини кільця.
Ця формула не показує, як у просторі розміщуються функціональні групи. Глюкоза може існувати в циклічних формах, які відрізняються розміщенням гідроксильних груп відносно площини кільця.
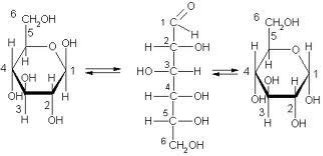 Якщо гідроксильна група біля першого атома Карбону знаходиться під площиною кільця – це α–глюкоза, над площиною – β-глюкоза.
Якщо гідроксильна група біля першого атома Карбону знаходиться під площиною кільця – це α–глюкоза, над площиною – β-глюкоза.
Циклічну будову молекула глюкози має у кристалічному стані, у водних же розчинах вона існує у двох різних формах, які взаємно переходять одна в одну:
- Фізичні властивості глюкози (Бесіда, робота з підручником)
- Безбарвна кристалічна речовина.
- Добре розчинна у воді.
- Солодка на смак.
- Легкоплавка, tпл. = 146˚С.
- Знаходження в природі (Розповідь вчителя)
- У винограді (глюкоза – виноградний цукор).
- В коренях, листках, стеблах та квітках і, особливо, в плодах рослин.
- Мед – суміш глюкози і фруктози.
- В крові людини ~ 0,1%.
Хімічні властивості глюкози:
Молекула глюкози є альдегідоспиртом. Тому глюкоза вступає в реакції, характерні для багатоатомних спиртів і альдегідів.
-
Реакції окиснення:
- повне: C6H12O6 + 6O2 = 6CO2 + 6H2O (при цьому виділяється енергія)
- неповне (часткове) окиснення - це якісні реакції на глюкозу
а) Реакція «срібного дзеркала» Як альдегід глюкоза окиснюється (наприклад, у реакції «срібного дзеркала») до глюконової кислоти.
![]()
Демонстрація 9. Окиснення глюкози амоніачним розчином арґентум(І) оксиду (за відсутності реагентів – віртуально).
б) Реакція «мідного дзеркала» - взаємодія глюкози з купрум (ІІ) гідроксидом Як багатоатомний спирт глюкоза реагує з купрум(ІІ) гідроксидом, утворюючи розчин синього кольору, а як альдегід – відновлює Купрум, утворюючи характерний оранжевий осад при нагріванні:
СН2ОН – (СНОН)4 – СОН + 2Сu(ОН)2 = СН2ОН –( СНОН)4 – СООН + Сu2О↓
+2Н2О
-
 Реакція відновлення - відновлюється воднем до шестиатомного спирту сорбіту:
Реакція відновлення - відновлюється воднем до шестиатомного спирту сорбіту:
сорбіт
- Реакції бродіння Велике значення мають процеси бродіння глюкози, які відбуваються під дією органічних каталізаторів-ферментів. Відомо кілька видів бродіння. Спиртове бродіння відбувається під дією ферментів дріжджів.
А)Спиртове бродіння
С6Н12О6 == 2С2Н6О + 2СО2
Б)Молочнокисле відбувається під дією молочнокислих бактерій: При цьому утворюється молочна кислота.
С6Н12О6 == 2СН3 – СНОН – СООН
Застосування глюкози:
- в медицині для підтримання життєдіяльності ослабленого організму в якості укріплюючого лікувального засобу при явищах серцевої недостатності, шоці, вона входить до складу кровозамінників та протишокових рідин.
- в кондитерській промисловості – виготовлення мармеладу, карамелі, печива.
- для сріблення дзеркал та ялинкових іграшок.
- В текстильній промисловості в якості відновника.
- Для оброблення тканин і шкір.
- В якості вихідного продукту при виробництві аскорбінових та гліконових кислот, для синтезу ряду похідних сахарів.
- Реакцію взаємодії глюкози з купрум (ІІ) гідроксидом використовують для виявлення цукру в сечі.
- Велике значення мають процеси бродіння глюкози. При квашенні капусти, огірків, скисанні молока відбувається молочнокисле бродіння, таке ж як при силосуванні кормів. Якщо силосна маса недостатньо втрамбована, то під впливом повітря відбувається маслянокисле бродіння і корм стає непридатним.
- На практиці використовують також спиртове бродіння глюкози при виробництві пива.
Цікаві факти.
- В організмі деяких ропух глюкоза знайшла собі досить цікаве застосування. У зимовий період інколи можна знайти ропух, вмерзлих у крижані брили, але після розмерзання земноводні оживають. Як цим тваринам не вдається не замерзнути на смерть?
Виявляється, з початком холодів у крові ропух кількість глюкози збільшується в 60 разів. Це заважає утворенню всередині організму кристаликів льоду.
- Герої роману Жюля Берна «Діти капітана Гранта» тільки зібрались повече- ряти м'ясом гуанако, як раптом з'ясувалося, що воно зовсім неїстівне. Можливо, воно надто довго зберігалося? — спантеличено спитав один з них. Ні, воно, на жаль, надто довго бігло! — відповів Паганель.
М'ясо смачне лише тоді, коли тварина убита під час відпочинку, але, якщо за нею тривалий час полювати і тварина довго біжить, тоді її м'ясо неїстівне. Під час розпаду глюкози утворюється не вода та вуглекислий газ, а більш складна речовина.Чим більше молочної кислоти накопичується у м'язах, тим тварина відчуває більшу стомленість. Саме молочна кислота зробила недобрим м'ясо тварини, підстреленої героями Жюля Верна.
- Закріплення вивченого матеріалу
 Бесіда:
Бесіда:
- Як довести, що молекула глюкози містить гідроксильні групи?
- Як довести, що молекула глюкози містить альдегідну групу?
Бліц «Чомучки»:
- Чому глюкоза, маючи велику відносну молекулярну масу добре розчинна у воді?
- Чому солодке молоко з часом набуває кислого смаку?
- Чому в спортсменів після тренування різко падає рівень глюкози в крові?
- Чому потрібно обмежувати вживання глюкози, якщо вона так потрібна для організму?
Розминка «Так-ні»
- Глюкоза належить до моносахаридів
- Глюкоза подібна до одноатомних спиртів
- При повному окисненні глюкози утворюється вуглекислий газ і вода
- Реактивом для визначення глюкози є бромна вода
- Результатом спиртового бродіння є утворення етанолу
- Глюкоза – основне джерело енергії для організму
Задача. Яку масу спирту можна під час спиртового бродіння 90 г глюкози, враховуючи, що вміст домішок у ній 15%? (39, 1г)
Інструктаж з БЖД.
Лабораторний дослід 2. Окиснення глюкози свіжоодержаним купрум(ІІ) гідроксидом
8. Домашнє завдання
Вивчити параграф, виконати вправи.
Задача. Яка маса срібла утвориться при окисненні 0,4 моль глюкози надлишком амоніачного розчину арґентум (І) оксиду?(86, 4г)
Сахароза, крохмаль і целюлоза: молекулярні формули, гідроліз.
Вивчення нового матеріалу
Сахароза
Найважливішою сполукою з дисахаридів є сахароза(звичайний цукор). Її молекулярна формула C12H22O11.
До її складу входять залишки глюкози та фруктози, що показує структурна формула.
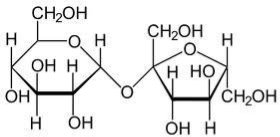 Сахароза — біла кристалічна речовина, розчинна у воді, солодка на смак. За 190—200 °С сахароза перетворюється на буру масу — карамель.
Сахароза — біла кристалічна речовина, розчинна у воді, солодка на смак. За 190—200 °С сахароза перетворюється на буру масу — карамель.
Великий вміст сахарози в цукровому буряку (16—20 %), стеблах цукрової тростини (14—16 %), а також у соку берези, клена, у багатьох плодах і овочах, у цукровій
пальмі, рожковому дереві, цукровому сорго.
Сахарозу добувають із цукрового буряка або цукрової тростини.
Хімічні властивості:
- окиснення:
![]() Чи горить сахароза?
Чи горить сахароза?
Цукрова пудра легко займається і навіть може спричинити вибух. C12H22O11 + 12O2 →12CO2 + 11H2O
- гідроліз при нагріванні у кислому середовищі. При цьому з однієї молекули сахарози утворюється молекула глюкози і молекула фруктози:
C12H22O11 + H2O →C6H12O6 + C6H12O6.
- дегідратація - при дії концентрованої сульфатної кислоти: C12H22O11 →12C + 11H2O
Полісахариди – вуглеводи, що складаються з великої кількості залишків глюкози.
Їх представниками є крохмаль та целюлоза – природні полімери.
В природі крохмаль міститься у вигляді зерен у плодах та насінні деяких рослин. Целюлоза утворює основну частину стебла рослин, а у дерев – стовбура. Волокна бавовни містять до 98 % целюлози; волокна льону й конопель теж в основному складаються з целюлози; у деревині вона становить близько 50%. Папір, бавовняні тканини — це вироби з целюлози. Особливо чистими зразками целюлози є вата з очищеної бавовни й фільтрувальний (непроклеєний) папір.
 (демонстрація)
(демонстрація)
Порівняйте фізичні властивості цих речовин. Чим зумовлена така відмінність між ними?
Як не дивно, але склад в них однаковий.
…-С6Н10О5-С6Н10О5-С6Н10О5-С6Н10О5-…
- (С6Н10О5)n – загальна формула полісахаридів, де n – кількість залишків глюкози (мономерів).
Утворення полісахаридів:
nС6Н12О6 → - (С6Н10О5)n - + nН2О
Порівняльна таблиця
|
Ознаки порівняння |
Крохмаль |
Целюлоза |
|
1. Формула |
- (С6Н10О5)n - |
|
|
2.Число мономерів |
N = 1тис – 5 тис, М = 172 n (n=100-1000) |
N = 15 тис – 40 тис, М = 172 n (n=10000-100000) |
|
3.Структурна будова |
Розгалужена, лінійна |
Лінійна |
|
4.Фізичні властивості |
Білий порошок, розчинний у гарячій воді |
Біла волокниста речовина, не розчинна у воді |
|
5.Хімічні властивості: |
Гідроліз: (С6Н10О5)n + nН2О → nС6Н12О6 (ферменти, кислота) Поступово: крохмаль - декстрини(частини молекули крохмалю)- глюкоза |
|
|
Горіння (С6Н10О5)n + 6nО2 → 6nСО2 + 5nН2О |
||
|
Взаємодія з йодом крохмаль + І2→ сполука синьо- |
|
|
|
|
фіолетового забарвлення |
|
|
6. Біологічна роль |
Запасаюча поживна речовина рослин |
Будівельний матеріал для рослин, структурна і опорна функція |
![]()
![]() Застосування
Застосування
крохмалю: целюлози :
- добування глюкози, патоки, спирту,
- виробництво клейстеру,
- продукти харчування,
- медичні засоби (мазі, присипки)
- будівельні матеріали (деревина)
- текстиль (нитки, тканини)
- медична вата
- лаки, кіноплівка, вибухівка, папір
- Закріплення вивченого матеріалу
Проблемні питання:
-
 Яке значення сахарози для рослин?
Яке значення сахарози для рослин?
- Яким чином можна відрізнити розчин глюкози від розчину сахарози?
- В рослинах міститься велика кількість крохмалю, наприклад, в картоплі вміст крохмалю – 20%, у пшениці – 60%, у рисі - 80%. Він
відкладається у плодах та насінні. Чому?
- Чому людям хворим на цукровий діабет слід обмежувати кількість хліба, картоплі?
- Чи може людина перетравлювати целюлозу? А які організми можуть? Чому?
- Яким чином можна удосконалити властивості штучних волокон, зробити їх міцнішими і стійкішими?
Групові завдання:
- Яким чином відрізнити розчин крохмального клейстеру від розчину глюкози?
- Часто, щоб сметана чи мед були густішими, до них додають крохмаль. Як виявити сурогат?
- У цукровій тростині масова частка сахарози становить 20%. Яку масу фруктози можна добути з тростини масою 25 т? (2,6т)
- Сахарозу кількістю речовини 0,25 моль гідролізували. Утворену при цьому глюкозу піддали спиртовому бродінню. Яку масу етанолу отримали в результаті бродіння?
- Яку масу целюлози потрібно взяти, щоб добути з неї 184 г етилового спирту? (324 г)
- Яку масу глюкози можна отримати з 240 кг картоплі, якщо вміст крохмалю в ній 20%? (53,3 кг)
- Домашнє завдання
Вивчити параграф.
Задача. Яку масу тирси, що містить 70% целюлози, потрібно піддати гідролізу для одержання 36 кг глюкози? (46,3 кг)
Пара 19 Практична робота №3
Тема пара: Практична робота 1. Розв’язування експериментальних задач
Мета пари:
навчальна: поглибити та систематизувати знання учнів про органічні речовини, продовжувати формувати вміння розв’язувати експериментальні задачі і розпізнавати органічні сполуки за допомогою якісних реакцій;
розвиваюча: продовжувати розвивати навички роботи з хімічним обладнанням, формувати вміння проводити хімічний експеримент, робити висновки, узагальнювати;
виховна: виховувати бережне ставлення до свого здоров’я
Діяльнісний компонент
Студент розв’язує експериментальні задачі, обґрунтовуючи обраний спосіб розв’язання.
Тип пари: пара формування вмінь і навичок
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні.
Обладнання: відповідно до інструкції
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
Письмова робота (додаток 1.)
- Актуалізація опорних знань
 Бесіда:
Бесіда:
![]() Пригадайте за допомогою яких якісних реакцій можна розпізнати: багатоатомні спирти
Пригадайте за допомогою яких якісних реакцій можна розпізнати: багатоатомні спирти
фенол альдегіди
![]() карбонові кислоти глюкозу
карбонові кислоти глюкозу
крохмаль
- Інструктаж з БЖД
- Виконання практичної роботи Додаткові завдання:
- Здійсніть перетворення:
- целюлоза – глюкоза – етанол - етилацетат– натрій ацетат
- крохмаль – глюкоза – етанол – етаналь – оцтова кислота – бутилацетат
- Які маси розчинів з масовими частками 5 і 25% потрібно змішати для приготування 200 г 10% розчину глюкози? (150 г і 50 г)
- Яку масу цукрового буряка з вмістом сахарози 16% потрібно взяти, щоб добути 230 г етанолу (5344 г)
- Формулювання висновків, оформлення звіту
- Домашнє завдання
Повторити тему, підготуватися до письмової роботи
Додаток 1.
Варіант 1.
1. Глюкоза – це
- спирт
- дисахарид
2.Сахароза має формулу:
a) С12Н24О12
b) С6Н12О6
- Під час гідролізу сахарози утворюється:
- фруктоза.
- тільки глюкоза,
- Сахароза – це:
- моносахариди
- полісахариди
- полісахарид
- моносахарид
c) С12Н22О11
d) С6Н10О6
- глюкоза і фруктоза
- крохмаль
c) дисахариди
- Для реакції «срібного дзеркала» використовують реактив:
- Cu(OH)2
- металічне срібло
- Ag2O
- лакмус
- У результаті спиртового бродіння глюкози утворюється:
- етанол і вуглекислий газ
- молочна кислота
- етанол
- Біологічне значення глюкози:
- запасна поживна речовина
- будівельний матеріал організму
d) молочна кислота і вуглекислий газ
- джерело енергії
- захист органів від ушкоджень
- Відносна молекулярна маса глюкози становить ….
- Виберіть правильні твердження щодо сахарози:
- запасаюча поживна речовина
- вступає в реакцію «срібного дзеркала»
- моносахарид
- малорозчинна у воді речовина
- утворюється під час фотосинтезу
- Встановіть відповідність:
- фруктоза
- сахароза
- глюкоза
a) С12Н22О11
- С6Н12О6
- С6Н12О6
|
Варіант 2. 1. Глюкоза має формулу: |
|
|
|
a)С6Н10О6 |
c) |
С6Н12О6 |
|
b) С12Н22О11 |
d) |
С12Н24О12 |
2 Під час дегідратації сахарози утворюється:
- вуглекислий газ і вода
- спирт і вода
- Біологічне значення сахарози:
- захист органів від ушкоджень
- запасна поживна речовина
- Внаслідок окиснення глюкози утворюється
- глюконова кислота
- вуглекислий газ і вода
- вуглець і вода глюкоза
c) джерело енергії будівельний матеріал організму
- спирт
- молочна кислота
- Продуктом реакції «мідного дзеркала» глюкози є:
- глюконова кислота
- вуглекислий газ
- Продуктом спиртового бродіння глюкози є:
- етанол і вуглекислий газ
- молочна кислота і вуглекислий газ
- Сахароза утворена:
a) α-глюкозою і β-глюкозою
- молочна кислота
- спирт
c) молочна кислота етанол
c) α - фруктозою і β-
b) α-глюкозою і фруктозою фруктозою
- Відносна молекулярна маса сахарози … 9.Виберіть правильні твердження щодо глюкози:
- не дає реакції «срібного дзеркала»
- полісахарид
- моносахарид
- утворюється під час фотосинтезу
- джерело енергії 10.Встановіть відповідність:
- моносахариди
- дисахариди
- полісахариди
- глюкоза
- крохмаль
- фруктоза
- сахароза
Варіант 3
- Здійснити перетворення: СО2 – С6Н12О6 – C2H5OH – C2H5ONa
- Обчисліть масу кисню, яку синтезували рослини, якщо при цьому утворилося 100 т глюкози. Який об’єм вуглекислого газу поглинувся?
Варіант 4.
- Здійснити перетворення: С12Н22О11 – С6Н12О6 – C2H5OH – CO2
- Яку масу глюкози можна добути з 1 т цукрового буряка, в якому масова частка сахарози 25%
Варіант 5.
- Здійснити перетворення: С12Н22О11 – CO2 - С6Н12О6 - - (C6H10O5)-
- Яка маса срібла утвориться при окисненні 0,8 моль глюкози надлишком амоніачного розчину арґентум (І) оксиду?
Тема 5. Нітрогеновмісні органічні сполуки.
Пара 17
Тема пари: Насичені й ароматичні аміни: склад і будова молекул, назви найпростіших за складом сполук. Будова аміногрупи.
Мета пари:
навчальна: розширити знання учнів про органічні сполуки на прикладі нітрогеновмісних речовин, сформувати поняття про аміни як органічні основи, ознайомити з їх класифікацією, властивостями, дати уявлення про будову молекул амінів, їх ізомерію, гомологію, номенклатуру, показати поширення в природі амінів, їх біологічну роль, продовжувати формувати вміння складати структурні формули на прикладі гомологів та ізомерів амінів.
розвиваюча: розвивати вміння порівнювати, узагальнювати;
виховна: розширювати науковий світогляд учнів
Очікувані результати навчання
Знаннєвий компонент
студент називає загальні формули та характеристичні (функціональні) групи амінів;
пояснює структурні формули амінів; зміст понять: характеристична (функціональна) аміногрупа;
наводить приклади амінів.
Діяльнісний компонент
Студент розрізняє насичені й ароматичні аміни;
складає молекулярні та структурні формули амінів за назвами і загальними формулами;
класифікує нітрогеновмісні органічні сполуки за характеристичними (функціональними) групами;
дотримується правил безпечного поводження з органічними речовинами.
Ціннісний компонент
студент усвідомлює вплив аніліну та його похідних (вогненебезпечність, подразливість, отруйність) на довкілля та організм людини.
Тип пари: пара засвоєння нових знань
Форми роботи: фронтальна робота, індивідуальна робота, робота в парах Методи навчання: словесні (бесіда, пояснення), практичні (виконання вправ). Обладнання: моделі молекул.
Хід пари
- Організаційний етап
- Актуалізація опорних знань
 Бесіда:
Бесіда:
![]() Які групи органічних речовин вам відомі?
Які групи органічних речовин вам відомі?
Які особливості у будові та властивостях характерні для них? Пригадайте основні відмінності між ними?
- Повідомлення теми уроку
- Вивчення нового матеріалу
Сьогодні ми починаємо вивчати групу органічних речовин, які, як вважають, стали основою життя на землі, а саме нітрогеновмісні речовини.
![]()
![]()
![]()
![]() Нітрогеновмісні органічні речовини
Нітрогеновмісні органічні речовини
Аміни Амінокислоти Білки Нуклеїнові кислоти Ці речовини саме таким чином ускладнювалися в процесі еволюції світу і
виникненні життя на Землі.
Найпростішими сполуками цієї групи органічних речовин є аміни.
Аміни – похідні амоніаку, в яких один чи кілька атомів Гідрогену заміщений на вуглеводневий залишок.
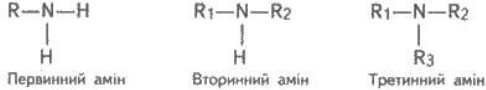 Н - N – Н
Н - N – Н
|
N
Амоніак
R-
NH2 R-NH-R R-N(R)-R
на:
Визначте, які з амінів первинні, вторинні, третинні:
![]() СН3-NH-СН3, (СН3)3-N, СН3-NH2, С2Н5-N –(СН3)2
СН3-NH-СН3, (СН3)3-N, СН3-NH2, С2Н5-N –(СН3)2
За особливостями будови вуглеводневого залишку аміни класифікують
- насичені (СН3-NH2)
- ненасичені СН3-СН=СН - NH2
- ароматичні (С6Н5- NH2)
![]() Загальна формула насичених амінів: R-NH2 або СnH2n+1NH2
Загальна формула насичених амінів: R-NH2 або СnH2n+1NH2
![]()
вуглеводневий залишок аміногрупа
Ізомерія насичених амінів обумовлена:
- ізомерією карбонового ланцюга (починаючи з С4) СН3-СН2-СН2-СН2- NH2 або СН3 –СН- СН2- NH2
|
СН3
- місцем аміногрупи (починаючи з С3) СН3-СН2-СН2-NH2 СН3-СН-СН3
|
NH2
- кількістю залишків, сполучених з аміногрупою: С3Н7-NH2, СН3-СН2- NH–СН3, (СН3)3-N
Як бачимо, виникає проблема у розрізненні цих ізомерів.
Номенклатура насичених амінів Первинні аміни:
СН3-NH2 - метиламін (метанамін) С2Н5-NH2 – етиламін (етанамін)
СН3-СН2-СН2- NH2 пропан-1-амін СН3-СН( NH2) –СН3 пропан -2-амін
СН3-СН (СН3)-СН2- NH2 2-метилпропан-1-амін
Вторинні і третинні аміни:
СН3-NH-СН3 - диметиламін (СН3)3-N - триметиламін Будова молекули метиламіну
Н
| δ- δ+
С2Н5-N –(СН3)2 - етилдиметиламін
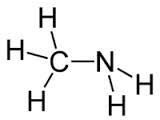 Н – С – N – Н , до атома Нітрогену зміщується
Н – С – N – Н , до атома Нітрогену зміщується
| | електронна густина, тому молекула Н Н полярна.
Така будова аміногрупи визначає певні фізичні властивості амінів
![]() ЗАВДАННЯ
ЗАВДАННЯ
Спрогнозуйте, як впливатиме аміногрупа на: агрегатний стан, розчинність, температури плавлення і кипіння
Фізичні властивості амінів:
С1-С3 – газоподібні, решта рідини або тверді. Газоподібні і рідкі мають неприємний запах. Перші представники розчинні у воді.
Температури кипіння у амінів вищі ніж у вуглеводнів через утворення водневого зв’язку.
Вплив на організм
Аміни, як правило отруйні, токсичні, мають подразнюючу дію на організм, спричиняють порушення дихання, негативно впливають на нервову систему. Утворюються в природі при гнитті органічних решток.
Застосування:
- виробництво полімерів
- синтетичних волокон
- барвників
- лікарських препаратів
- компонент ракетного палива
- Закріплення вивченого матеріалу
 Робота в парах:
Робота в парах:
- Напишіть формули речовин:
- триетиламін
- бутан-2-амін
- діетилметиламі
н
- 2-метилгексан-3-амін
Які з них первинні, вторинні, третинні?
- Зобразіть напівструктурні формули амінів складу С4Н11N.
- Задача. Знайдіть формулу вторинного насиченого аміну, який у 1,551 раза важчий від повітря. (СН3-NH–СН3)
6.Домашнє завдання
Вивчити параграф, виконати вправи.
Підготуватися до захисту навчального проекту 20. Анілін – основа для виробництва барвників.
Аміни як органічні основи. Хімічні властивості метанаміну, аніліну. Одержання аніліну.
Вивчення нового матеріалу
Оскільки атом Нітрогену має неподілену пару електронів, аміни, як і амоніак, проявляють властивості основ, проте вони є сильнішими основами завдяки впливу метильного радикалу, який відштовхуючи від себе електрони, спрямовує їх до аміногрупи: СН3→NH2
Основні властивості посилюються в ряду:
Амоніак< первинні аміни <вторинні аміни <третинні аміни
Хімічні властивості амінів
- Взаємодія з водою
СН3-NH2 + НОН = СН3-NH3ОН ↔ СН3-NH3+ + ОН- йон метиламонію
- З кислотами: СН3NH2 + НCl = СН3NH3Cl –метиламоній хлорид Солі амінів, як і солі амоніаку реагують з лугами:
СН3NH3Cl + NaOH = СН3NH2 + NaCl + H2O
3. Горіння: 4СН3-NH2 + 9О2 = 4СО2 + 2N2 + 10H2О
Добування амінів:
Взаємодія спиртів з амоніаком:
СН3ОН + NH3 = СН3NH2 + Н2О, при подальшій дії спирту утворюється вторинний і третинний амін.
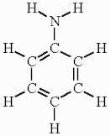 Анілін (феніламін) – найпростіший ароматичний амін, складається з бензольного ядра та аміногрупи.
Анілін (феніламін) – найпростіший ароматичний амін, складається з бензольного ядра та аміногрупи.
До первинних, вторинних чи третинних амінів належить анілін?
Анілін має властивості дещо відмінні від інших амінів, що пояснюється впливом бензольного ядра на аміногрупу і навпаки.
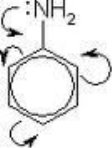 Оскільки в бензені електрони утворюють спільну π- електронну хмару, вони не лише не зміщуються до аміногрупи, а навпаки – неподілена електронна пара Нітрогену зміщується до бензольного кільця. Зменшення електронної густини на атомі Нітрогену призводить до послаблення здатності приєднувати катіон Гідрогену, а отже і взаємодіяти з кислотами. Тому порівняно з амінами, анілін є слабшою основою.
Оскільки в бензені електрони утворюють спільну π- електронну хмару, вони не лише не зміщуються до аміногрупи, а навпаки – неподілена електронна пара Нітрогену зміщується до бензольного кільця. Зменшення електронної густини на атомі Нітрогену призводить до послаблення здатності приєднувати катіон Гідрогену, а отже і взаємодіяти з кислотами. Тому порівняно з амінами, анілін є слабшою основою.
Відповідно посилення основних властивостей відбуватиметься таким чином:
Анілін < амоніак< первинні аміни <вторинні аміни <третинні аміни
Проте аміногрупа здійснює вплив і на бензольне кільце: електронна густина зміщується в орто- і пара-положення і Гідрогени там стають більш рухливими, тому легко відриваються.
Властивості аніліну
Спробуйте передбачити і пояснити фізичні властивості аніліну:
-
 Агрегатний стан (безбарвна масляниста рідина)
Агрегатний стан (безбарвна масляниста рідина)
- Температура плавлення і кипіння (-6ºС і +184ºС)
- Розчинність у воді (низька)
Отруйний !!!
(демонстрація)
Хімічні властивості
Як ви гадаєте, в чому буде відмінність між аніліном та іншими амінами?
1. Горіння: 4С6Н5NH2 +31О2 = 24СО2 + 2N2 + 14H2О
- Взаємодія з кислотами: С6Н5NH2 + НCl = С6Н5NH3Cl – феніламоній хлорид
(демонстрація)
- Реакція з бромом (якісна реакція)
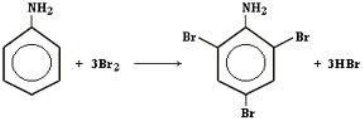 2,4,6 – триброманілін (білий осад)
2,4,6 – триброманілін (білий осад)
С6Н5NH2 + 3Br2 = С6Н2Br3NH2 + 3HBr
Добування аніліну:
Реакція Зініна – відновлення нітробензену атомарним воднем:
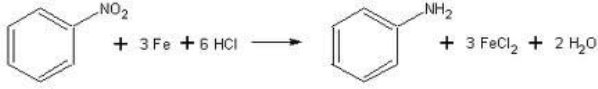
або С6Н5NО2 + 6[Н] = С6Н5NH2 + 2Н2О
Застосування аніліну: (повідомлення учнів)
Захист навчальних проектів:
20. Анілін – основа для виробництва барвників.
Вплив на організм (повідомлення учнів)
![]()
![]()
Спробуйте сформулювати основні правила техніки безпеки
- Закріплення вивченого матеріалу
 Бесіда:
Бесіда:
- З якими сполуками проявляє подібність анілін? В чому його відмінність?
- Яке більше значення аніліну: позитивне чи негативне? Обґрунтуйте думку
Робота в групах:
Практичне завдання:
У трьох пробірках містяться:
- гліцерин, анілін, оцтовий альдегід
- бензен, оцтова кислота, анілін. Як їх відрізнити?
Знайдіть помилки у твердженнях та виправте їх.
- Анілін належить до ароматичних амінів, його молекула складається з бензольного ядра і нітрогрупи.
- В аніліні проявляється взаємний вплив атомів та груп атомів у молекулі.
- Наявність бензольного ядра посилює основні властивості аніліну, а присутність аміногрупи збільшує рухливість атомів Гідрогену у мета-положенні.
- Для аніліну характерні слабкі основні властивості, тому він взаємодіє лише із сильними кислотами.
- Перевагою реакції Зініна є те, що в ній використовується молекулярний водень.
Задача
- Обчисліть об’єм метиламіну, що містить 4% домішок, який згорів, якщо при цьому утворилося 4,9 л азоту. (10,2 л)
- При спалюванні аміну масою 11,8 г утворився вуглекислий газ масою 26,4 г, 16,2 г води і азот. Густина речовини за гелієм 14,75. Визначте формулу аміну, складіть формули його ізомерів. (С3Н7NH2)
7. Домашнє завдання
Вивчити параграф, виконати вправи
Задача. Анілін масою 40 г з вмістом домішок 7% прореагував з розчином, що містив надлишок хлоридної кислоти. Яка маса солі утворилася? (51,8 г)
Пара 18
Тема пари: Амінокислоти: склад і будова молекул, загальні і структурні формули, характеристичні (функціональні) групи, систематична номенклатура. Пептидна група. Хімічні властивості аміноетанової кислоти. Пептиди.
Мета пари:
навчальна: сформувати знання про амінокислоти як біфункціональні органічні сполуки, розглянути їх склад, будову, показати амфотерний характер амінокислот, як необхідну передумову їх поліконденсації, cформувати вмінні і навички складати рівняння хімічних реакцій властивих амінокислотам, з’ясувати біологічну роль амінокислот та їх поширення у природі;
розвиваюча: розвивати вміння порівнювати, узагальнювати;
виховна: виховувати самостійність Очікувані результати навчання Знаннєвий компонент
студент називає загальні формули та характеристичні (функціональні) групи амінокислот;
пояснює структурні формули амінокислот; амфотерність амінокислот; зміст понять: пептидна група, поліпептид;
наводить приклади амінокислот.
Діяльнісний компонент
Студент ними формулами; рівняння реакцій, які описують хімічні властивості аміноетанової кислоти (взаємодія з натрій гідроксидом, хлоридною кислотою, утворення дипептиду);
класифікує нітрогеновмісні органічні сполуки за характеристичними (функціональними) групами;
прогнозує хімічні властивості амінокислот, зумовлені особливостями будови їхніх молекул;
характеризує хімічні властивості аміноетанової кислоти; біологічну роль амінокислот;
установлює причинно-наслідкові зв’язки між складом, будовою, властивостями нітрогеновмісних органічних сполук.
Ціннісний компонент
студент висловлює судження про вплив окремих нітрогеновмісних органічних сполук на організм людини;
обґрунтовує застосування речовин їхніми властивостями;
оцінює біологічне значення амінокислот;
робить висновки про властивості амінокислот, виходячи з будови молекул речовин, і про будову речовин, виходячи з їхніх властивостей; на основі спостережень.
Тип пари: комбінований урок
Форми роботи: фронтальна робота, самостійна робота учнів, робота в парах
Методи навчання: словесні (бесіда, пояснення), практичні (виконання вправ).
Обладнання: зразки амінокислот.
Хід пари
- Організаційний етап
- Перевірка домашнього завдання
Комбіноване опитування:
Письмове опитування (додаток 1)
 Учні пояснюють домашнє завдання
Учні пояснюють домашнє завдання
Завдання біля дошки:
-
Скласти рівняння реакцій:
- С2Н5NH2 + НОН =
- С2Н5NH2 + НCl = с. С3Н7NH2 + Н2SO4 =
Фронтальна бесіда:
- Які речовини називають амінами?
- Основні чи кислотні властивості виявляють аміни?
- Який вплив амінів на організм людини?
- Де застосовуються аміни?
- Скласти рівняння реакцій, в які вступає анілін
- Порівняйте анілін з амінами та бензином: що подібного, а в чому відмінність?
- Як впливає будова аніліну на його властивості?
- З чим пов’язане застосування аніліну?
- Сформулюйте правила безпечної поведінки з ним.
- Розташувати речовини за посиленням основних властивостей: метиламін, анілін, амоніак, диметиламін, триметиламін
- Мотивація навчальної діяльності
Вважають, що життя на землі зародилось тоді, коли виникли білки. На сьогодні відомо 2·1018 білків, лише в людському організмі їх є 5 млн. Проте всі ці білки побудовані лише з 20 амінокислот. Як таке можливо? Сьогодні ми це і з’ясуємо.
- Повідомлення теми уроку
-
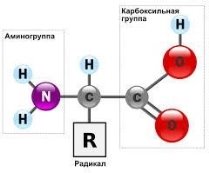 Вивчення нового матеріалу
Вивчення нового матеріалу
З яких частин, судячи з назви, повинні складатися амінокислоти?
Амінокислоти – похідні вуглеводнів, що містять одночасно карбоксильну та аміногрупу.
Аміногрупа R
![]() |NH2 - СН - COOH карбоксильна група
|NH2 - СН - COOH карбоксильна група
Часто молекулу амінокислот називають біполярною, тому що аміногрупа проявляє основні властивості, а карбоксильна – кислотні, як результат, амінокислоти амфотерні сполуки.
Ізомерія амінокислот обумовлена:
- будовою карбонового ланцюга (СН3-СH(СН3)- СH(NH2) – COOH)
- місцем аміногрупи, яке вказують як цифрами, так грецькими літерами (α, β, γ, δ) -
4 γ 3β 2 α 1
(СН3-СH(СН3)- СH(NH2) – COOH)
Номенклатура амінокислот:
- обираємо найдовший ланцюг (обов’язково з аміно – і карбоксильною групою)
- нумеруємо, починаючи з карбоксильної групи (літери з наступного атома Карбону)
- вказуємо місце аміногрупи (цифрою чи літерою)
- вказуємо місце і назви інших замісників
- називаємо головний ланцюг
СH2(NH2) – COOH – аміноетанова кислота (амінооцтова) – гліцин
3 β 2 α 1
СН3 - СH(NH2) – COOH – 2-амінопропанова кислота (α-амінопропанова кислота) – аланін
3 β 2 α 1
СН2(NH2) – СH2– COOH – 3-амінопропанова кислота (β-амінопропанова кислота)
4 γ 3 β 2 α 1
СН3-СH(СН3)- СH(NH2) – COOH – 2 – аміно- 3-метилбутанова кислота - валін
(α – аміно- 3 метилбутанова кислота)
![]() Цікавим є те, що в живих організмах є лише α-амінокислоти.
Цікавим є те, що в живих організмах є лише α-амінокислоти.
Чому α-атом Карбону не перший, а другий?
1. Фізичні властивості амінокислот: (робота з підручником)
- тверді, кристалічні
- розчинні у воді
- деякі мають солодкий смак
- температури плавлення вищі, ніж у відповідних кислот.
Чому амінокислоти так відрізняються від карбонових кислот?
Хімічні властивості:
З якими класами органічних сполук будуть виявляти подібність амінокислоти?
- Взаємодія з лугами:
СH2(NH2) – COOH + NaОН = СH2(NH2) – COONa+ HОН – натрій аміноацетат
- З кислотами:
СH2(NH2) – COOH + НCl = [NH3СH2– COOH]Cl – гліциній хлорид
3.
4. Поліконденсація- взаємодія 2 і більше амінокислот між собою з утворенням полімеру (поліпептиду) і відщепленням води:
![]() пептидна групa
пептидна групa
H – NH - СH2– COOH + NH2 - СH2– COOH = H – N - СH2– CO– NH - СH2– COOH + Н2О
пептидний зв’язок
В такій реакції може брати участь велика кількість амінокислот, утворюючи три-, чотири - і поліпептид. Кількість амінокислот у ньому може досягати кількох сотень, навіть тисяч, формуючи білок. Наприклад, інсулін складається з 51 амінокислоти.
Добування амінокислот:
- Гідроліз білків (у присутності кислот чи лугів)
- Дія амоніаку на галогенопохідні кислот:
- СH3 – COOH + Cl2 = ClСH2– COOH + HCl
- ClСH2– COOH + 2NH3 = СH2(NH2) – COOH + NH4Cl
5. Закріплення вивченого матеріалу
Бесіда:
 ні?
ні?
- Чому 2 амінокислоти можуть взаємодіяти між собою, а дві кислоти
- Чим відрізняється поліконденсація від полімеризації?
- Яке значення амінокислот для організму?
Робота в парах:
-
Напишіть формули речовин:
- 2- аміно-3-етилпентанова кислота
- β-аміно – 2,3,4-триметилгексанова кислота
- Складіть формули всіх ізомерів α-амінопентанової кислоти, назвіть їх.
- Задача На нейтралізацію 25 г амінокислоти витратили 45 г 25%-го розчину натрій гідроксиду. Яка формула амінокислоти? (NH2СH2СH2COOH)
6. Домашнє завдання
Вивчити параграф, виконати вправи.
Додаток 1
Тестові завдання:
- До якої групи органічних речовин належать аміни:
- оксигеновмісні
- нітрогеновмісні
- галогеновмісні
- вуглеводні
- Яка з функціональних груп називається аміногрупою:
- – СООН b) - ОН; c) -СОН d) –NH2
- Виберіть загальну формулу третинних амінів: а) R-NH2 b) R-NH-R c) R-N-R
R
- Серед запропонованих амінів виберіть вторинні аміни: a)СН3-NH-СН3, b) СН3-NH2, c) (СН3)3-N, d)С2Н5-NH–СН3
- Вкажіть амін, що за звичайних умов газом:
a) диетиламін, b) метиламін,
c) бутан-1-амін
- Назвіть амін, виражений формулою: СН3-СН(С2Н5)-СН2- NH22-етилбутан-1-амін
- 2-етилпропан-1-амін
- 2-етилпропан-3-амін
- Що виражає рівняння реакцій: 4С2Н5-NH2 + 15О2 = 8СО2 + 2N2 + 14H2О
неповне згоряння метиламіну
неповне окиснення амінів горіння амоніаку
горіння етиламіну
- Чим пояснити те, що перші представники гомологічного ряду розчинні у воді:
- наявністю вуглеводневого залишку
- низькою відносною молекулярною масою
- наявністю аміногрупи
- До якої групи амінів належить триметиламін:
первинні вторинні третинні
- Напишіть формулу 3,3-диметилпентан-2-амін
Білки як високомолекулярні сполуки.
Хімічні властивості білків
Вивчення нового матеріалу
Білки ще називають протеїнами, від грец. «протос» - первинний. На білки припадає 50% сухої маси клітини. Білків найбільше міститься в м’язах, вони виконують роль ферментів, гормонів, утворюють слизові оболонки внутрішніхорганів, утворюють клітинну оболонку, а також рогові покриви (пір’я, волосся, нігті).
Білки (поліпептиди) – біологічні полімери, що складаються з α - амінокислот сполучених пептидними зв’язками.
Молекулярна маса білків – від кількох тисяч до кількох мільйонів. Наприклад, інсулін має масу 5700 (складається з 51 амінокислоти), гемоглобін – 68000.
В живих організмах налічується до 5 млн. білків. Кожен з них виконує лише йому властиву функцію. Але всі вони побудовані лише з 20 α - амінокислот. Як таке можливе?
Зміна хоча б однієї амінокислоти у поліпептиді призводить до зміни структури, а, отже, і функцій білка.
Білки, що містять всі амінокислоти називають повноцінними – білки горіхів, гречки, вівса, молока, м’яса, яєць, риби.
В організмі вони виконують найголовніші функції:
- каталітична – ферментативна – пепсин, трипсин
- структурна – кератин рогових покривів, колаген сполучної тканини, еластин
- рухова – актин та міозин м’язових волокон
- транспортна – гемоглобін, міоглобін
- регуляторна – гормони інсулін (51 амінокислота), вазопресин (9), соматотропін (190)
- захисна – антитіла, інтерферон
-
 енергетична – 17 кДж енергії виділяється з 1 г білку
енергетична – 17 кДж енергії виділяється з 1 г білку
- рецепторна – передача нервового імпульсу
Важливим етапом розвитку біологічної та хімічної науки стало вивчення первинної структури білків. Першим було вивчено інсулін Сенгером у 1945 - 54р.Дослідження структури білків сьогодні здійснюється в спеціальному приладі секвенаторі, який відриває по одній амінокислоті, які потім піддають ідентифікації.
Оскільки білки складаються з великої кількості амінокислот, їхня просторова будова досить складна, в ній виокремлюють чотири рівні.
|
Структура |
Просторова будова |
Назва, приклади |
Типи зв’язків |
|
Первинна |
А-А-А-А-А-А- |
Поліпептидний ланцюг |
Пептидні |
|
Вторинна |
|
Спіраль (кератин волосся, нігтів) |
Водневі |
|
Третинна |
|
Глобула (ферменти, гормони) |
Йонні, дисульфідні, водневі, гідрофобні |
|
Четвертинна |
|
Кілька глобул (гемоглобін – 2 по 141 і 2 по146 амінокислот) |
Йонні, дисульфідні, водневі |
Хімічні властивості білків:
- Гідроліз (відбувається під впливом ферментів або кислот, які руйнують пептидні зв’язки, в такій послідовності: білок – поліпептид – дипептид – амінокислота)
NH2-CH2-CONH-CH2-COOH + HOH = NH2-CH2-COOH + NH2-CH2-COOH
- Денатурація – руйнування ІІ, ІІІ, IV структури білка, що веде до втрати його функцій. Можливий зворотній процес – ренатурація – відновлення структури білка.
Денатурацію спричиняють:
- температура
- сильні кислоти, луги,
- солі важких металів (свинець, ртуть, цинк, мідь)
- спирт
- струшування
- радіація.
- Кольорові реакції білків (якісні реакції):
- ксантопротеїнова (для білків, що містять бензольне кільце): білок + нітратна кислота(конц.) = жовте забарвлення при нагріванні;
- біуретова (виявляю пептидні зв’язки):
білок + луг + купрум (ІІ) сульфат = фіолетове забарвлення
Білки бувають:
- Прості (протеїни) – складаються лише з амінокислот
- Складні (протеїди) – містять жири (ліпопротеїни), вуглеводи (глікопротеїни), фосфопротеїни.
Багаті на білок такі харчові продукти: сир та молочні продукти, м'ясо, риба, яйця, горіхи, бобові рослини.
Добова норма людини – 90 г білків.
- Закріплення вивченого матеріалу
Бесіда «Чомучки»:
-
 Чому, коли ввести в кров людині яєчний білок, вона гине, а коли з’їдає його – ні?
Чому, коли ввести в кров людині яєчний білок, вона гине, а коли з’їдає його – ні?
- Чому для людини температури тіла +42ºС є смертельною, а для курей – нормальною?
- Чому хворі на алкоголізм не мають апетиту? Натомість в них часто розвивається виразка, гастрит. Чому?
- В Стародавньому Римі були страшні тортури: людину прив’язували до стовпа, на сонці і годували лише м’ясом, не даючи води. За три дні вона гинула. Чому?
- Чому денатуровані білки не можуть виконувати свої функції?
Завдання:
- Скласти рівняння гідролізу дипептиду, утвореного 2-амінобутановою і 2- амінопропановою вислотою
- Із скількох амінокислот складається білок, що має 5 пептидних зв’язків?
Інструктаж з БЖД.
Лабораторний дослід №. 3. Біуретова реакція.
Лабораторний дослід №. 4. Ксантопротеїнова реакція.
Захист навчальних проектів:
19. Натуральні волокна тваринногопоходження: їхнівластивості, дія на організмлюдини, застосування.
- Синтез білків.
- Збалансоване харчування – запорука здорового життя.
- Виведенняпляморганічногопоходження.
7. Домашнє завдання
Вивчити параграф, виконати вправи
Задача. Масова частка Нітрогену в амінокислоті 18,7%. Визначте формулу амінокислоти. (NH2СH2COOH)
Підготувати повідомлення про біологічне значення амінокислот та білків
Додаток 1.
Варіант 1.
- До нітрогеновмісних речовин належать:
- білки
- вуглевод
и
- аміни
- жири
- естери
- Амінокислоти містять одночасно такі функціональні групи
СООН ОН; СОН; NH2
- Найпростішою амінокислотою є:
- амінооцтова
- амінопропанова
- Амінокислоти мають властивості:
- амінометанова
-
амінобутанова
- кислотні
- основні
- амфотер
ні
- Амінокислоти сполучаються між собою зв’язком
- йонним
- пептидним
- водневим
- металічним
- При полімеризації амінокислот утворюється ….
білок крохмаль
жир
поліетилен
- Як кислоти амінокислоти реагують з …
- Як основи амінокислоти взаємодіють з …
- Назвати амінокислоту: СН3-СH(СН3)- СH(NH2) – COOH
- Написати формулу амінокислоти: 3-аміно-2-етилбутанова кислота
Варіант 2.
- Амінокислотою з найбільшою молекулярною масою є:амінооцтова
- амінопропанова
- До нітрогеновмісних речовин належать:
- амінопентанова
-
амінобутанова
- естери
- білки
- аміни
- жири
е) вуглеводи
- Властивості амінокислот визначаються наявністю в них:гідроксильної групи
- аміногрупи
- карбоксильної групи
- карбонільної групи
- Амінокислоти сполучаються між собою зв’язком
- металічним
- водневим
- пептидним
- йонним
-
 При полімеризації амінокислот утворюється: поліпептид крохмаль жири поліетилен
При полімеризації амінокислот утворюється: поліпептид крохмаль жири поліетилен
- Якісною реакцією на амінокислоти є:
- реакція «срібного дзеркала»
- взаємодія з купрум (ІІ) гідроксидом
- бромування
- реакція з йодом
- Загальна формула амінокислот …
- Ізомерія амінокислот буває …..
- Назвати амінокислоту: СН2NH2-СH(С2Н5)- СH2 – COOH
- Написати формулу амінокислоти: 2-аміно-4-метилгексанова кислота
Розв’язування розрахункових задач
Мета пари:
навчальна: продовжувати формувати вміння складати рівняння реакцій хімічних перетворень нітрогеновмісних органічних речовин та розв’язувати розрахункові задачі за їх участю;
розвиваюча: розвивати вміння порівнювати, узагальнювати, систематизувати;
виховна: виховувати самостійність, ініціативність, колективізм
Очікувані результати навчання
Діяльнісний компонент
учень розв’язує задачі на виведення молекулярної формули речовини за масовими частками елементів, обґрунтовуючи обраний спосіб розв’язання; на виведення молекулярної формули речовини за масою, об’ємом або кількістю речовини реагентів або продуктів реакції, обґрунтовуючи обраний спосіб розв’язання.
обчислює за хімічними рівняннями кількість речовини, масу або об’єм за кількістю речовини, масою або об’ємом реагенту, що містить певну частку домішок, обґрунтовуючи обраний спосіб розв’язання.
Тип уроку: урок формування вмінь та навичок
Форми роботи: фронтальна робота, самостійна робота учнів, робота в групах Методи навчання: словесні (бесіда, пояснення), практичні (виконання вправ). Обладнання: картки із завданнями
Хід уроку
- Організаційний етап
- Перевірка домашнього завдання
Письмова робота (додаток 1.)
Усне опитування:
- в чому полягає біологічне значення білків?чи вірне твердження: «життя без білків неможливе»?
- люди якої вікової категорії найбільше потребують повноцінного білкового харчування?
- Повідомлення теми уроку
- Узагальнення і систематизація знань
Фронтальна робота з класом
Бесіда:
- Що подібного у будові нітрогеновмісних речовин?
- Які спільні хімічні властивості у нітрогеновмісних речовин?
- Наведіть приклади нітрогеновмісних речовин, які мають властивості:
- основні
- кислотні
- амфотерні
Завдання 1.
- Назвати речовини, вказати клас, до якого вони належать:
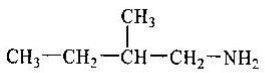
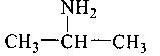
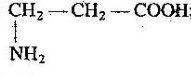
![]()
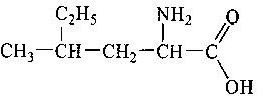
- Скласти рівняння реакції гідролізу трипептиду, назвати продукти реакції:
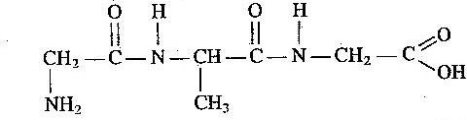
-
Здійснити перетворення:
- СН4 – С2Н2 – С6Н6 – С6Н5NO2 – C6H5NH2 - C6H2Br3NH2
- пропен – пропаном – пропаналь – пропанова кислота – 3-хлорпропанова кислота – 3-амінопропанова кислота
- Задача. α- амінопропанову кислоту кількістю речовини 2,5 моль нейтралізували розчином натрій гідроксиду з масовою часткою лугу 20%. Визначте масу використаного розчину лугу. (500 г)
4. Задача. На нейтралізацію амінокислоти масою 103 г витратили 133,6 мл розчину калій гідроксиду з масовою часткою лугу 32% та густиною 1,31г/мл. Визначте молекулярну формулу кислоти, складіть формули можливих ізомерів.. (NH2СH2СH2СН2COOH)
Робота в групах за картками із окремими завданнями Група 1.
- Складіть рівняння реакцій даної амінокислоти з
- натрій гідроксидом
- хлоридною кислотою
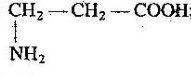
- .Назвіть амінокислоту, складіть формули 2 її ізомерів, дайте їм назви
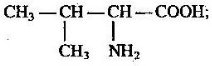
- Складіть формули:
- 3-етил-2,3,4-триметилпентан-1-амін
- β-аміно-2,3-диетилгексанова кислота
- Обчисліть, яку масу аніліну можна отримати з 150 г нітробензену, що містить 4% домішок? (109 г)
Група 2.
- Складіть рівняння реакцій даної амінокислоти з:
- калій гідроксидом
- бромідною кислотою
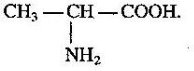
- Назвіть амінокислоту, складіть формули 2 її ізомерів, дайте їм назви:
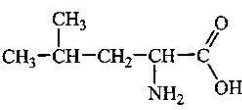
- Складіть формули:
- 2-етил-3,3-диметилгексан-1-амін
- α-аміно-2,2-дихлоргептанова кислота
4.Яку масу 10%-го розчину 2-амінопропанової кислоти потрібно взяти для нейтралізації 0,4 моль натрій гідроксиду? (356 г)
Група 3.
- Складіть рівняння реакцій між амінокислотами:
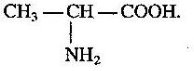
 і
і
- .Назвіть амінокислоту, складіть формули 2 її ізомерів, дайте їм назви
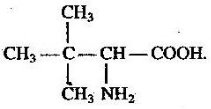
- Складіть формулу:
- γ-аміно-3-етил-2,2-диметилпентанова кислота
- 4-метилбутан-2-амін
- На нейтралізацію 25 г амінокислоти витратили 45 г 25%-го розчину натрій гідроксиду. Яка формула амінокислоти?
- Домашнє завдання
Повторити розділ «Нітрогеновмісні речовини». Виконати вправи. Підготуватися до контрольної роботи.
Додаток 1.
Контрольна робота №2 «Нітрогеновмісні органічні речовини».
Мета уроку:
навчальна: визначити рівень навчальних досягнень учнів з теми, ступінь оволодіння базовими поняттями теми, розуміння взаємовідношень і залежностей, з’ясувати рівень сформованості вмінь розв’язувати розрахункові та експериментальні задачі, здійснювати перетворення речовин, складати формули ізомерів та називати їх за систематичною номенклатурою;
розвиваюча: розвивати вміння порівнювати, робити висновки, узагальнювати;
виховна: виховувати самостійність, наполегливість.
Тип уроку: урок контролю знань, вмінь, навичок.
Форми роботи: самостійна письмова робота.
Обладнання: завдання для письмової роботи
Хід уроку
- Організаційний етап
- Проведення контрольної роботи
Проводиться за окремими варіантами (додаток 1.)
- Підсумки уроку,домашнє завдання
Повторити основні класи органічних сполук.
Додаток 1.
Варіант 1.
- Виявити білки в органічних речовинах можна за допомогою:a. реакції «срібного дзеркала»
- індикатором
- біуретової реакції
|
b. |
|
йоду |
|
|
2. |
|
Первинна структура білка – це: |
|
|
a. |
|
дволанцюгова спіраль |
c. одноланцюгова спіраль |
|
b. |
|
послідовністьамінокислот |
d. глобула |
|
|
3. |
Анілін належить до: |
|
|
|
a. |
амінокислот |
c. третинних амінів |
|
|
b. |
ароматичних амінів |
d. білків |
- Чим відрізняється денатурація і гідроліз білків?
-
Скласти рівняння реакцій:
- СН3NH2+ O2 =
- С2Н5NH2+ HCl =
- NH2 – СH2– COOH + КОН =
-
Напишіть формули:
- 2,3-диметилпентан-1-амін
- 2-амінобутанова кислота
- 3-аміно-4-метилгексанова кислота
- Який об’єм кисню потрібний для спалювання 93 г метиламіну?
- У трьох пробірках без етикеток містяться наступні речовини: оцтова кислота, білок, глюкоза. Складіть план розпізнавання цих речовин, вкажіть основні галузі їх застосування.
- Яку масу натрій гідроксиду потрібно взяти для нейтралізації 400 г 60%
-го розчину аміноетанової кислоти?
Додаткове завдання
- Масові частки елементів у органічній речовині: Карбону 53,33%, Гідрогену – 15,55% і Нітроген. Густина пари за повітрям 1,551. Визначте формулу речовини, складіть формули ізомерів, назвіть їх.
Варіант 2Мономерами білків є:
- амінокислоти
- глюкоза
- нуклеотиди
- етилен
-
Білки в організмах не виконують функції (кілька відповідей):
- рухова, захисна
- збереження спадкової інформації
-
При горінні амінів утворюються
- вуглекислий газ, вода,
азот
- вода, вуглекислий газ
- енергетична, транспортна
- запасаюча, теплоізоляція
- азот, вуглекислий газ
- чадний газ, вуглекислий газ
- З якими класами сполук виявляють подібність амінокислоти? Як це проявляється у їх властивостях?
-
Скласти рівняння реакцій:
- С2Н5NH2+ O2 =
- СН3NH2+ HCl =
-
Напишіть формули:
- 3-етил-5-метилгексан-2-амін
- 3-амінопентанова кислота
- 2-аміно-3- етилгептанова кислота
с.NH2 –СH2–COOH + HCl =
- Яку масу калій гідроксиду потрібно взяти для нейтралізації 0,5 моль амінооцтової кислоти?
- У трьох пробірках без етикеток містяться наступні речовини: анілін, крохмаль, оцтовий альдегід. Складіть план розпізнавання цих речовин вкажіть основні галузі їх застосування.
- Обчисліть об’єм азоту, що утвориться при спалюванні 40 г метанаміну, якщо останній містить 22,5 % негорючих домішок.
Додаткове завдання
- Масові частки елементів у органічній речовині: Карбону 61,02%, Гідрогену – 15,25% і Нітроген. Густина пари за вуглекислим газом 1,342. Визначте формулу речовини, складіть формули її ізомерів.
Тема 5. Синтетичні високомолекулярні речовини і полімерні матеріали на їх основі
Пара 19
Тема пари: Синтетичні високомолекулярні речовини. Полімери. Реакції полімеризації і поліконденсації. Пластмаси.
Мета пари:
навчальна: продовжувати формувати в учнів уявлення про полімери на прикладі синтетичних сполук, ознайомити із складом і застосуванням полімерних матеріалів, їх класифікацією, розширити знання про реакції полімеризації і
поліконденсації, ознайомити учнів із складом та будовою деяких полімерних матеріалів, властивостями термопластичних і термореактивних полімерів;
розвиваюча: розвивати вміння порівнювати, систематизувати;
виховна: виховувати самостійність Очікувані результати навчання Знаннєвий компонент
учень пояснює суть поняття полімер; реакцій полімеризації і поліконденсації як способів добування полімерів;
наводить приклади синтетичних високомолекулярних речовин і полімерних матеріалів на їх основі; рівнянь реакцій полімеризації і поліконденсації.учень
Діяльнісний компонент
учень розрізняє реакції полімеризації і поліконденсації; пластмаси; дотримується правил безпечного поводження з синтетичними матеріалами. Тип уроку: урок засвоєння нових знань
Форми роботи: фронтальна робота, самостійна робота учнів, індивідуальна робота
Методи навчання: словесні (бесіда, пояснення), наочні (демонстрація), практичні (виконання вправ).
Обладнання: зразки полімерів, набір реактивів згідно інструкції.
Хід пари
- Організаційний етап
- Актуалізація опорних знань
 Бесіда:
Бесіда:
- Що таке полімери? Які полімери ви знаєте?
- Що спільного у будові полімерів?
- Як називається реакція їх утворення?
- Як називається елементарна частинка полімерів?
- Які вам відомі синтетичні полімери?
- Мотивація навчальної діяльності
Уявіть ситуацію: вчені не відкрили реакцію полімеризації і до цього часу не винайшли полімери. Що б змінилося у нашому житті?
- Повідомлення теми уроку
- Вивчення нового матеріалу
Високомолекулярні сполуки (ВМС) – це сполуки з великою відносною молекулярною масою (від тис - до млн.), що складаються з великої кількості однакових мономерних ланок, сполучених між собою.
Природними ВМС є білки, нуклеїнові кислоти, полісахариди. Однак значне місце займають синтетичні ВМС добуті людиною. До них належить поліетилен, поліпропілен та ін.. Саме вони стали основою сучасних полімерних матеріалів.
Будова полімерів:
![]()
![]()
![]() nСН=СН2 → - (СН- СН2 -)n – n - ступінь полімеризації СН3 СН3
nСН=СН2 → - (СН- СН2 -)n – n - ступінь полімеризації СН3 СН3
мономер полімер елементарна (мономерна) ланка Відносна молекулярна маса полімеру обчислюється так: Мг(полімеру)= n * Мг(мономеру)
![]() Яка відносна молекулярна маса поліпропілену, якщо ступінь полімеризації 2000?
Яка відносна молекулярна маса поліпропілену, якщо ступінь полімеризації 2000?
Класифікація полімерів:
- лінійні (целюлоза, поліетилен)
- розгалужені (амілопектин)
- сітчасті (фенолоформальдегідні смоли)
Полімери у твердому стані можуть мати на одних ділянках впорядковане розміщення, а на інших безладне, тому їх характеристикою є ступінь кристалічності – частка речовини з впорядкованим розміщенням макромолекул (90% - кристалічна будова, 10% аморфна)
Властивості полімерів
Як ви гадаєте, як впливає будова на властивості полімерів?
Властивості полімерів визначаються масою, довжиною, типом будови.
Деякі з полімерів після нагрівання і охолодження не зазнають перетворень і зберігають свої властивості, їх називають термопластичними (поліетилен, поліпропілен).
Термореактивні після нагрівання втрачають пластичність і розчинність в органічних розчинниках , тому що їхня структура змінюється (фенолоформальдегідні смоли).
Спробуйте передбачити хімічні властивості полімерів
Полімери розкладаються на мономери, реагують з сильними окисниками, концентрованими розчинами кислот і лугів. Виняток - поліетилен, поліпропілен. Чому?
4. Добування полімерів
Полімеризація – сполучення великої кількості однакових молекул (мономерів) у полімерний ланцюг
Поліконденсація – реакція утворення полімеру, під час якої відщеплюється молекула води чи ін..
Співполімеризація – реакція утворення полімеру з мономерів двох видів (фенолоформальдегідні смоли)
Найпоширенішими полімерами є:
поліетилен nСН2=СН2 → (- СН2- СН2–)n – (плівка, тара, ізоляція, труби)
поліпропілен -
![]()
![]()
![]()
![]() СН=СН2 + СН=СН2 → -СН- СН2 - СН - СН2 – (труби, іграшки, деталі апаратури,
СН=СН2 + СН=СН2 → -СН- СН2 - СН - СН2 – (труби, іграшки, деталі апаратури,
СН3 СН3 СН3 СН3 волокна, має високу твердість, стійкий до тертя)
![]()
![]()
![]()
![]() полівінілхлорид – штучна шкіра, лінолеум, гумові чоботи, рукавички, труби. СН=СН2 + СН=СН2 → - СН- СН2 - СН - СН2 -
полівінілхлорид – штучна шкіра, лінолеум, гумові чоботи, рукавички, труби. СН=СН2 + СН=СН2 → - СН- СН2 - СН - СН2 -
Сl Сl Сl Сl
політетрафторетилен (тефлон): (-СF2 – CF2-)n – покриття посуду
Для цих полімерів спільними властивостями є: стійкість до кислот, лугів, хороші ізоляційні властивості, термопластичність, морозостійкість. Однак вони не витримують нагрівання (1000), горять, при цьому розкладаючись.
Пластмаси – матеріали на основі полімерів, що зберігають після нагрівання і наступного охолодження надану їм форму.
Крім полімерів пластмаси можуть містити добавки (крейда, сажа, волокна, папір).
Переваги пластмас:
- низька вартість, легкість обробки
- хороші ізоляційні якості
- мала густина
- хімічна стійкість
Недоліки:
- низька теплостійкість і горючість
- важкість утилізації
- Закріплення вивченого матеріалу
 Бесіда:
Бесіда:
- Які речовини можуть полімеризуватися?
- Який полімер: поліетилен чи полівінілхлорид є більш небезпечним?
- Чим відрізняється мономер і мономерна ланка поліпропілену?
- Які з сполук можуть вступати в реакцію полімеризації, а які – в реакцію поліконденсації: пропен, аміноетанова кислота, дибромоетен?
Задача.
Молекула мономера складається з двох атомів Карбону і атомів двох галогенів. Масова частка Карбону 20,6%, а Хлору 30,47%. Визначте формулу мономера. Складіть рівняння його полімеризації. (С2ClF3)
Захист навчальних проектів:
- Перспективи одержання і застосування полімерів із наперед заданими властивостями.
- Дослідження маркування виробів із полімерних матеріалів і пластмас.
- Виготовлення виробів із пластикових пляшок.
7. Домашнє завдання
Вивчити параграф, виконати вправи.
Задача. Середня молекулярна маса зразка поліпропілену 21000. Який ступінь полімеризації полімеру? (500)
Каучуки, гума.
Мета уроку:
навчальна: ознайомити учнів з каучуками та гумою, з’ясувати їх склад, властивості, застосування, основні методи добування, показати значення хімії у створення нових матеріалів;
розвиваюча: розвивати вміння порівнювати, застосовувати набуті знання в повсякденному житті;.
виховна: розширити науковий світогляд учнів, виховувати екологічну культуру учнів
Очікувані результати навчання
Знаннєвий компонент
учень наводить приклади синтетичних високомолекулярних речовин і полімерних матеріалів на їх основі.
Діяльнісний компонент
учень розрізняє каучуки, гуму;
описує властивості полімерних матеріалів;
установлює причинно-наслідкові зв’язки між складом, будовою, властивостями та застосуванням полімерів.
Тип уроку: комбінований урок
Форми роботи: фронтальна робота, самостійна робота учнів.
Методи навчання: словесні (бесіда, дискусія), наочні (демонстрація), практичні (виконання вправ, лабораторний дослід).
Обладнання: колекція «Каучуки», зразки виробів з гуми
Хід уроку
- Організаційний етап
- Перевірка домашнього завдання
Усне опитування:
-
 Що таке високомолекулярні сполуки?
Що таке високомолекулярні сполуки?
- Як вони утворюються?
- Охарактеризуйте будову полімерного ланцюга
- Як класифікують полімери за будовою?
- Чим відрізняються термореактивні і термопластичні полімери?
Письмові завдання:
Написати рівняння реакції утворення:
- поліпропілену
- поліетилену
- полівінілхлориду
Задача. Відносна молекулярна маса поліетилену 1400. Який ступінь полімеризації у ньому?
- Мотивація навчальної діяльності
У Центральній і Південній Америці на берегах річки амазонки росте незвичайне дерево - бразильська гевея. Сік дерева тубільці назвали «каучук» -
«сльози дерева». З цього соку вони робили пружні м’ячі, якими залюбки гралися діти. Де зараз використовується ця речовина?
- Повідомлення теми уроку
- Вивчення нового матеріалу
У 18 ст. зразки каучуку потрапили в Європу, але там виявилося що каучук водонепроникний і еластичний у вузькому інтервалі температур. Коли ж у 1839 – 1843 р було відкрито процес вулканізації потреба в каучуку зросла.
Для сучасного автомобіля потрібно 250 кг каучуку, для літака – 600 кг, а на військовий корабель – 70 т.
Англійський вчений Фарадей у 1826 р визначив склад каучуку – (С5Н8)n
Каучуки – полімери рослинного або синтетичного походження, з яких виготовляють гуму. Їх характерна властивість – висока еластичність, однак при нагрівання чи охолодженні до -50°С вони втрачають цю властивість. Каучуки водонепроникні, зносостійкі, хороші ізолятори.
Натуральний каучук має білий колір, легший за воду, розчиняється в бензині.
Добування каучуків:
- Першим синтетичним каучуком було добуто бутадієновий каучук у 1931 р за методом С.В.Лебедєва (шина на його автомобілі прослужила 16 тис км пробігу).
![]()
бута-1,3-дієн
- ізопреновий (аналог природного):

Ізопрен (2-метилбута-1,3-дієн)
- хлоропреновий
nСН2=С - СН=СН2→ (-СН2-С=СН-СН2-)n
| |
Сl Сl
![]() Назвіть вихідну речовину для хлоропренового каучуку
Назвіть вихідну речовину для хлоропренового каучуку
У 18 столітті шматочками каучуку найчастіше стирали написане на папері. В 1819р. шотландський інженер Чарльз Макінтош запропонував розчиняти каучук у маслі, яке добували внаслідок перегонки кам’яновугільної смоли. Він заснував першу фабрику по виробництву водонепроникного одягу. Проте цей одяг був чутливий до зміни температури – з підвищенням її вироби ставали липкими і мали неприємний запах, а із зниженням ставали жорсткими і ламалися на згинах.
Почалися пошуки речовин, які б запобігли цим небажаним властивостям. Каучук змішували з різними хімічними сполуками але безуспішно. Лише в 1839р. Ч. Гудьїр під час проведення дослідів випадково упустив пластинку каучуку, на якій була сірка, на розжарену плиту і виявив, що з липкої маси каучук перетворився на пружну еластичну речовину, яка не боїться тепла і холоду.
Отже, каучуки є основою гуми. Для її виготовлення здійснюють вулканізацію
-
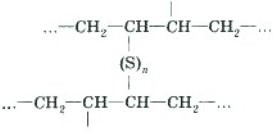 нагрівання каучуку з сіркою. При цьому до каучуку додають наповнювачі – глину, сажу, крейду, вони подовжують термін придатності гуми. При взаємодії з сіркою розривається частина подвійних зв'язків і карбонові ланцюги
нагрівання каучуку з сіркою. При цьому до каучуку додають наповнювачі – глину, сажу, крейду, вони подовжують термін придатності гуми. При взаємодії з сіркою розривається частина подвійних зв'язків і карбонові ланцюги
«зшиваються» S – S зв’язками. При надлишку сірки всі подвійні зв’язки руйнуються і утворюється твердий ебоніт.
Гума є стійкішою до органічних розчинників, але руйнується концентрованими нітратною та сульфатною кислотами.
Поясніть причини цього
Демонстрація 13. Зразки каучуків, гуми.
Застосування гуми:
- виробництво шин
- взуття
- медичних і спортивних товарів
- ізоляційних матеріалів
Екологічний вплив
Відходи гуми не руйнуються в природі, тому їх утилізують: спалюють, термічно розкладають, переробляють на будматеріали, сировину для доріг.
- Закріплення вивченого матеріалу
 Бесіда:
Бесіда:
- Яке значення мало відкриття процесу вулканізації каучуку?
- Які переваги гуми порівняно з каучуком
- Запропонуйте методи повторного використання, переробки або утилізації виробів з гуми.
- Поясніть, до яких наслідків може привести спалювання автомобільних
шин
Задача. Обчисліть об’єм кисню і повітря, який витрачається для спалювання
такої кількості бутадієнового каучуку, яка витрачається на виготовлення одного автомобіля (250 кг). (570 м3, 2850 м3)
- Домашнє завдання
Вивчити параграф.
Підготувати повідомлення про застосування каучуку, гуми.
ХХІ століття можня справедливо назвати ерою полімерів або ерою пластмас, оскільки жодна із сфер людського життя без них не обходиться.
Найважливіші полімери
(самостійна робота учнів з підручником)
|
Назва |
Мономерна ланка |
Властивості |
Застосування |
|
Поліетилен |
(-СН2-СН2-)n |
термопластичний, стійкий до кислот та лугів, окисників (крім галогенів), нерозчинний у воді, розчинний у |
виготовлення труб, пакувальної плівки, тари, побутових предметів, посуду для |
|
|
|
органічних розчинниках, легко плавиться, горить |
зберігання реактивів, ізоляційних матеріалів |
|
Поліпропі- лен |
(-СН2-СН (СH3 -)n |
термопластичний, стійкий до тертя, твердий |
волокна, труби, деталі апаратури, іграшки, посуд, ізоляція |
|
Полівініл- хлорид |
(-СН2-СН(CH -)n |
стійкий до кислот, лугів, органічних розчинників, при 1100 розкладається, твердий,термопластичний, погано горить |
виробництво штучної шкіри, лінолеуму, волокон, труб, тари, ізоляції, захисних рукавичок та чобіт |
|
Полістирол (пінополісти- рол) |
(-СН2-СН -)n | С6Н5 |
термопластичний, не реагує з кислотами, розчинний в деяких орг. розчинниках, легко склеюється, неміцний, термонестійкий, горючий (виділяє отруйні речовини) |
виготовлення облицювальних плит, ізоляції, медичних приладів, посуду, тари для продуктів, іграшок, шоломів, |
|
Поліметил- метакрилат (органічне скло – плексиглас) |
|
прозорий, легкий, міцний, волого-, морозо-, світлостійкий, розчинний у орг. розчинниках, при 1200 розм’якшується, легко загоряється |
замінник скла в транспорті, приладах, техніці, акваріумах, виготовлення декоративних плиток |
|
Феноло- формаль- дегідні смоли |
[-С6Н3(ОН)- СН2-]n |
термореактивні, термостійкі, нерозчинні в орг. розчинниках, при нагріванні розкладаються з виділенням альдегіду |
електрообладнання, виготовлення меблів, тирсоплит, склопластику |
- Закріплення вивченого матеріалу
Завдання
- Які з вивчених полімерів, на вашу думку, є:
- найбезпечнішими для здоров’я людини
-
 небезпечними для людини
небезпечними для людини
- хімічно найстійкішими
- Запропонуйте свої способи утилізації виробів з полімерів
-
 Фенолоформальдегідні смоли добувають реакцією співполімеризації фенолу та формальдегіду. Знаючи
Фенолоформальдегідні смоли добувають реакцією співполімеризації фенолу та формальдегіду. Знаючи
властивості вихідних речовин, спробуйте передбачити вплив полімерів на організм людини
- Склад полівінілацетату (клею ПВА) подібний до полівінілхлориду, але містить замість хлору ацетатну групу, складіть рівняння реакції його полімеризації
Задача. Обчисліть масові частки елементів уплексигласі.
Захист навчальних проектів:
Рециклінг як єдиний цивілізований спосіб утилізації твердих побутових відходів.
Переробка побутових відходів в Україні та розвинених країнах світу.
- Домашнє завдання
Вивчити параграф, виконати вправу
Задача. Який об’єм етену потрібно взяти для отримання 3 кг поліетилену?
(3,3 м3)
Здавна для виготовлення свого одягу людина користувалася природними волокнами, одержуваними з бавовни, льону, вовни деяких тварин, з ниток, випрядених гусеницею шовковичного шовкопряда. Цілком природно, що ці природні джерела виявилися недостатніми, щоб цілком задовольнити все зростаючу потребу в тканинах.
Саме тому поряд з природними волокнами створювали штучні (в основі яких природна сировина – целюлоза, яка в процесі переробки піддається ряду перетворень). А згодом людство засобами хімічної науки навчилося одержувати і синтетичні волокна, тобто такі, основу яких складають не природні високомолекулярні речовини, а синтетичні полімери. Одними з перших синтетичних волокон стали відомі нейлон і капрон.
Класифікація волокон
|
|
Волокна |
||||
|
природні |
хімічні |
||||
|
рослинні |
тваринні |
штучні |
синтетичні |
||
|
бавовна, льон |
шовк, шерсть |
віскозне, ацетатне |
поліамідні капрон, нейлон, |
поліестерні лавсан |
|
|
целюлоза |
білкові полімери |
целюлоза оброблена хімічними речовинами |
поліконденсація амінокислот, амінів |
поліконденсація кислоти з спиртом |
|
|
тканини, одяг |
тканини, одяг |
канати, одяг, сітки, килими |
канати, шланги, штучне хутро, ковдри, ізоляція, вітрила, |
||
Речовини, що утворюють ці волокна, за своєю будовою подібні до білкових речовин шовку. Молекули усіх волокон мають лінійну будову і складаються з повторюваних ланок. Такими ланками в молекулах целюлози будуть залишки молекул глюкози. У молекулах білку натурального шовку, вовни ланками є залишки амінокислот:
Довгі ланцюжки молекул іншого синтетичного волокна – капрону, що є винаходом радянських учених, - побудовані з повторюваних ланок – залишків амінокапронової кислоти NH2–(CH2)5–COOH.
Добування капрону:
nNH2(CH2)5COOH → [-NH(CH2)5CO-]n + nН2О
ε-амінокапронова кислота капрон
Нагріту грузлу смолу продавлюють через тонкі отвори - фільєри. Охолоджуваний повітрям струмінь застигає, утворюючи волокно. Швидкість утворення волокон тут дуже велика – 1000 м /хв. Далі волокна піддаються розтягуванню на барабанах, що обертаються з різною швидкістю; при цьому вони подовжуються в кілька разів. Молекули, що утворять їх, раніше ніби зморщені, випрямляються і розташовуються по осі волокна. Від цього міцність волокна сильно зростає.
З капрону можна одержувати настільки тонкі волокна, що нитка довжиною 9 км буде важити усього лише 6 г.
Волокна нейлону і капрону мають міцність, яка значно перевищує міцність природних і штучних волокон. Вироби з них мають багато й інших чудових властивостей. Вони не гниють, не поїдаються міллю. Після прання вони швидко сохнуть і не деформуються. Ці вироби не гігроскопічні і не знижують своєї міцності від вологи, як це спостерігається в штучних волокон, і навіть у натурального шовку.
Волокно лавсан за хімічною природою є поліестером. Вихідні речовини для його одержання – двохосновная терефталева кислота
![]()
![]() HOOC– –COOH і двохатомний спирт етиленгліколь HO–CH2–CH2–OH.
HOOC– –COOH і двохатомний спирт етиленгліколь HO–CH2–CH2–OH.
При відомих умовах ці речовини вступають між собою в реакцію естерифікації так, що в кожного з них взаємодіють при цьому обидві функціональні групи. У результаті утвориться високомолекулярна смола лавсан.
Одержувані зі смоли лавсан волокна характеризуються великою міцністю, значною стійкістю до високих температур, світла та інших реагентів. Тканини з лавсану не мнуться і не втрачають згодом надану їм форму.
- Закріплення вивченого матеріалу
![]() Завдання
Завдання
- Які хімічні реакції лежать в основі синтезу синтетичних волокон??
- Які переваги синтетичних волокон, порівняно з натуральними? А недоліки?
- Яким чином можна відрізнити природні та синтетичні волокна?
- Як ви гадаєте, тканини з яких волокон переважатимуть у гардеробі людини ХХІІ століття?
Захист навчальних проектів:
Синтетичні волокна: їх значення, застосування у побуті та промисловості.
Практикум.
- Прокласифікуйте волокна, наведені у додатку 1. за їх походженням.Проаналізуйте склад тканин за етикетками, наведеними нижче, порівняйте в них вміст природних, штучних та синтетичних волокон.



-
Домашнє завдання
- Вивчити параграф. Аналіз етикеток одягу.
- Задача. Яку масу капрону можна отримати з 80 кг технічної амінокапронової кислоти, якщо вміст домішок у ній 10%? (62,1 кг)
Підготувати повідомлення про застосування природних, штучних та синтетичних волокон.
Додаток 1.
Умовні позначення волокон на етикетках
Які ж умовні позначення можна зустріти на ярликах і етикетках і що конкретно вони означають? Склад тканин позначається латинськими літерами. Зазвичай, є ще і стрічка з вказівкою співвідношення волокон(сировинний склад, у відсотках). У таблиці приведені основні умовні позначення і їх розшифровка:
|
Код |
Англійське значення |
Переклад |
|
C |
Acetat |
Ацетат |
|
CL |
Chlorofibre |
Хлоридне волокно |
|
CO |
Cotton |
Бавовна |
|
LI |
Flax |
Льон |
|
PA |
Nylon |
Нейлон, поліамід |
|
PE |
Polyethilen |
Полетилен |
|
PI |
Paper |
Целлюлозне волокно |
|
PL |
Polyester |
Поліестер |
|
PP |
Polypropylene |
Поліпропілен |
|
SE |
Silk |
Шовк |
|
TA |
Triacetat |
Триацетат |
|
VI |
Viscose |
Віскоза |
|
WA |
Angora |
Ангора |
|
WM |
Mohair |
Мохер |
|
WO |
Wool |
Шерсть |
Додаток 2.
|
назва |
Зовнішній вигляд |
Як змінюється від нагрі- вання |
Проба на горіння |
Вплив на волокно лугу або кислоти |
|||
|
NaOHр |
NaOHк |
H2SO4р |
H2SO4к |
||||
|
Бавовна |
волокна прямі, однакові за товщною |
не плавиться |
горить яскравим полум’ям з утворенням ажурного попелу, поширюючи запах паленого паперу |
втрачає міцнсть під час кип’ятіння |
набухає, іноді руйнуєт ься |
Руй- нується |
Руй- нується |
|
Шерсть |
хвилясті волокна з незнаним блиском |
внаслідок сильного нагрівання спікається |
горить погано, поширюючи запах паленого волосся або рогу |
Розчиняєть ся під час кип’ятіння |
Руй- нується |
Поміт- них змін невідбув ається |
набухає |
|
Нату- ральний шовк |
волокна однакові за товщиною, гладенькі |
Не плавиться |
горить, поширює запах паленого волосся або рогу |
помітних змін не відбуваєтьс я |
втрачає міцність |
помітни х змін не відбуває ться |
втрачає міність |
|
Віскоза |
однакові за товщиною, гладенькі волокна із скловидним блискм або матові |
не плавиться |
горить яскравим полум’ям, поширюючи запах паленого паперу |
при кімнтній температур і змін не відбуваєть- ся |
сильно набухає і втрачає міцність |
Руй- нується |
Руй- нується |
|
Ацетат- не волокно |
однакові за товщиною волокна, гладенькі, м’які, шовковисті |
плавиться, утворюючи маленьку блискучу світлу кульку |
горить, утворюючи маленьку липку кульку. Запах продуктів горіння кислий |
повільно руйнується |
Розчи- няється |
|
|
|
Капрон |
волокна однакові за товщиною, гладенькі, із скловидним блиском, сухі, пружні |
плавиться, утворюючи тверду, блискучу, темну кульку |
горить погано навіть у полум’ї, поширюючи неприємний запах |
не діє |
не діє |
не діє |
Розчи- няється протя- гом 5- 10 хв |
|
Найлон |
волокна однакові за товщиною, гладенькі, із скловидним блиском |
плавиться, скручую- чись |
горить голубуватим полум’ям, поширюючи характерний запах прілих горіхів |
не діє |
не діє |
не діє |
Розчи- няється |
|
Лавсан |
волокна |
плавиться, |
горить спалахами |
діє тільки |
розчиня |
Обвуг- |
Руйнуєт |
Пара 20
Тема пари: Зв’язки між класами органічних речовин. Загальні поняття про біологічно активні речовини (вітаміни, ферменти).
Мета пари:
навчальна: узагальнити і систематизувати знання учнів про органічні речовини, показати різноманітність класів органічних сполук, їх подібність, відмінність, генетичні зв’язки між ними; закріпити вміння складати формули органічних речовин, рівняння реакцій, що характеризують їх хімічні властивості, продовжувати формувати вміння встановлювати залежність властивостей речовини від її будови, розв’язувати розрахункові задачі за участю органічних сполук;
розвиваюча: розвивати вміння передбачувати, систематизувати, порівнювати;
виховна: розширити науковий світогляд учнів
Очікувані результати навчання
Знаннєвий компонент
студент пояснює причини багатоманітності органічних речовин;
наводить приклади гомологів та ізомерів; сполук із простими і кратними зв’язками; сполук з різними характеристичними (функціональними) групами.
Діяльнісний компонент
розрізняє органічні сполуки за належністю до відповідних гомологічних рядів;
складає рівняння реакцій, які характеризують генетичні зв’язки органічних сполук;
досліджує наявність органічних кислот у продуктах харчування за допомогою індикаторів;
установлює зв’язки між класами органічних сполук;
використовує знання про органічні сполуки для пояснення їх різноманітності;
дотримується правил безпечного поводження з органічними речовинами.
Ціннісний компонент
студент висловлює судження про можливості використання органічних сполук залежно від їхніх властивостей;
робить висновки про важливість знань про органічні сполуки.
Тип пари: урок формування вмінь та навичок
Форми роботи: фронтальна робота, самостійна робота учнів, робота в групах
Методи навчання: словесні (бесіда, дискусія), наочні (демонстрація), практичні (виконання вправ).
Обладнання: картки із завданнями.
Хід пари
- Організаційний етап
- Мотивація навчальної діяльності
Ми розглянули основні класи органічних речовин, проникли у таємниці сполук, які є основою всього живого.
Тому сьогодні у нас буде не просто урок, а урок-загадка, на якому вас чекають непрості випробування, пов’язані з органічними речовинами. Якщо ви були старанні, то зі всіма завданнями легко справитесь.
- Повідомлення теми уроку
- Узагальнення і систематизація знань, вмінь, навичок.
Робота в групах. Завдання 1. «Хто я?»
Назвіть наступні речовини, вкажіть класи органічних сполук, до яких вони належать:
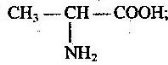
 1. 7.
1. 7.
8.
 2.
2.
 9.
9.
10.
3.
4.  11.
11. 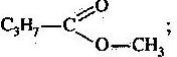
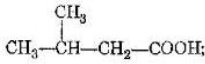
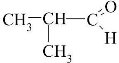 5. 12.
5. 12. 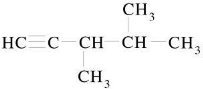
6.
Завдання 2. «Секретні реакції»
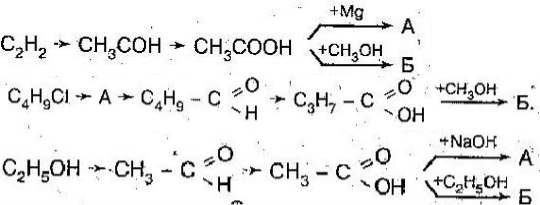 Здійсніть перетворення, визначте невідомі речовини:
Здійсніть перетворення, визначте невідомі речовини:
1.
2.
3.
![]() 4.
4.
Завдання 3. «Загадкова формула»
Наведіть приклади і назвіть речовини, загальні формули яких наступні:
1 група: речовини із загальною формулою А 2 група: речовини із загальною формулою Б 3 група: речовини із загальною формулою В 4 група: речовини із загальною формулою Г
Між речовинами яких груп можлива взаємодія? Складіть 2 рівняння реакцій.
Завдання 4. «Невідомі ізомери»
Складіть напівструктурні формули речовин, склад яких:С5H10
- С3H8O
- С4H8O2
- С3H7O2N
Завдання 5. «Задачі-загадки»
- Маса 1 л алкену – 1,25 г. Знайдіть його молекулярну формулу, складіть напівструктурну формулу та рівняння реакцій, характерні для нього. (С2Н4)
- Масові частки елементів у органічній речовині: Карбону 61,02%, Гідрогену – 15,25% і Нітроген. Густина її пари за вуглекислим газом 1,342. Визначте формулу речовини, складіть формули її ізомерів. (С3Н7NН2)
- Масові частки елементів у складі органічної речовини становлять: Карбон 40%, Гідроген – 6,67% і Оксиген. Відносна молекулярна маса її у 4,5 разів більша від маси Аргону. Вона не відновлює срібло при нагрівання з арґентум (І) оксидом, але забарвлює купрум (ІІ) гідроксид у яскраво-синій колір, як багатоатомні спирти. Яка молекулярна і напівструктурна формула речовини? (С6Н12О6 - фруктоза)
6. Домашнє завдання
Повторити основні класи органічних сполук.
Загальні поняття про біологічно активні речовини (вітаміни, ферменти).
Вивчення нового матеріалу
Є речовини, яких для організму потрібно дуже мало – тисячні частки грама, але без них нормальне функціонування неможливе. До цих речовин належать біологічно активні сполуки, а саме вітаміни та ферменти.
Вітаміни – низькомолекулярні органічні речовини, які в невеликих кількостях є необхідними для життєдіяльності людини.
Вітаміни бувають:
- Водорозчинні (С, РР, В1, В2)
- Жиророзчинні (А, Е, D, К)
З чим це пов’язано? Які особливості споживання цих вітамінів?
![]() Самостійна робота з підручником із заповненям таблиці (додаток 1)Ферменти. Властивості, механізм дії Ферменти — це біологічні каталізатори, здатні прискорювати хімічні реакції в клітині в десятки тисяч разів.
Самостійна робота з підручником із заповненям таблиці (додаток 1)Ферменти. Властивості, механізм дії Ферменти — це біологічні каталізатори, здатні прискорювати хімічні реакції в клітині в десятки тисяч разів.
Всі ферменти організму мають величезну масу - від 5000 до 1000000. Це пов'язано з наявністю білка в складі молекули. Для порівняння: молекулярна маса глюкози - 180, а вуглекислого газу - всього 44.
На сьогоднішній день відкрито більше ніж 2000 ферментів, які були виявлені в клітинах різних організмів. Однак більшість із цих речовин до кінця ще не вивчено
Основні властивості ферментів:
- усі ферменти — глобулярні білки; вони збільшують швидкість реакції, але самі в цій реакції не витрачаються;
- ферменти високо специфічні: один фермент може каталізувати тільки одну реакцію;
- фермент завжди більший за субстрат (або субстрати), з якими він взаємодіє;
- фермент взаємодіє з субстратом за допомогою активного центру — спеціальної ділянки, яка за формою відповідає субстратові;
- дуже мала кількість ферменту викликає перетворення великих кількостей субстрату;
- активність ферментів залежить від рН середовища, температури, тиску і від концентрацій як субстрату, так і самого ферменту;
- фермент-субстратний комплекс здатний знижувати енергію активації реакції (тобто робити меншою енергію початку реакції), саме це і дозволяє ферменту прискорити перебіг реакції.
Основні функції ферментів - це зниження активації енергії, тим самим підняття швидкості реакції. Деякі чинники, що впливають на активність ферментів:
- Концентрація ферменту
- Концентрація субстрату (із збільшенням концентрації ферментів чи субстратів швидкість реакції зростає).
- pH-середовище (пепсин в шлунку pH 1,5-2,2)..
- Температура. (оптимальна температура для реакції ферментів приблизно 37°C).
- Інгібітори, активатори.
Активність ферментів використовується для отримання ефективних пральних порошків. Рекомендується використовувати подібний пральний порошок при температурі не вище 50 градусів, інакше може піти процес денатурації.
- Закріплення вивченого матеріалу
 Проблемне питання
Проблемне питання
- Як ви гадаєте, для яких вітамінів можливий гіпервітаміноз: водо- чи жиророзчинних?
- Чому температура тіла 42°С є смертельною для людини, а для інших організмів (курей, наприклад) є нормальною?
- Чому при зниженій кислотності шлунку їжа починає повільніше перетравлюватися?
Задача.
- Виведіть формулу аскорбінової кислоти, якщо відомо, що її відносна молекулярна маса у 5,5 разів перевищує відносну молекулярна масу кисню, а масові частки елементів у ній становлять: Карбону – 40,9%, Гідрогену – 4,54%, а решта – Оксиген (С6Н8О6)
- Яка молекулярна формула вітаміну А, якщо відомо, що його відносна молекулярна маса у 71,5 разів перевищує масу Гелію, масова частка Карбону у сполуці – 83,9%, Гідрогену – 10,5%, решту становить Оксиген?
(С20Н30О)
6. Домашнє завдання
Вивчити параграф, виконати вправи
Задача. До складу вітаміну В6 входить: Карбон – 56,8%, Гідроген – 6,5 %, Нітроген – 8,3 % та Оксиген. Відносну густина пари його за воднем – 84,5. Визначте формулу вітаміну
(C8H11NO3).
Література
- Програма з хімії для 10–11 класів закладів загальної середньої освіти. Рівень стандарту (затверджена наказом МОН України від 23.10.2017 № 1407).
- Величко Л.П. Хімія (рівень стандарту): підручник для закладів загальної середньої освіти. 10 клас. 2018 (електронний варіант)
- Лашевська Г.А. Хімія (рівень стандарту): підручник для закладів загальної середньої освіти. 10 клас. 2018 (електронний варіант)
- Лашевська Г.А. Хімія: 9 кл.: підручник для загальноосв. навч. Закл. –К.: Генеза, 2009.-280с:іл.
- Попель П.П. Хімія (рівень стандарту): підручник для закладів загальної середньої освіти. 10 клас. 2018 (електронний варіант)
- 4. Попель П.П. Хімія:підручник для 11 класу загальноосвіт навч. Закладів (11 рівень)/ П.П.Попель, Л.С.Крикля.-К.:ВЦ «Академія»,2011.-352 с.
- Савчин М.М. Хімія (рівень стандарту): підручник для закладів загальної середньої освіти. 10 клас. 2018 (електронний варіант)
- Тарас Н.І. Хімія. Дидактичні матеріали.11 клас. Академічний рівень / Н.І.Тарас, Л.О.Мартинюк.-Тернопіль: Мандрівець, 2016.-112 с.
- Ярошенко О.Г. Хімія (рівень стандарту): підручник для закладів загальної середньої освіти. 10 клас. 2018 (електронний варіант)
![]()

про публікацію авторської розробки
Додати розробку