Конспекти уроків з хімії 11 клас рівень стандарту
Уроки хімії, 11 клас. Рівень стандарту
Допоміжний матеріал, 2012. - 170с.
Посібник містить розробки всіх уроків хімії для 11 класу (рівень стандарту). Наведені матеріали за змістом і структурою повністю відповідають чинній програмі курсу хімії. Посібник містить орієнтовне календарно-тематичне планування, критерії оцінювання навчальних досягнень, конспекти уроків. Наведено зразки самостійних та контрольних робіт.
Посібник призначений для вчителів хімії.
Відділ освіти Старокостянтинівської райдержадміністрації
 Хмельницької області
Хмельницької області


2012
Укладачі С.С. Поліщук, Т.О.Шостак, О.В. Осика, Ю.М. Мельник, В.В. Чернега, Н.О. Тащук, Л.А.Ярощук– творча група вчителів хімії Старокостянтинівського району Хмельницької області
Рецензент: Н.М. Нестечук – методист РМК відділу освіти Старокостянтинівської райдержадміністрації Хмельницької області
Друкується згідно рішення ради районного методичного кабінету відділу освіти Старокостянтинівської райдержадміністрації
( протокол від 20.01.2012 р. №01)
Уроки хімії, 11 клас. Рівень стандарту
Допоміжний матеріал, 2012. - 170с.
Посібник містить розробки всіх уроків хімії для 11 класу (рівень стандарту). Наведені матеріали за змістом і структурою повністю відповідають чинній програмі курсу хімії. Посібник містить орієнтовне календарно-тематичне планування, критерії оцінювання навчальних досягнень, конспекти уроків. Наведено зразки самостійних та контрольних робіт.
Посібник призначений для вчителів хімії.
ПОЯСНЮВАЛЬНА ЗАПИСКА
Вступ. Програма призначена для навчання хімії на рівні стандарту в класах суспільно-гуманітарного, філологічного, художньо-естетичного, технологічного, спортивного напрямів і у класах фізико-математичного і математичного профілів. Програмою передбачено вивчення хімії металічних і неметалічних елементів та їхніх сполук (10 клас) й органічних сполук (11 клас). Зміст програми грунтується на знаннях, набутих учнями в курсі основної школи.
Мета навчання хімії на рівні стандарту полягає у формуванні засобами навчального предмета ключових компетентностей учнів, необхідних для соціалізації, творчої самореалізації особистості, розуміння природничо-наукової картини світу, вироблення екологічного стилю мислення і поведінки та виховання громадянина демократичного суспільства.
Вивчення хімії спрямоване на виконання таких освітніх, розвивальних і виховних завдань:
- розвиток особистості учня, його природних задатків, інтелекту, пам'яті, здатності до самоосвіти;
- формування наукового світогляду учня на основі засвоєння системи знань про речовини та їхні перетворення, основні хімічні закони й теорії, методи наукового пізнання в хімії;
- формування життєвої і соціальної компетентностей учня, його екологічної культури, навичок безпечного поводження з речовинами у побуті та на виробництві;
- розкриття ролі хімії у розвитку суспільного господарства та забезпеченні добробуту людини.
Структура навчальної програми. Зміст програми складається з двох розділів, присвячених хімії елементів й органічній хімії.
У 10 класі знання з неорганічної хімії на якісно новому рівні розкриваються за рахунок вивчення хімії елементів та їхніх сполук. Паралельне структурування навчального матеріалу тем "Неметалічні елементи та їхні сполуки", "Металічні елементи та їхні сполуки" дасть змогу учням за час, відведений на вивчення цих тем, усвідомити та засвоїти знання у такій логічній послідовності; положення елемента в періодичній системі → будова атома → фізичні та хімічні властивості простої речовини → фізичні та хімічні властивості сполук (оксиду, гідрату оксиду, сполуки неметалічного елемента з Гідрогеном) → окремі найважливіші сполуки елемента (поширеність у природі, добування, використання).
Зміст курсу хімії 11 класу розроблено з урахуванням відомостей про органічні сполуки, одержаних учнями в основній школі. У ньому посилено дедуктивний підхід і практичне спрямування навчального матеріалу.
У програмі послідовно розкриваються основні змістові лінії хімічної компоненти Державного стандарту базової і повної загальної середньої освіти. Крім традиційних питань, що стосуються хімічних елементів, речовин і реакцій, належну увагу приділено висвітленню методів наукового пізнання в хімії, ролі теоретичних і експериментальних досліджень. Матеріал має чітко виражене екологічне спрямування. Екологічна складова у програмі представлена біосферними колообігами Оксигену, Нітрогену, вуглекислого газу, води та такими наслідками впливу діяльності людини на середовище, як парниковий ефект, кислотні дощі, використання органічних речовин у побуті тощо. Належну увагу приділено впливові хімічних чинників на здоров'я людини, поясненню згубної дії алкоголю, наркотичних речовин, тютюнопаління.
У структурі програми виокремлено такі структурні підрозділи як "Демонстрації", "Лабораторні досліди", "Практичні роботи", "Орієнтовні об'єкти екскурсій".
Кількість годин, відведених па вивчення хімії, відповідає чинним навчальним планам, затвердженим Міністерством освіти і науки України, а саме: 10 кл. - 1 год, 11 кл. - 1 год на тиждень.
Особливості організації навчання. Навчання хімії зорієнтовано на досягнення державних вимог до рівня загальноосвітньої підготовки учнів. Передбачено не лише засвоєння хімічних понять, законів, теорій, а й осмислене використання знань учнями, формулювання ними оцінних суджень, виявлення власного ставлення у різних життєвих ситуаціях.
Перелік вимог зорієнтує вчителя на досягнення мети навчання з кожної теми програми, полегшить планування цілей і завдань уроків, дасть змогу виробити адекватні методичні підходи до проведення навчальних занять, поточного й тематичного оцінювання.
Організації навчання хімії сприятиме використання перевірених шкільною практикою лекційно-семінарської системи, групової роботи, проблемного навчання, дидактичних ігор. Ефективності засвоєння знань сприятиме застосування сучасних інформаційних технологій навчання.
Рекомендації щодо роботи з навчальною програмою. Для тематичного оцінювання, а також для повторення, узагальнення, аналізу та коригування знань учнів передбачено резервні години. Розподіл годин у програмі орієнтовний. Учитель може аргументовано вносити зміни до розподілу годин, відведених програмою на вивчення окремих тем, змінювати послідовність вивчення питань у межах теми.
Критерії оцінювання навчальних досягнень учнів із хімії
При оцінюванні рівня навчальних досягнень з хімії враховується:
- рівень засвоєння теоретичних знань;
- оволодіння хімічною мовою як засобом відображення знань про речовини і хімічні явища;
- сформованість експериментальних умінь, необхідних для виконання хімічних дослідів, передбачених навчальною програмою;
- здатність учнів застосовувати набуті знання на практиці;
- уміння розв'язувати розрахункові задачі.
За відмінностями між обсягом і глибиною досягнутих результатів, ступенем самостійності у виконанні завдань, здатністю використовувати знання у нових ситуаціях виокремлено рівні навчальних досягнень учнів, що оцінюються за 12-бальною шкалою.
Кожний наступний рівень вбирає в себе вимоги до попереднього, а також додає нові характеристики.
Визначальними в оцінюванні рівня навчальних досягнень учнів є особистісні результати пізнавальної діяльності, у яких відображаються загальнопредметні компетентності, набуті учнями в процесі навчання хімії.
Критерії оцінювання навчальних досягнень учнів
|
Рівні навчаль-них досяг- нень учнів |
Бали |
Критерії оцінювання навчальних досягнень учнів |
|
|
1 |
Учень (учениця) розпізнає деякі хімічні об'єкти (хімічні символи, формули, явища, посуд тощо) і називає їх (на побутовому рівні); знає правила безпеки під час проведення практичних робіт |
|
Почат- ковий І |
2 |
Учень (учениця) описує деякі хімічні об'єкти за певними ознаками; знає призначення лабораторного обладнання |
|
|
||
|
|
3 |
Учень (учениця) має фрагментарні уявлення з предмета вивчення і може відтворити окремі його частини; під керівництвом учителя виконує найпростіші хімічні досліди |
|
|
4 |
Учень (учениця) знає окремі факти, що стосуються хімічних сполук і явищ; складає прості прилади для проведення дослідів і виконує їх під керівництвом учителя; складає з допомогою вчителя скорочену умову задачі |
|
Серед- ній ІІ |
5 |
Учень (учениця) з допомогою вчителя відтворює окремі частини навчального матеріалу, дає визначення основних понять; самостійно виконує деякі хімічні досліди, описує хід їх виконання, дотримується порядку на робочому місці; самостійно складає і записує скорочену умову задачі |
|
|
6 |
Учень (учениця) відтворює навчальний матеріал з допомогою вчителя; описує окремі спостереження за перебігом хімічних дослідів; робить обчислення за готовою формулою |
|
Достат- ній ІІІ
|
7 |
Учень (учениця) самостійно відтворює значну частину навчального матеріалу; з допомогою вчителя порівнює хімічні об'єкти, описує спостереження за перебігом хімічних дослідів; наводить рівняння реакцій за умовою задачі |
|
8
|
Учень (учениця) самостійно відтворює фактичний і теоретичний навчальний матеріал, порівнює і класифікує хімічні об'єкти; самостійно виконує всі хімічні досліди згідно з інструкцією; робить обчислення за рівнянням реакції |
|
|
|
9 |
Учень (учениця) виявляє розуміння основоположних хімічних теорій і фактів, наводить приклади на підтвердження цього; робить окремі висновки з хімічних дослідів; з допомогою вчителя розв'язує задачі |
|
|
||
|
|
10 |
Учень (учениця) володіє навчальним матеріалом і застосовує знання у стандартних ситуаціях, уміє аналізувати, узагальнювати й систематизувати надану інформацію, робити висновки; робить висновки з практичної роботи; самостійно наводить і використовує необхідні формули для розв'язування задач |
|
Високий ІV
|
11 |
Учень (учениця) володіє засвоєними знаннями і використовує їх у нестандартних ситуаціях, установлює зв'язки між явищами: самостійно знаходить і використовує інформацію згідно з поставленим завданням; виконує хімічний експеримент, раціонально використовуючи обладнання і реактиви; самостійно розв'язує задачі, формулює відповіді |
|
|
12 |
Учень (учениця) має системні знання з предмета, аргументовано використовує їх, у тому числі у проблемних ситуаціях; аналізує додаткову інформацію; самостійно оцінює явища, пов'язані з речовинами та їх перетвореннями; робить обгрунтовані висновки з хімічного експерименту; розв'язує експериментальні задачі за власним планом; самостійно аналізує та розв'язує задачі раціональним способом |
Календарно - тематичне планування
11 клас (35 год, із них 5 год – резервні)
Рівень стандарту
|
№ уроку |
Дата |
Зміст уроку Демонстрації, лабораторні досліди |
Примітка |
|
Органічні сполуки |
|||
|
1 |
|
Теорія як вища форма наукових знань. Теорія хімічної будови органічних сполук О.М. Бутлерова. |
|
|
2 |
|
Явище ізомерії. |
|
|
3 |
|
Структурна ізомерія, номенклатура насичених вуглеводнів. Лабораторний дослід №1. Виготовлення моделей молекул парафінів. |
|
|
4 |
|
Багатоатомність органічних сполук, їх класифікація. |
|
|
5 |
|
Органічні речовини в живій природі. |
|
|
6 |
|
Рівні структурної організації органічних речовин. |
|
|
7 |
|
Контрольна робота. |
|
|
8 |
|
Природні джерела органічних речовин. |
|
|
9 |
|
Природний і супутній нафтові гази, їх склад, використання. |
|
|
10 |
|
Нафта. Склад, властивості нафти. |
|
|
11 |
|
Продукти перегонки нафти, їх застосування. Детонаційна стійкість бензину. Лабораторний дослід №2 «Оз- найомлення зі зразками нафтопродуктів». |
|
|
12 |
|
Кам’яне вугілля, продукти його переробки. Лабораторний дослід №3 «Ознайомлення зі зразками продуктів коксування вугілля та різних видів палива». |
|
|
13 |
|
Основні види палива та їх значення в енергетиці країни. |
|
|
14 |
|
Охорона навколишнього середовища від забруднень під час переробки вуглеводневої сировини та використанні продуктів її переробки. |
|
|
15 |
|
Контрольна робота за І семестр |
|
|
16 |
|
Синтез органічних сполук різних класів на основі вуглеводневої сировини |
|
|
17 |
|
Органічні речовини як основа сучасних матеріалів.Пластмаси. Лабораторний дослід № 4 «Ознайомлення зі зразками пластмас». |
|
|
18 |
|
Синтетичні каучуки, гума. Лабораторний дослід № 5 «Ознайомлення зі зразками каучуків». |
|
|
19 |
|
Штучні і синтетичні волокна. Лабораторний дослід № 6 «Ознайомлення зі зразками натуральних, штучних і синтетичних волокон». |
|
|
20 |
|
Органічні сполуки і здоров’я людини. |
|
|
21 |
|
Жири, білки як компоненти їжі, їх роль в організмі. |
|
|
22 |
|
Вуглеводи, вітаміни як компоненти їжі, їх роль в організмі. |
|
|
23 |
|
Харчові добавки, Е-числа. Лабораторний дослід № 7 «Ознайомлення зі змістом етикеток на харчових продуктах». |
|
|
24 |
|
Контрольна робота. |
|
|
25 |
|
Поняття про синтетичні лікарські засоби (на прикладі аспірину). |
|
|
26 |
|
Шкідливий вплив вживання алкоголю, наркотичних речовин, тютюнокуріння на організм людини. |
|
|
27 |
|
Органічні сполуки в побуті. |
|
|
28 |
|
Поняття про побутові хімікати. |
|
|
29 |
|
Загальні способи поводження з побутовими хімікатами. Лабораторний дослід №8. «Ознайомлення зі змістом інструкцій до товарів побутової хімії». |
|
|
30 |
|
Мило, його склад, мийна дія. Синтетичні мийні засоби. Лабораторний дослід №9. Порівняння властивостей мила і синтетичних мийних засобів. |
|
|
31 |
|
Органічні розчинники, їх застосування. |
|
|
32 |
|
Практична робота №1 «Видалення забруднень органічного походження з поверхні тканини». |
|
|
33 |
|
Попередження забруднення довкілля при використанні органічних речовин в побуті. |
|
|
34 |
|
Контрольна робота за ІІ семестр. |
|
|
35 |
|
Екскурсія «Газова промисловість, переробка газу, екологічні проблеми та альтернативи». |
|
Урок №1
Тема: Теорія як вища форма наукових знань. Теорія хімічної будови органічних сполук О.М. Бутлерова
Мета: Розширити і поглибити знання учнів про взаємозв’язок між будовою речовин та їх властивостями; ознайомити з основними положеннями теорії хімічної будови органічних сполук О.М. Бутлерова;розвивати вміння визначати наукове і практичне значення теорії хімічної будови;виховувати спостережливість, уважність
Обладнання і матеріали: Електронний підручник «Органічна хімія»
Базові поняття і терміни: Ізомерія, ізомери, валентність, ковалентні зв’язки, фізичні властивості речовин
Тип уроку: Комбінований
ХІД УРОКУ
І. Організаційний момент
ІІ. Актуалізація опорних знань
Бесіда
- Який ступінь окиснення виявляє Карбон в етані (С2Н6), в бутані (С4Н10), в бензені (С6Н6)? Відповідь поясніть.
- Що таке хімічна будова?
- Порівняйте властивості таких сполук Гідрогену, як: HCl, H2O, NH3. Чи однакові вони за властивостями? Чому?
- Що показує молекулярна формула речовини? Скільки формул відповідає кожній речовині?
ІІІ. Вивчення нового матеріалу
- Теорія як вища форма наукових знань. Передумови і створення теорії хімічної будови.
Робота з електронним підручником «Органічна хімія» § 2
- Теорія Бутлерова. Залежність властивостей речовин від їх будови.
Розповідь учителя
Основні положення теорії хімічної будови органічних речовин
О. Бутлерова полягають у такому.
1. Атоми в молекулах з'єднані між собою у певному порядку хімічними зв'язками відповідно до їх валентності; Карбон у всіх органічних сполуках чотиривалентний.
2. Властивості речовини визначаються не тільки її якісним складом, але і її будовою.
3. Атоми й групи атомів, що утворили молекулу, взаємно впливають один на одного, від чого залежить реакційна здатність молекули.
Зараз можна доповнити формулювання ще одним пунктом:
4. Будова молекули може бути визначена на підставі вивчення її хімічних властивостей.
Хімічна будова і вплив, який чинять атоми один на одного,— центральне поняття теорії О. М. Бутлерова, тому що хімічна будова обумовлює хімічні властивості сполук.
Важливим наслідком теорії хімічної будови є висновок про те, що кожна органічна сполука повинна мати одну хімічну формулу, яка відбиває її будову. Цей висновок теоретично обґрунтовує явище ізомерії — існування речовин з однаковим молекулярним складом, але різною будовою і різними властивостями.
Існування ізомерів вимагало використання не тільки молекулярних брутто-формул, але й структурних формул, які відбивають порядок зв'язку атомів у молекулі кожного ізомеру.
Значення теорії О. Бутлерова важко переоцінити. Вона лежить в основі розуміння хімічних процесів, властивостей речовин, конструювання речовин із заздалегідь визначеними властивостями.
ІV. Закріплення і узагальнення знань
Завдання
- Сформулюйте основні положення теорії О.М. Бутлерова.
- Наведіть приклади, що підтверджують цю теорію.
- Напишіть структурні формули речовини складу С4Н9Сl.
V. Домашнє завдання
§ 1 № 1,2,3,4 (початковий рівень); 5 (середній рівень); 6 (достатній та високий рівень) с. 9-10
VІ. Підсумок уроку
Урок № 2
Тема: Явище ізомерії
Мета: Пояснити учням явище ізомерії; ознайомити з міжнародною номенклатурою назв органічних сполук;розвивати вміння складати структурні формули за назвами речовин і давати назви речовинам у відповідності до їх структурних формул;
виховувати уважність
Обладнання й матеріали: Набори для виготовлення моделей органічних речовин, демонстраційний матеріал з формулами органічних сполук, моделі молекул метану, етану
Базові поняття і терміни: Ізомерія, ізомери, структурні формули, номенклатура UIPAK, замісники
Тип уроку Комбінований
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
Бесіда
- Назвіть основні положення теорії хімічної будови О.М. Бутлерова.
- Як слід розуміти послідовність сполучення атомів у молекулі?
- Назвіть приклади, які характеризують взаємний вплив атомів у молекулі.
- Яка формула дає більше інформації про молекулу органічної речовини – молекулярна чи структурна? Відповідь поясніть.
ІV. Вивчення нового матеріалу
- Явище ізомерії
Розповідь учителя
Префікс ізо- означає «однаковий». Ізомери мають однаковий склад, але різну будову.
Ізомерія – це явище, при якому речовини однакового складу мають різну просторову будову і, відповідно, властивості.
Розберемо це явище на прикладах. Перший представник алканів – метан (СН4). Структурна формула:
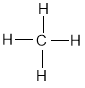
Виходячи з валентності Карбону і Гідрогену, атоми у цій молекулі не можуть бути розташовані по іншому, тобто ізомерів у метану немає.
Розглянемо етан:
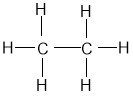
Як би ми не повертали молекулу, нового розташування атомів у молекулі не виходить. Просто повертаючи модель молекули у просторі, не можна домогтися різної будови.
Розглянемо пропан. Розглядається таке явище, як вигини ланцюга. Ординарні зв’язки забезпечують вільне обертання атомів Карбону один відносно одного:
СН3 – СН2 – СН3 СН3 – СН2
![]()
![]()
СН3
Згинаючи карбоновий ланцюг, нічого нового не одержимо (можна провести аналогію з намистом)
Розглянемо будову бутану.
Робота з електронним підручником «Органічна хімія» § 3
- Назви ізомерів
Щоб дати назву ізомеру треба:
- Виділити ланцюг з найбільшою кількістю атомів Карбону – головний ланцюг, порахувати в ньому кількість атомів Карбону; відповідна назва вуглеводню буде основою назви ізомеру;
- Визначити, до якого за рахунком атома Карбону прикріплений замісник. Це значення буде записане цифрою на початку назви;
- Визначити назву замісника за числом атома Карбону в ньому.
Наприклад:
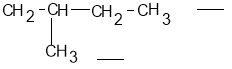 головний ланцюг
головний ланцюг
замісник
В головному ланцюгу чотири атоми Карбону, отже, кінець назви – бутан. До другого атома Карбону прикріплений замісник (в ньому один атом Карбону), таким чином, назва цієї сполуки –
2-метилбутан.
Нумерацію атомів Карбону потрібно починати з того кінця, до якого ближче розгалуження.
Головний ланцюг не обов’язково прямий, можливий вигин головного ланцюга.
Замісник не може бути прикріплений до кінця ланцюга, це буде тільки загин ланцюга.
- Складання структурних формул речовин за їхніми назвами
Розповідь учителя
Складемо структурну формулу речовини з назвою 2,3-диметилпентан. Закінчення назви – пентан, отже, в головному ланцюгу 5 атомів Карбону:
С – С – С – С – С
Частка ди вказує, що в молекулі є два замісники (в даному випадку це метил СН3) біля другого і третього атомів Карбону. Структурна формула:
СН3 – СН – СН – СН2 – СН3
׀ ׀
СН3 СН3
V. Закріплення і узагальнення знань
Бесіда
- Дайте визначення ізомерів.
- У чому полягає причина ізомерії?
Завдання
- Скласти формули речовин: 2,2-диметилбутан, 3,3,4-триметилгексан, 3-етил-2-метил-4-пропілгептан.
- Гра «Атракціон». Пропонується молекулярна формула речовини складу С7Н16. Переможе той, хто складе найбільшу кількість структурних формул цієї речовини та дасть їм назви за сучасною номенклатурою.
VІ. Домашнє завдання
§ 1(с. 5-6)
Завдання:
- Напишіть структурні формули 2,4,4-триметилгексану, 2,2-диметилпропану, 2,2,3-триметилпентану (початковий та середній рівень);
- Складіть структурні формули всіх ізомерів складу С6Н14. Назвіть ізомери.
VІІ. Підсумок уроку
Урок № 3
Тема: Структурна ізомерія, номенклатура насичених вуглеводнів. Лабораторний дослід №1. Виготовлення моделей молекул парафінів
Мета: Закріпити набуті учнями знання про явище ізомерії, гомології і назви гомологів метану; закріпити вміння складати їх молекулярні та структурні формули;
розвивати вміння зображувати структурні формули ізомерів парафінів та давати їм назви за сучасною номенклатурою;
виховувати самостійність під час виконання завдань
Обладнання та матеріали: Набори для виготовлення моделей молекул органічних речовин, моделі молекул метану, етану
Базові поняття і терміни: Ізомерія, ізомери, гомологи, структурні формули, замісники, сучасна номенклатура UIPAC
Тип уроку: Комбінований
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
Завдання
Оперативно (за 4-5 хв) дайте відповіді з колонки В на інформацію, що розміщена в колонці А (зліва)
А В
- Хімічна формула замісника матилу_______ А. чотири
- Молекула метану містить__________δ-звязків Б. СН2
- Хімічний склад етану можна виразити формулою_ В. ізобутан
- Гомологічна різниця – це група атомів__________ Г. СН3
- Ізомером бутану є________________ Д. С2Н6
- Шостий член гомологічного ряду алканів Е. С3Н7
має хімічну формулу______________ Є. С6Н14
ІV. Вивчення нового матеріалу
Розповідь учителя
З курсу хімії основної школи ви пам’ятаєте, що алкани утворюють гомологічний ряд, загальна формула якого СnH2n+2. В алканах атоми Карбону сполучені між собою тільки простими (Одинарними) зв’язками, а решта зв’язків з’єднує їх з атомами Гідрогену.
Робота з таблицею 2.1 § 2 (с.11). Гомологи метану.
Гомологи – речовини з однаковим якісним складом, подібні за будовою і хімічними властивостями, але відрізняються один від одного на певну кількість груп -СН2-. Цю групу називають гомологічною різницею.
Гомологи, розташовані за зростанням їхньої молекулярної маси, утворюють гомологічний ряд.
Побудова структурних формул ізомерів
Лабораторний дослід №1. Виготовлення моделей молекул парафінів. Інструктаж з БЖД
Пригадайте, у 9-му класі ви вже конструювали моделі молекул метану, етану, пропану…
Інструкція
Використовуючи набір для конструювання куле стрижневих моделей молекул, виготовте модель молекули бутану і його ізомеру. Порівняйте будову цих речовин. Дайте їм назви за сучасною номенклатурою.
Сконструюйте моделі молекул ізомерів складу С5Н12. Порівняйте будову цих речовин і назвіть їх за сучасною номенклатурою.
V. Закріплення і узагальнення знань
Бесіда
- Що таке структурна ізомерія?
- Назвіть мінімальну кількість атомів Карбону в ланцюзі насичених вуглеводнів, за якої стає можливим утворення ізомерів.
Завдання
- Укажіть, скільки сполук позначено цими формулами:
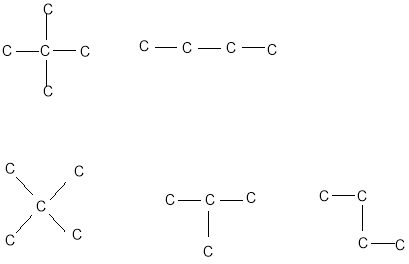
- Знайдіть молекулярну формулу і напишіть структурну формулу насиченого вуглеводню, відносна молекулярна маса якого дорівнює 58.
![]() Дано: Розв’язок
Дано: Розв’язок
CnH2n+2 =nAr(C) + 2nAr(H) +2
Mr(CnH2n+2) =58
![]() Mr( CnH2n+2) =12n+2n +2
Mr( CnH2n+2) =12n+2n +2
58=14n+2
Формула - ? 14n = 58-2
n= 4
Відповідь: формула вуглеводню С4Н10 – бутан
СН3 – СН2 – СН2 – СН3
VІ. Домашнє завдання
§ 2,3 № 1-3 (початковий і середній рівень), №4-5 (достатній рівень) с. 15 № 10 (високий рівень) с.20
VІІ. Підсумок уроку
Урок № 4
Тема: Багатоатомність органічних сполук, їх класифікація
Мета: Закріпити знання учнів про особливості будови атома Карбону, гомологію та ізомерію; ознайомити з поняттям характеристичні (функціональні) групи для пояснення
багатоатомності органічних речовин;розвивати вміння класифікувати органічні сполуки за будовою карбонового ланцюга, видами карбон-карбонових зв’язків, функціональними групами, наводити приклади органічних сполук різних класів; виховувати самостійність, уважність, спостережливість
Обладнання і матеріали: Набори для виготовлення моделей молекул органічних речовин, таблиця «Функціональні групи – ознаки належності органічних речовин до певного класу»
Базові поняття і терміни: Ізомерія, ізомери, гомологи, гомологічний ряд, характеристична (функціональна) група
Тип уроку:Урок вивчення нового матеріалу
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
Завдання
Напишіть структурні формули органічних речовин, назви яких можуть відповідати
1,2-диметилбутан;
2-бромо-5-метилгептан;
2,2,4,4-тетраметилгексан.
ІV. Вивчення нового матеріалу
- Багатоатомність органічних сполук
Багатоатомність органічних сполук зумовлена унікальними особливостями атомів Карбону. Наявність чотирьох електронів на зовнішньому енергетичному рівні причина того, що атом Карбону не схильний ані втрачати, ані приєднувати електрони. Тому Карбон утворює переважно ковалентні, а не йонні зв’язки.
(Робота з малюнком 4.1. Види електронних орбіталей. Будова атома Карбону в основному і збудженому стані §4с. 21)
- Класифікація органічних сполук
- За типом карбонового ланцюга і наявністю в ньому одинарних і кратних зв’язків;
Робота зі схемою
Класифікація органічних сполук за будовою карбонового ланцюга


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()







Робота з ілюстраціями органічних речовин різної будови (мал. 4.5., 4.6., 4.7.) § 4 с.24-25.
- За характеристичними (функціональними) групами;
Розглянемо ці критерії докладніше, скориставшись даними таблиці 4.1. Функціональні групи – ознаки належності органічних речовин до певного класу (§ 4 с.23).
Усі класи органічних сполук взаємопов’язані. Перехід від одних класів до інших відбувається переважно внаслідок перетворення функціональних груп без змін карбонового ланцюга.
V. Закріплення і узагальнення знань
Складання таблиці
«Характеристика основних класів органічних сполук»
|
Гомологічний ряд |
Загальна формула |
Особливості будови |
Особливості назви |
|
Алкани (насичені або парафіни) |
СnH2n+2 |
С-С зв’язки одинарні |
Суфікс –ан- |
|
Алкени (ненасичені ряди етилену) |
СnH2n |
С=С зв’язки подвійні |
Суфікс –ен- |
|
Алкіни (ненасичені ряди ацетилену) |
СnH2n-2 |
С≡С звязки потрійні |
Суфікс –ін- |
|
Арени (ароматичні вуглеводні) |
СnH2n-6 |
Ароматичне ядро
|
|
|
Насичені одноатомні спирти |
СnH2n+1ОН |
Характеристична група ОН |
Суфікс –ол- |
|
Насичені багатоатомні спирти |
СnH2n (ОН)2 СnH2n-1(ОН)3 |
Дві (три) характеристичні групи ОН |
Суфікси –ді-, -три-, –ол- |
|
Альдегіди |
СnH2n+1СОН |
Характеристична група СОН |
Суфікс –аль- |
|
Насичені одноосновні карбонові кислоти |
СnH2n+1СООН |
Характеристична група СООН |
Суфікс –ов-, закінчення -а |
|
Естери |
R1-СОО- R2 |
R1 – радикал кислоти, R2 – радикал спирту |
|
|
Вуглеводи |
Сn (H2O)m |
|
У моно- і дисахаридів суфікс –оз-, закінчення –а |
|
Амінокислоти |
|
Дві характеристичні групи: крбоксильна СООН й аміногрупа NH2 |
Префікс аміно-, суфікс –ов-, закінчення -а |
VІ. Домашнє завдання
§ 4 № 1-5 (початковий і середній рівень), №6-7 (достатній і високий рівень) с. 26-27.
VІІ. Підсумок уроку
Урок № 5
Тема: Органічні речовини в живій природі
Мета: Закріпити знання учнів про будову органічних речовин; ознайомити з різноманітністю органічних речовин, їх роллю в живій природі; розвивати вміння класифікувати органічні речовини за призначенням;виховувати бережливе ставлення до природних ресурсів
Обладнання і матеріали: Набори матеріалів, виготовлених з різних органічних речовин
Базові поняття і терміни: Ізомерія, ізомери, гомологи, гомологічний ряд, характеристична (функціональна) група
Тип уроку: Комбінований
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
Бесіда
З курсу біології, хімії 9 класу пригадайте органічні речовини, що є у живих істот, охарактеризуйте їх біологічне значення.
Кожна з відповідей ретельно аналізується. Учитель спрямовує обговорення так, щоб було охоплено, по можливості, найбільшу кількість органічних речовин і розглянуто їхнє значення.
ІV. Вивчення нового матеріалу
- Жива природа – невичерпне джерело органічних речовин
Розповідь учителя
Органічні речовини виникли прямо або непрямо з живої речовини або продуктів їх життєдіяльності; присутні в атмосфері, поверхневих і підземних водах, осадах, ґрунтах і гірських породах.
Природні органічні речовини знаходяться в твердому (вугілля, сланці, тверді бітуми), рідкому (нафта, рідкі бітуми) і газоподібному (пароподібному) стані (газ і газоконденсат).
До сьогодні людство використовує органічні речовини, вироблені живими організмами, аби задовольнити матеріальні потреби, передусім – у харчових продуктах, зручному одязі, комфортному житлі, теплі, дотриманні гігієни, збереженні здоров’я тощо.
Демонстрація
Учитель демонструє зразки, малюнки одягу, продуктів харчування, предметів гігієни, виготовлених з органічних речовин












- Хімія живого – один із стратегічних напрямків розвитку сучасної хімії
Розповідь учителя з елементами бесіди
Запитання до класу
-Як задовольнити потреби сучасного суспільства, не піддаючи небезпеці можливість майбутніх поколінь задовольняти свої потреби?
Кожна відповідь ретельно аналізується і робиться загальний висновок.
У промисловість органічного синтезу впроваджують нові технологічні процеси з використанням дешевих і доступних джерел сировини (наприклад, використання парафінових вуглеводнів для добування карбонових кислот), вводять економічно ефективні малостадійні хіміко-технологічні процеси, здійснюють перехід від періодичних процесів до безперервних. Велика увага надається впровадженню безвідхідних виробництв, що має важливе значення для охорони навколишнього середовища. Проводять пошуки нових, більш ефективних каталізаторів, для того, щоб збільшити вихід продуктів реакції.
V. Закріплення і узагальнення знань
Бесіда
- Назвіть продукти харчування, у складі яких містяться білки, жири, вуглеводи.
- Назвіть галузі використання целюлози.
- Назвіть галузі використання нафтопродуктів.
- Спробуйте назвати галузь промисловості, яка не використовує (чи не виробляє) органічних речовин?
VІ. Домашнє завдання
§ 5 № 1-6 (початковий і середній рівень) с. 31.
З інформаційних джерел підготувати повідомлення про паливо майбуття (достатній та високий рівень).
VІІ. Підсумок уроку
Урок № 6
Тема: Рівні структурної організації органічних речовин
Мета: Сформувати поняття про рівні структурної організації органічних речовин;розвивати вміння характеризувати значення рівнів організації органічних речовин у живій природі, класифікувати органічні сполуки за рівнями структурної організації;виховувати уважність, розсудливість
Обладнання і матеріали: Набори матеріалів, виготовлених з різних органічних речовин
Базові поняття і терміни: Хімічний склад, рівні організації, молекулярний рівень, клітинний рівень, полімерний рівень
Тип уроку: Комбінований
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
Бесіда
- Які рівні організації живого виділяють учені?
- Які основні властивості живого вам відомі?
ІV. Вивчення нового матеріалу
- Основні властивості живого
Рівні структурної організації органічних речовин тісно пов’язані з рівнями структурної організації форми руху матерії.
Заповнення таблиці разом з учнями
|
Властивості живого |
Характеристика властивості |
|
Певний хімічний склад |
Для всіх живих систем є характерним певне співвідношення за вмістом різних хімічних елементів, яке відрізняється від співвідношення за вмістом хімічних елементів у неживих системах, і наявність певних груп речовин, які називають органічними речовинами |
|
Багаторівневість організації |
Біологічні системи мають кілька рівнів організації, кожному з яких притаманні певні риси й особливості |
|
Наявність обміну речовин |
Усі живі системи можуть функціонувати лише за умови існування обміну речовин та енергії з навколишнім середовищем. Припинення обміну призводить до припинення життєдіяльності живої системи |
|
Здатність до саморегуляції |
Наявність обміну речовин вимагає від живих систем здійснення постійної регуляції своїх внутрішніх процесів та процесів взаємодії з навколишнім середовищем. Відсутність або порушення саморегуляції призводить до припинення процесів обміну |
- Рівні структурної організації органічних речовин
Робота з малюнком 6.1

- Молекулярний рівень організації руху матерії
Є продовженням атомного і водночас – попередником полімерного рівня, має певні особливості. Це ковалентний тип зв’язку між атомами в молекулах, сталий склад молекул і стала молекулярна маса. Важливою є наявність певної конфігурації, що характеризує особливості стійкого взаємного розташування атомів або груп атомів у просторі молекули.
- Полімерний рівень організації матерії
Розповідь учителя з елементами бесіди
Вчитель пропонує учням реакцією полімеризації утворити з етилену поліетилен (СН2=СН2 → (-СН2 – СН2-)n)
Так само, як і в низькомолекулярних органічних сполук, характерною ознакою полімерів є ковалентні зв’язки. Водночас особливого значення набувають міжмолекулярні зв’язки, зокрема – водневі. Саме завдяки їм підтримується вторинна структура білка і подвійна спіраль молекули ДНК.
Полімерний рівень організації хімічної форми руху є предтечею клітинного рівня біологічної форми руху.
V. Закріплення і узагальнення знань
Бесіда
- Який зв'язок між хімічною формою руху матерії з фізичною і біологічною?
Завдання
Порівняйте характерні ознаки молекулярного і полімерного рівнів структурної організації речовин. Відповідь оформіть як таблицю.
VІ. Домашнє завдання
§ 6 № 1-5 (початковий і середній рівень), №6-7 (достатній і високий рівень) с. 35.
Урок № 7
Тема: Контрольна робота
Мета: Визначити рівень навчальний досягнень учнів з теми,
розуміння основних понять, уміння використовувати їх на практиці.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, картки-завдання.
Тип уроку: Урок контролю знань
ХІД УРОКУ
І. Організаційний момент
ІІ. Письмова контрольна робота
І варіант
Завдання з вибором однієї правильної відповіді(0,5б)
- Вкажіть прізвище вченого, який розробив теорію хімічної будови органічних сполук:
А Д.І.Менделєєв; Б О.М. Бутлеров;
В М. Цвєт; Г М.М. Бекетов.
- Позначте групу атомів, що є гомологічною різницею:
А СН3 ; Б СН2;
В СН; Г СН4.
- Позначте правильне твердження щодо ізомерів:
А мають тотожні властивості;
Б мають різні молекулярні маси;
В відрізняються за будовою;
Г ізомери бувають лише одного виду.
- Яка рослина є головним промисловим джерелом крохмалю:
А ріпак; Б льон;
В картопля; Г виноград.
- Вкажіть ознаку, яка притаманна речовинам молекулярного рівня структурної організації:
А стала молекулярна маса;
Б йонний зв'язок;
В змінний склад;
Г сітчаста будова.
- Позначте вид ізомерії органічних сполук, що властива для алканів:
А термічна; Б структурна;
В геометрична; Г кольорова.
Завдання на встановлення відповідності(1б)
- Установіть відповідність між ізомерами:
1 СН3 – СН2 – СН – СН3 А 2-метилбутан;
׀
СН3 Б 2-метилпропан;
2 СН3 – СН2 – СН – СН2 - СН3 В 3-етилпропан;
׀
С2Н5 Г 2,2-диетилбутан;
Д 3-метилбутан.
3 СН3
׀
СН3 – СН2 – СН – СН3
׀
СН3
4 СН3 – СН – СН3
׀
СН3
Завдання на встановлення послідовності
- Установіть назви алканів у порядку збільшення їх температур кипіння:
А октан; Б декан;
В бутан; Г пентан.
- Розташуйте рівні структурної організації матерії за зростанням складності:
А полімерний; Б молекулярний;
В клітинний; Г атомний.
Завдання відкритої форми(2б)
- Напишіть структурні формули речовин, які мають такі назви
2,5-диметилпентан;
3-етил-2,4-диметилгексан;
3,4-діетил-2,6,6-триметилгептан;
2,2,3-триметилбутан.
- Складіть структурні формули ізомерів складу С7Н16. Назвіть
ізомери за сучасною номенклатурою.
- Знайдіть молекулярну формулу і напишіть структурну формулу насиченого вуглеводню, відносна молекулярна маса якого дорівнює 86.
ІІ варіант
Завдання з вибором однієї правильної відповіді(0,5б)
- Позначте назву алкану, що містить чотири атоми Карбону:
А пентан; Б метан;
В бутан; Г пропан.
- Укажіть число можливих структурних формул, що відповідають складу С3Н8:
А 1; Б 2;
В 3; Г 4.
- Вкажіть продукт, багатший на білки:
А сало; Б капуста;
В риба; Г кетчуп.
- Вкажіть, які рівні структурної організації притаманні органічним речовинам:
А атомний і молекулярний;
Б атомний і полімерний;
В молекулярний і полімерний;
Г полімерний і клітинний.
- Позначте загальну формулу насичених вуглевонів:
А CnH2n-2; Б CnH2n;
В CnH2n+2; Г CnH2n-6
- Вкажіть функціональну групу карбонових кислот:
А –ОН; Б -СОН;
В -СООН; Г -NH2.
Завдання на встановлення відповідності(1б)
- Установіть відповідність між ізомерами:
1 СН3 – СН – СН2 – СН3 А 2-метилбутан;
׀
СН3 Б 2,3-диметилбутан;
2 СН3 – СН2 – СН – СН2 - СН3 В 3-етилпропан;
׀
С2Н5 Г 2,2-диметилбутан;
Д 3-метилбутан.
3 СН3
׀
СН3 – СН2 – СН – СН3
׀
СН3
4 СН3 – СН – СН – СН3
׀ ׀
СН3 СН3
Завдання на встановлення послідовності
- Установіть назви алканів у порядку зменшення їх температур кипіння:
А октан; Б декан;
В бутан; Г пентан.
- Розташуйте рівні структурної організації матерії за зменшенням складності:
А полімерний; Б молекулярний;
В клітинний; Г атомний.
Завдання відкритої форми(2б)
- Напишіть структурні формули речовин, які мають такі назви
2,5-диметилгексан;
3-етил-2,4-диметилгептан;
3-етил-2,5,5-триметилгексан;
2,2,3-триметилпентан.
- Складіть структурні формули ізомерів складу С6Н14. Назвіть
ізомери за сучасною номенклатурою.
- Знайдіть молекулярну формулу і напишіть структурну формулу насиченого вуглеводню, відносна молекулярна маса якого дорівнює 100.
ІІІ. Домашнє завдання
Виконати варіант сусіда
ІV. Підсумок уроку
Урок № 8
Тема: Природні джерела органічних речовин.
Мета: Ознайомити учнів з природними джерелами органічних
речовин; розвивати логічне мислення, пізнавальний інтерес;
виховувати бережливе ставлення до природи.
Обладнання: зразки органічних речовин: нафта, торф, буре
вугілля, природний газ,кам’яне вугілля.
Тип уроку: Урок вивчення нового матеріалу.
Базові поняття: Вуглеводнева сировина,вичерпний ресурс,
корисні копалини, нафта, торф, буре вугілля, газ.
ХІД УРОКУ
І.Організаційний момент ІІ.Актуалізація опорних знань Бесіда 1.Наведіть приклади корисних копалин. 2.На які групи поділяються корисні копалини?
ІІІ.Мотивація навчальної діяльності
Учитель повідомляє тему уроку та його мету. Звертає увагу, на те, що на цьому уроці учні познайомляться з природними джерелами органічних речовин.
IV.Вивчення нового матеріалу
1.Природні джерела вуглеводнів.
Розповідь вчителя
Природні джерела органічних речовин відомі вам з уроків географії, природознавства. До них належать: нафта, торф, природний газ, буре вугілля, кам’яне вугілля:
НАФТА ПРИРОДНИЙ ГАЗ


БУРЕ ВУГІЛЛЯ КАМ’ЯНЕ ВУГІЛЛЯ


ТОРФ

Кам’яне вугілля, газ, нафта, торф – найважливіші природні джерела вуглеводневої сировини. Вуглеводнева сировина належить до вичерпних природних ресурсів. Ця обставина змушує розвідувати нові родовища і разом з тим експлуатувати вже відкриті таким чином, щоб максимально вилучати з них копалини і раціонально, з найбільшою користю використовувати їх. Існує два способи використання цих вуглеводнів: перший – у вигляді палива, як джерела енергії, другий – у вигляді сировини для подальшої переробки. Просте спалювання нафти, газу, вугілля економічно не вигідне. Крім цього, продукти спалювання природних вуглеводнів забруднюють атмосферу. Тому з кожним роком усе активніше йде пошук альтернативних джерел енергії. 2. Альтернативні джерела енергії -Які альтернативні джерела енергії вам відомі? (прогнозовані відповіді учнів)
-біопаливо;
-сонячна енергія;
-енергія морських припливів.
Існують різні погляди на походження горючих копалин.
1.Теорія органічного походження.
2.Теорія мінерального походження.
3.Космічна теорія.
V.Узагальнення та систематизація знань
Робота з таблицею
|
Природні джерела органічних речовин |
Застосування |
|
|
|
VI.Домашнє завдання
§ 7 (с.36 – 37), підготувати повідомлення «Найважливіші газові родовища України»
VII.Підсумок уроку
Урок № 9
Тема: Природний і супутній нафтові гази, їх склад, використання.
Мета: Ознайомити учнів зі складом природного та супутного
нафтового газу, порівняти їх склад, розглянути використання
цих газів в народному господарстві; розвивати логічне
мислення,пізнавальний інтерес; виховувати самостійність Обладнання: зразки продуктів, які одержують з природного газу
та супутного нафтового газу.
Тип уроку: Комбінований.
Базові поняття: Природний газ, супутній нафтовий газ.
ХІД УРОКУ
І.Організаційний момент ІІ.Перевірка домашнього завдання Бесіда 1.Назвіть найважливіші природні джерела вуглеводнів. 2.Які альтернативні джерела енергії вам відомі? ІІІ.Актуалізація опорних знань Бесіда 1.Як можна використовувати природні джерела вуглеводнів? 2.Опишіть склад природного газу. IV.Мотивація навчальної діяльності Учитель повідомляє тему та мету уроку. Звертає увагу, на те, що на цьому уроці діти познайомляться з продуктами переробки природного та супутного нафтового газів. V.Вивчення нового матеріалу 1.Природний газ Розповідь вчителя Природний газ – суміш, що утворилася в земних надрах унаслідок низки різноманітних хімічних реакцій. У природному газі містяться вуглеводні з невеликою відносною молекулярною масою. Він має такий приблизний склад ( за об’ємом ):
|
Метан |
98% |
|
Пропан, етан, бутан |
1,5% |
|
Азот,благородні гази,карбон(IV) оксид, водяна пара |
0,5% |
-Запишіть хімічні формули цих речовин.
Природний газ добувають із земних надр за допомоги свердловин.

На теренах України є родовища природного газу. Повідомлення учнів 2.Супутні нафтові гази Розповідь вчителя Супутний нафтовий газ розчинений у нафті і виділяється при її видобутку. Склад супутного нафтового газу відрізняється від складу природного газу меншим вмістом метану, підвищеним вмістом етану, пропану,вищих вуглеводнів. Крім того, у ньому присутні в основному ті самі домішки, що й в природному газі, а саме: азот, вуглекислий газ, благородні гази, водяна пара. 3.Застосування і переробка газу Робота з підручником § 7 с.38 – 40 Заповніть таблицю
|
Продукти переробки газів |
Застосування |
VI.Узагальнення та систематизація знань
Бесіда 1.Опишіть склад природного газу. 2.Назвіть продукти переробки газів. 3.Як переробляють природний та супутний нафтовий гази? VII.Домашнє завдання § 7 ( с.37 – 40), № 1- 5 (достатній рівень), № 8 (середній рівень), № 10 (високий рівень), підготуватися до « Круглого столу» VIII.Підсумок уроку
Урок № 10
Тема: Нафта. Склад, властивості нафти.
Мета: З’ясувати склад і особливості одного з природних джерел вуглеводнів – нафти, ознайомити учнів з основними процесами видобутку з нафти вуглеводнів, необхідних у народному господарстві; розвивати логічне мислення, пізнавальний інтерес; виховувати бережливе ставлення до природи.
Обладнання: зразки нафти, колба з водою.
Тип уроку: Ділова гра « Круглий стіл».
Базові поняття: Нафта, корисні копалини, оліїста рідина.
ХІД УРОКУ
І.Організаційний момент
ІІ.Перевірка домашнього завдання
ІІІ.Актуалізація опорних знань
Бесіда
1.Який склад нафти? 2.Опишіть фізичні властивості нафти. IV.Мотивація навчальної діяльності Учитель повідомляє тему та мету уроку. V.Вивчення нового матеріалу За круглим столом збираються учні: хімік, геолог, географ, еколог. Виступи учасників круглого столу
Хімік. Нафта – масляниста рідина темно-бурого або майже чорного кольору з характерним запахом. Капнемо крапельку нафти у воду. Ви бачите, нафта плаває на поверхні води, практично нерозчинна у ній.


За складом нафта – складна суміш вуглеводнів різної молекулярної маси, головним чином рідких. Звичайно ці вуглеводні парафінові, ароматичні, циклоалкани. Крім вуглеводнів нафта містить оксиген-, сульфур- і нітрогенвмісні сполуки.
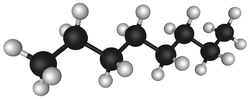
Октан – один з вуглеводнів нафти
Залежно від переважного вмісту вуглеводнів, того чи іншого класу в нафтовій фракції, розрізняють такі основні види нафти:
-метанова нафта;
-нафтенова нафта;
-змішана нафта.
Також нафту класифікують за фізичними властивостями:
-легка нафта (густина 0,9г/мл)
-важка нафта ( густина більша за 0,9г/мл)
Геолог.Питання про вихідну речовину, з якої утворилася нафта,про процеси нафтоутворення та формування нафти в концентровані поклади,а окремих покладів – у родовища дотепер ще не є остаточно з’ясованим. Існує ряд думок про походження нафти:
1.Органічна теорія
Згідно з цією теорією, нафта утворилася із залишків морських організмів і рослин, що осідали протягом мільйонів років на морське дно.
2.Неорганічна теорія
Автором цієї теорії є Д.І.Менделєєв, відповідно до цієї теорії, нафта могла утворитися з карбідів металів, що знаходилися в надрах Землі, і води, яка просочилася туди.
3.Космічна теорія
За цією теорією, нафта могла утворитися з водню і вуглецю при формуванні нашої планети.
Географ.Основні родовища зосереджені в Україні у Дніпрово –Донецькому, Прикарпатському, Кримському регіонах. Розвідка нафти в Дніпрово- Донецькому регіоні проводилась в 30-ті роки XX ст., а розробка після Другої світової війни. Найбільша глибина покладу нафтових горизонтів становить близько 5 тис. метрів. Це основний на сьогоднішній день район видобутку нафти в Україні. Важливими в цьому регіоні нафтовими копальнями є: Леляовське, Радгенківське, Каганевське. У Прикарпатському регіоні поклади нафти стали видобувати в примітивний спосіб ще в XIX ст., а промисловим- у другій половині XIX ст. Нафта й газ тут залягають на глибині не більше 150-3000 м. Найбільші родовища в цьому регіоні: Битковсько-Бабчинське, Домінське. Приморсько-Кримський регіон охоплює територію півострова та прилеглої до нього акваторії Чорного моря. У цьому районі залягає 3% нафти від загальної кількості в Україні.
Еколог.Життя людини пов’язане з горінням пальних об’єктів у побуті й промисловості. І, як ми знаємо, все це приводить до забруднення навколишнього середовища. Збільшення кількості вуглекислого газу за рахунок згоряння пальних речовин може призвести й вже призводить до підвищення температури на Землі та в зв’язку з цим – до зміни клімату. Під час горіння зменшується кількість кисню в атмосфері. За підрахунками вчених, якщо так продовжуватиметься, то через 150 років рівень кисню знизиться до критичного. Ми пропонуємо:
- ощадливо використовувати енергію;
- витягувати з пального сірку;
- використовувати альтернативні джерела енергії.
VI.Узагальнення та систематизація знань
Робота з таблицею «Нафта»
|
Що я знав (знала) з книжок, TV, інтернет- джерел |
Що дізнався (дізналася), на уроці |
Про що хочу дізнатися |
|
|
|
|
VII.Домашнє завдання
§ 8 ( с.42), № 8 (с.48), скласти кросворд « Нафта»
VIII.Підсумок уроку
Урок №11
Тема: Продукти перегонки нафти, їх застосування. Лабораторний дослід №2 «Ознайомлення зі зразками нафтопродуктів». Детонаційна стійкість бензину.
Мета: Розглянути основні наукові принципи й технологічні процеси переробки нафти, показати широку сферу використання нафтопродуктів; розвивати пізнавальний інтерес, логічне мислення; виховувати бережливе ставлення до природи.
Обладнання: колекція « Продукти переробки нафти» , довідник.
Тип уроку: Комбінований.
Базові поняття: Первинна перегонка нафти, крекінг, риформінг, фракції нафти, октанове число, детонаційна стійкість бензину.
ХІД УРОКУ
І.Організаційний момент
ІІ. Перевірка домашнього завдання Розв’язування кросвордів, які склали учні.
ІІІ. Актуалізація опорних знань Бесіда
1.Які види нафти вам відомі?
2.Назвіть основні теорії походження нафти.
3.Опишіть фізичні властивості нафти.
IV.Мотивація навчальної діяльності
Учитель повідомляє тему та мету уроку.
V.Вивчення нового матеріалу
Розповідь вчителя
Сира нафта звичайно не застосовується. Для одержання з нафти технічно цінних продуктів її піддають переробці. Існує два способи переробки нафти:
-первинна переробка, яка полягає в перегонці нафти;
-вторинна переробка: крекінг та риформінг.
Перегонку нафти здійснюють на нафтопереробних заводах.


У процесі перегонки нафти одержують світлі нафтопродукти: бензин, лігроїн, гас, солярове масло, а в залишку- чорну рідину- мазут.


ГАС БЕНЗИН


ЛІГРОЇН ДИЗЕЛЬНЕ ПАЛИВО

МАЗУТ ГУДРОН
Продукти перегонки нафти мають різне застосування.
Робота з таблицею § 8 с.42 - 44
|
Назва нафтопродукту |
Застосування |
|
|
|
При вторинних методах переробки нафти відбувається зміна структури вуглеводнів, що входять до її складу .Велике значення має крекінг вуглеводнів нафти, який проводять для підвищення виходу бензину.
Крекінг – це високотемпературна переробка нафтових фракцій з метою одержання більш низькомолекулярних продуктів. Існує два види крекінгу: термічний та каталітичний.
Також важливе значення має риформінг - каталітична переробка бензинових фракцій прямої перегонки нафти за допомогою водню з використанням каталізаторів. Застосовується головним чином для одержання високооктанового моторного пального. Так, з бензинової фракції нафти з октановим числом( ОЧ) 30 – 45 у результаті каталітичного риформінгу одержують бензин з ОЧ = 85 – 95.
Лабораторний дослід № 2
Тема: ознайомлення зі зразками нафтопродуктів.
Мета: ознайомитися зі зразками нафтопродуктів; порівняти їхні
властивості.
Обладнання та реактиви: колекція продуктів нафтопереробки,
довідник.
Хід роботи
І.Інструктаж з БЖД
ІІ.Виконання роботи.
1.Розгляньте колекцію продуктів нафтопереробки і випишіть їх назви:
Продукти прямої перегонки:-------------------------------------------------------
Продукти вторинної переробки:--------------------------------------------------
Продукти переробки мазуту:-------------------------------------------------------
2.Розгляньте видані вам зразки і визначте для кожного: агрегатний стан за кімнатної температури, колір, запах, температуру кипіння або її відсутність ( за довідником), розчинність у воді, температуру плавлення або її відсутність (за довідником).
Результати запишіть у таблицю.
|
Ознаки порівняння |
Бензин |
Гас |
Мазут |
Вазелін |
|
Формули компонентів фракції |
|
|
|
|
|
Зовнішній вигляд |
|
|
|
|
|
Колір |
|
|
|
|
|
Запах |
|
|
|
|
|
Температура кипіння |
|
|
|
|
|
Розчинність у воді |
|
|
|
|
|
Галузі застосування |
|
|
|
|
ІІІ. Висновок------------------------------------------------------------------------------
Детонаційна стійкість бензину характеризує здатність вуглеводнів у його складі протистояти самозайманню за стискання. Це найважливіша кількісна характеристика палива, за якою визначають його сортність і застосування у двигунах різних конструкцій. Мірою детонаційної стійкості пального служить ОЧ; воно чисельно дорівнює вмісту (в об’ємних %) ізооктану (ОЧ= 100) в його еталонній суміші з н – гептаном (ОЧ=0), при якому ця суміш має однакові, антидетонаційні властивості з пальним, яке випробовують.
VI.Узагальнення та систематизація знань 1.Які продукти отримують при перегонці нафти?
2.Де здійснюють перегонку нафти?
VII.Домашнє завдання
§ 8 (с.42-47), № 1- 7(тести) с.47 -48 , розробити і підготуватися до захисту проекту
VIII.Підсумок уроку
Урок № 12
Тема: Кам’яне вугілля, продукти його переробки. Лабораторний дослід №3 «Ознайомлення зі зразками продуктів коксування вугілля та різних видів палива».
Мета: З’ ясувати роль кам’яного вугілля як джерела різних хімічних речовин, ознайомити з основними принципами процесу коксування кам’яного вугілля, показати різноманітність використання продуктів коксування; розвивати пізнавальний інтерес, логічне мислення; виховувати бережливе ставлення до природи.
Обладнання: різні види вугілля, зразки продуктів його переробки.
Тип уроку: Урок - проект
Базові поняття: Антрацит, кокс, буре вугілля, суха перегонка,
коксовий газ, кам’яновугільна смола.
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання Перевірка виконання письмового завдання ( вибірково )
ІІІ. Актуалізація опорних знань
Бесіда
1.Що ви знаєте про вугілля?
2.Опишіть фізичні властивості вугілля.
3.Назвіть родовища вугілля в Україні.
IV.Мотивація навчальної діяльності
Учитель повідомляє тему та мету уроку.
V.Вивчення нового матеріалу Захист проектів Виступ групи фізиків
Вугілля – тверда горюча корисна копалина органічного походження.
Згідно з біогенною гіпотезою походження вугілля, воно утворилося з відмерлих рослин в результаті життєдіяльності мікроорганізмів. Утворення вугілля з рослиних залишків відбувалося через кілька стадій:
Торф – Буре вугілля - Кам’яне вугілля – Антрацит
Основні види вугілля
АНТРАЦИТ КАМ’ЯНЕ ВУГІЛЛЯ


БУРЕ ВУГІЛЛЯ ТОРФ


Кам’яне вугілля – осадова гірська порода, продукт глибокого розкладання решток рослин – хвощів, плаунів, деревоподібних папоротей. За хімічним складом кам’яне вугілля є сумішшю високомолекулярних поліциклічних ароматичних сполук з високим вмістом Карбону.
Високомолекулярна структура вугілля
Вугілля широко використовують як паливо, воно служить також вихідною сировиною для одержання різних хімічних продуктів. Прогнозовані запитання членів інших груп:
- Як утворилося вугілля?
- Які види вугілля ви знаєте?
- Опишіть фізичні властивості кам’яного вугілля.
Виступ групи технологів
Основними методами переробки вугілля є суха перегонка і газифікація.
Суха перегонка вугілля полягає в його хімічному розкладі при нагріванні без доступу повітря. Розрізняють два варіанти сухої перегонки вугілля – напівкоксування і коксування.
Коксування кам’яного вугілля має велике промислове значення. Процес коксування здійснюється на коксохімічних заводах.

Основні продукти коксування кам’яного вугілля:
-коксовий газ;
-надсмольна вода;
-кам’яновугільна смола;
-кокс.
- Робота з таблицею
|
Основні продукти |
Застосування |
|
Коксовий газ |
|
|
Надсмольна вода |
|
|
Кам’яновугільна смола |
|
|
Кокс |
|
Газифікація – це перетворення органічної частини викопного вугілля на горючі гази при високотемпературній взаємодії його з окисником. При цьому вугілля повністю переходить у генераторний і водяний гази. Для газифікації використовують буре вугілля та кокс. Сам процес проводять у газогенераторах.
Прогнозовані запитання членів інших груп
1.Які методи переробки кам’яного вугілля ви знаєте?
2.Назвіть основні продукти коксування кам’яного вугілля
3.Де здійснюють процес коксування?
Практична частина проекту ( виконують всі групи)
Лабораторний дослід № 3
Тема: ознайомлення зі зразками продуктів коксування вугілля та
різних видів палива.
Мета: ознайомитися зі зразками продуктів коксування вугілля та
різних видів палива; порівняти їхні властивості.
Обладнання та реактиви: колекція продуктів коксування вугілля та різних видів палива.
Хід роботи
І.Інструктаж з БЖД
ІІ.Виконання роботи
1.Розгляньте колекцію продуктів коксування кам’яного вугілля і визначте для кожного: агрегатний стан, зовнішній вигляд, колір, запах, розчинність у воді.
Результати запишіть у таблицю
|
Кам’яне вугілля |
|||
|
Ознаки порівняння |
Коксовий газ |
Кокс |
Кам’яновугільна смола |
|
Формули компонентів |
|
|
|
|
Зовнішній вигляд |
|
|
|
|
Колір |
|
|
|
|
Запах |
|
|
|
|
Розчинність у воді |
|
|
|
|
Галузі застосування |
|
|
|
2.Розгляньте колекцію зразків палива і визначте для кожного: агрегатний стан, зовнішній вигляд, температуру займання та теплоту згоряння (за довідником).
Результати спостережень запишіть у таблицю.
|
Ознаки порівняння |
|||||
|
Назва палива |
Агрегат-ний стан |
Зовнішній вигляд |
Темпера-тура займання |
Теплота згоряння |
Шкідливі продукти згоряння |
|
Кам’яне вугілля |
|
|
|
|
|
|
Буре вугілля |
|
|
|
|
|
|
Торф |
|
|
|
|
|
|
Нафта |
|
|
|
|
|
|
Природний газ |
|
|
|
|
|
ІІІ.Висновок--------------------------------------------------------------------------------
VI.Узагальнення та систематизація знань
Бесіда
1.Розповісти теорію походження вугілля.
2.Які основні методи переробки вугілля ви знаєте?
VII.Домашнє завдання
§ 9 с.49-53; №8 с.57.
VIII.Підсумок уроку
Урок № 13
Тема: Основні види палива та їх значення в енергетиці країни.
Мета: Ознайомити з основними видами палива, їх значенням в
енергетиці країни, розглянути важливе значення біопалива
і альтернативних газів; розвивати логічне мислення;
виховувати бережливе ставлення до природи.
Обладнання: зразки видів палива.
Тип уроку: Урок вивчення нового матеріалу.
Базові поняття: Паливо, біопаливо.
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
ІІІ. Актуалізація опорних знань
Самостійна робота
І – варіант
1.Розповісти теорію походження вугілля.
2.Які основні методи переробки вугілля ви знаєте?
ІІ - варіант
1.Які продукти утворюються при сухій перегонці вугілля? Де вони використовуються?
2.Опишіть фізичні властивості кам’яного вугілля.
IV.Мотивація навчальної діяльності.
Учитель повідомляє тему та мету уроку.
V.Вивчення нового матеріалу.
1.Паливо та його види
Розповідь вчителя з елементами бесіди
Паливо – природні або синтетичні речовини, спалювання яких супроводжується виділенням великої кількості теплової енергіїї.
-Які види палива ви знаєте?
(прогнозовані відповіді учнів):
-нафта;
-природний газ;
-торф.
Отже, всі існуючі види палива поділяються на тверді, рідкі, газоподібні.
Тверде паливо:
-природне- дрова,торф, вугілля;
-штучне- кокс, деревне вугілля.
Рідке паливо:
-природне- нафта;
-штучне- бензин, гас, мазут.
Газоподібне паливо:
-природне- природний газ;
-штучне- генераторний газ.
Кожний вид палива при згорянні виділяє неоднакову кількість тепла.
-Робота з таблицею § 9 с. 54
|
Паливо
|
Кількість теплоти,що виділяється внаслідок повного згоряння палива масою 1 кг |
|
|
|
-Як ви гадаєте, при згорянні якого палива виділяється найбільше тепла?
(прогнозовані відповіді учнів):
-при згорянні нафти;
-при згорянні антрациту;
-при згорянні коксу.
2.Значення паливних ресурсів в енергетиці України.
Розповідь вчителя
Значення паливних ресурсів в енергетиці нашої країни важко переоцінити. Незважаючи на наявність покладів нафти, газу, вугілля, Україна - енергодефіцитна країна, тому що, задовільняє свої потреби на половину. Пріоритетним для України є використання біопалива та альтернативних газів.
Біопаливо – паливо з біологічної сировини.
Робота зі схемою §9 с. 55
Україна вирощує ріпак на експорт у ЄС, тому що в нас відсутні умови на виробництво. Використання альтернативних газів- один з шляхів розв’язання енергетичної проблеми.
VI.Узагальнення та систематизація знань
1.Які види палива ви знаєте?
2.Наведіть приклади твердого палива.
VII.Домашнє завдання
§9 с.53-57; підготувати повідомлення «Біопаливо і його значення в енергетиці України».
VIII.Підсумок уроку
Урок №14
Тема: Охорона навколишнього середовища від забруднень під
час переробки вуглеводневої сировини та використанні
продуктів її переробки
Мета: Ознайомити учнів із проблемами забруднення
навколишнього середовища продуктами переробки нафти,
вугілля, природного газу; поглибити знання про парниковий
ефект; розвивати уявлення про альтернативні джерела енергії
та можливості використання вторинної сировини;
виховувати розуміння відповідальності за наслідки
діяльності.
Обладнання та реактиви: схема використання паливних ресурсів.
слайди та малюнки виробництв альтернативних джерел
енергії, карта корисних копалин України.
Тип уроку: засвоєння знань умінь і навичок.
Базові поняття: парниковий ефект, екологічно чисте паливо,
комплексне використання сланцевий газ, альтернативні
джерела енергії.
ХІД УРОКУ
І. Організаційний етап
Привітання, налаштування учнів на робочий лад.
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
- Аналіз помилок при виконанні лабораторного досліду № 3.
- Робота біля дошки.
а) два учні , незалежно один від одного заповнюють таблицю «Кам’яне вугілля». На виконання відводиться 5 - 10 хвилин. Після заповнення проводиться аналіз з участю класу.
|
Категорія для характеристики |
Характеристика |
|
З чого і коли утворене |
Кам’яновугільний період, деревовидні папороті, хвощі, плауни. |
|
Склад
|
Суміш високомолекулярних полі циклічних ароматичних сполук з високим умістом Карбону |
|
Світові запаси у порівнянні з запасами нафти і газу |
Істотно вищі |
|
Способи переробки
|
Піроліз, коксування |
|
Розміщення родовищ в Україні |
Робота з картою. |
|
Піроліз |
Термічне розкладання без доступу повітря органічних сполук. |
|
Коксування |
Високотемпературний (за 1000 – 1 1000С) піроліз кам’яного вугілля. |
б) виконання завдань для самоконтролю на с. 57 підручника та додаткове завдання від учнів класу по §9. Хімія 11клас, рівень стандарту Г.А. Лашевська, А.А Лашевська
3. Усне опитування проводиться одночасно з виконанням завдань біля дошки.
а)Коротка характеристика процесу коксування (підготовчий етап,тривалість коксування, коксовий пиріг,застосування, продукти коксохімії, безперервне коксування).
4. Робота з підручником (на місцях) с. 55 - 56 Хімія 11 клас рівень стандарту Г.А. Лашевська, А.А Лашевська.
Кілька учнів поодинці чи в парах складають схему «Альтернативні джерела енергії»
ІІІ. Мотивація навчальної діяльності
Учитель повідомляє тему уроку та його мету, зазначає, що на цьому уроці учні отримають повну відповідь на питання,що до екологічної безпеки з приводу переробки і використання вуглеводневої сировини; використання альтернативних джерел енергії.
ІV. Вивчення нового матеріалу
- Постановка проблемного питання вчителем.
- Які шкідливі речовини утворюються під час переробки вуглеводневої сировини і використання продуктів, одержаних з неї?
- Чим вони небезпечні для довкілля?
- Як можна звести до мінімуму їхню негативну дію?
- Що можемо зробити для цього ми?
- Розповідь учителя
Забруднення – це зміна якості навколишнього середовища, що призводить до негативних наслідків.
Розрізняють природні й антропогенні забруднення. Природне виникає в результаті природних причин – виверження вулканів, землетрусів, пожеж. Антропогенне забруднення – прямий чи опосередкований результат людської діяльності.
Стрімко зростає чисельність населення на Землі, 7 мільярдів зареєстровано на кінець 2011року. Існують життєві потреби людей та можливі шляхи їх забезпечення. Завдяки економічному розвитку країн стало можливим забезпечити потреби великої кількість населення. Економічний розвиток суспільства тісно пов'язаний з споживанням великої кількості енергії. Основні джерела енергії – вугілля, нафта, природній і супутні нафтові гази. Все це вичерпні джерела енергії, зменшення їх кількості вимагає економного та ефективного їх використання. Зношене і застаріле обладнання та енергоємні процеси переробки вимагають нових економічних затрат. У цей же час необхідність захисту навколишнього середовища змушує докладати зусиль, спрямованих на удосконалення технологій використання природної сировини, а також на створення нових джерел енергії.
- Робота з підручником.
Заповнення таблиці з обговоренням матеріалу
Вуглеводнева сировина
|
Категорія |
Характеристика |
|
Природній газ |
|
|
Екологічна безпека |
Екологічно чисте паливо |
|
Склад |
Метан, незначна кількість його гомологів: етан, пропан, бутан; домішки водяної пари, сірководню Н2S, азоту N2, водню Н2, гелію Не, Карбон (ІV)оксид. |
|
Вплив водяної пари |
Водяна пара в складі природного газу за певних умов може: конденсуватися, утворювати гідрати (сірководень) – спричинює корозію металу. (Спричинює корозію металевого газового обладнання. У наслідок корозії можливі прориви газопроводів, що часто супроводжується вибухами, руйнуваннями і людськими жертвами; додатковими фінансовими витратами.) |
|
Способи очищення від домішок |
Розчин натрій гідроксиду, карбонати лужних металів. (H2S +NaOH = NaHS + H2O, H2S + 2NaOH = Na2S + 2H2O, CO2 + 2NaOH = Na2CO3 + H2O, Na2CO3 + H2S = NaHS + NaHCO3 Хімічні відходи цього процесу – натрій сульфід і натрій гідроген сульфід – сировина для хімічної , текстильної промисловості… Натрій гідроген карбонат ( питна сода) використовується у харчовій, легкій, медичній, фармацевтичній промисловості, кольоровій металургії.) Мембранні і плазмохімічні технології. |
|
Продукт повного окиснення |
Вуглекислий газ, водяна пара. |
|
Наслідки спалювання неочищеного газу |
Посилення парникового ефекту, виникнення кислотних дощів. |
|
Супутні нафтові гази |
|
|
Використання |
Уловлювання і переробка як органічної сировини. |
|
Наслідки спалювання неочищеного газу |
Забруднення атмосфери. ( Спалювання у факелах призводить до значних викидів забруднюючих речовин і погіршення екологічної ситуації у промислових районах. В атмосферу потрапляють недопалений метан, вуглекислий і чадний гази, сажа, оксиди Нітрогену і Сульфуру, відбувається хімічне і теплове забруднення) |
|
Сланцевий газ |
|
|
Проблеми при добуванні |
Можливе забруднення артезіанської води. (Видобування пов’язане з використанням канцерогенних речовину складі рідин для розриву пластів.) |
|
Нафта і нафтопродукти |
|
|
Види забруднення |
Смог. (Аерозоль з диму, туману й пилу, один з видів забруднення повітря) |
|
Шляхи уникнення смогу |
Каталітичний нейтралізатор. (При роботі автомобілів у цьому пристрої шкідливі складові вихлопу – чадний газ, оксид Нітрогену, недопалені вуглеводні – перетворюються на вуглекислий газ, азот і воду. Зменшується забруднення канцерогенними і мутагенними полі конденсованими ароматичними вуглеводнями, передусім бензпіреном.) |
|
Потрапляння у воду |
Утворює плівку. (Нафта вкриває тонкою плівкою значні частини акваторії за порівняно невеликих розливів.) |
|
Наслідки утворення плівки |
Загибель тварин. (Нафта не змішується з водою, оскільки вона легша, довгий час тримається на поверхні. Хутро морських ссавців злипається, нафта проникає в організм і спричинює захворювання. При очищенні хутра нафта поглинається тваринами і призводить до отруєння. У рибоїдних і водоплавних птахів піря просочується і склеюється. Тварини гинуть від переохолодження і неможливості літати та отруєння.) Погіршення освітлення води. (Нафтова плівка знижує освітленість товщі води. Процеси фотосинтезу втрачають інтенсивність, зменшується концентрація кисню.) |
|
Шляхи подолання наслідків катастроф |
Використання сорбентів. (За допомогою сорбентів збирають і видаляють нафту з поверхні води і ґрунту…) |
|
Кам’яне вугілля |
|
|
Наслідки спалювання |
Викид парникових газів. ( Науковцями встановлено, що при спалюванні вугілля у атмосферу потрапляє значно більше парникових газів, ніж на газовій станції. |
|
Склад продуктів згорання |
Вугільний пил, сажа, чадний газ, отруйні сполуки Нітрогену, Сульфуру, Меркурію, Кадмію, Берилію, Плюмбуму, Арсену, Селену, парникові гази. (В результаті фізико – хімічних процесів токсичні сполуки включаються у коло обіг речовин. Потрапляють у ґрунт, підземні, поверхневі й ґрунтові води, живі організми. |
|
Уникнення екологічного ризику |
Запровадження нових технологій при спалювання. Переробка породних відвалів при видобутку вугілля. ( Після збагачення вугілля у відходах міститься велика кількість хімічних елементів періодичної системи Д.І. Менделєєва. Сировина для виробництва алюмінію, у відходах міститься Германій, видобуток їх є економічно привабливим. Вивільнення земельних площ. При переробці відвалів, відходів після використання вивільняються земельні площі, що можуть використовуватись за прямим призначенням.) |
- Мозковий штурм «Що робити?» Завершуючи попереднє вивчення і обговорення матеріалу, учителем ставиться питання: «Яким чином особисто ви можете запобігти негативному впливу на довкілля, зумовленому використанням вуглеводневого палива і продуктів переробки вуглеводневої сировини?»
Застосування енергозберігаючих технологій.
- утеплення вікон, утеплення стін пінопластом, пластикові вікна, вікна обтягнуті плівкою;
- сортування сміття, здача в пункти збору вторинної сировини: скло, металолом, папір;
- Предмети ужитку багаторазового використання: стаканчики, тарілки, сумки;
- Ходити пішки чи їздити на велосипеді, гужовий транспорт замість автотранспорту…
Після висловлення всіх пропозицій і обговорення підводиться підсумок. Необхідно використовувати всі можливі шляхи для запобігання негативного впливу на довкілля.
V. Узагальнення та систематизація знань
1. «Граємо у футбол – забиваємо гол»
Кожна група (2 учні) готує питання за вивченим матеріалом для інших груп. На одговорення відповіді відводиться 10сек. Відповідає учень, котрого вибере той, хто поставив питання.
- Назвіть найважливіші природні джерела вуглеводнів.
- Запропонуйте можливі способи встановити наявність в продуктах горіння: води, вуглекислого газу.
- Які позитивні і негативні наслідки виробництва енергії?
- У чому причина кислотних дощів? Що треба зробити, щоб кислотних дощів не було?
- Назвіть наслідки парникового ефекту які спостерігаються в наш час.
- Запропонуйте можливі шляхи подолання явища парникового ефекту.
2. Повідомлення учнів:
- енергозберігаючі технології;
- альтернативні джерела енергії.
VI. Домашнє завдання
§ 10 , завдання для самоконтролю.
Додатковий матеріал до уроку
Екологічно шкідливими і небезпечними для природи наслідками виробництва енергії є: парниковий ефект, кислотні дощі, термічні й хімічні забруднення навколишнього середовища та економічна нестабільність, як одна з причин нездорового психологічного стану людей.
Парниковий ефект
У світі постійно спалюють велику кількість вугілля. Продуктами його спалювання, крім корисної енергії є дим, сажа, карбон діоксин, оксиди Сульфуру і Нітрогену. На сучасних теплоелектростанціях, які працюють на вугіллі, видалення пилу й окалини з пічних газів здійснюється за допомогою спеціальних фільтрів – електроосаджувачів. Потім очищені гази піднімаються димарями і випускаються у верхні шари атмосфери, де збільшується їх концентрація. Це є однією з причин виникнення парникового ефекту.
Парниковий ефект спричинює затримку теплової енергії, яка випускається Землею в космічний простір. Частина сонячного випромінювання проходить крізь озоновий шар і досягає поверхні Землі. Ці промені представлені м’яким ультрафіолетовим та видимим світлом, а також інфрачервоними променями. Інфрачервоне теплове випромінювання потрапляючи на поверхню впливає на молекули, ніби розгойдує їх,саме цим, підсилює коливальні рухи атомів, це призводить до підвищення температури речовин. Нагріта земна поверхня теж стає джерелом довгохвильового інфрачервоного випромінювання. Таке випромінювання поглинають пари вод, вуглекислий газ, метан, та інші компоненти атмосфери, створюючи парниковий ефект. Без парникового ефекту Земля була б мертвою пустелею: усе її тепло, що випускається, ішло б у космос, температура біля її поверхні складала б – 150С, а не +180С як зараз. Природній енергетичний баланс порушують промислові викиди і їх стрімке збільшення. Концентрація СО2 в атмосфері може призвести до глобального потепління клімату і як наслідок танення льодовиків, підвищення рівня Світового океану.
Кислотні дощі
Шкода, якої завдають кислотні дощі:
1.Зниження врожайності основних сільськогосподарських культур (пшениці, жита, кукурудзи, рису). Причиною є загибель певної мікрофлори ґрунту , а як наслідок рослин і ґрунтових тварин. На таких ґрунтах добре себе почувають: кропива, щавель, хвощі.
2.Загибель лісів. Через кислотні дощі особливо страждають вічнозелені дерева, масові насадження хвойних, це пов’язано з особливістю опадання хвої у цих рослин. Дерева втрачають імунітет, отруюються, хворіють, у них знижується фотосинтез і вони гинуть.
3.Загибель закритих водойм (озер). Під дією кислотних дощів змінюється реакція водного середовища, підвищується кислотність.
Алюмосилікатні породи ґрунтів розчиняються в такому середовищі, вони є токсичними для великої кількості організмів. Гинуть водяні рослини і тварин.
4.Корозія і виведення з технологічних процесів металевих споруд та деталей веде до підвищення вартості виробництва чи додаткових фінансових витрат населення.
5. Руйнування вапняних, кам’яних будинків, металевих дахів і споруд.
Причиною кислотних дощів є викиди оксидів Сульфуру, Нітрогену, Карбону та інших сполук, що викликають підвищення кислотності опадів. Такі речовини утворюються в результаті:
- спалювання всіх видів викопного палива;
- роботи хімічних виробництв;
- роботи металургійних комбінатів;
- роботи двигунів внутрішнього згорання.
Використання нетрадиційних джерел енергії
Найважливішими видами альтернативних джерел енергії є: атомна енергетика, енергія вітру, припливу і відпливу, сонячна, геотермальна.
Способи прямого перетворення сонячної енергії
Сонячні панелі. Їх виготовляють з металів, оскільки вони є гарними провідниками тепла. Найчастіше з цією метою використовується мідь. На неї наносять покриття чорного кольору, щоб панель краще поглинала сонячне світло. Сонячні панелі звичайно прикріплюють на дахах будинків і використовують для обігріву житла.
Фотоелементи. Використання скляних панелей, що містять уран оксид і рідкоземельний елемент неодим, який підсилює поглинання світла фотоелементами.
Водень. Одержаний будь - яким способом водень можна перетворити на інший вид палива. Найпростішим способом одержання водню з води є електроліз. Фотоліз – перспективний напрямок, пряме використання сонячної енергії для одержання водню з води за допомогою її фотохімічного розкладу.
Біофотоліз. Ферменти одержані з живих організмів, використовуються при біохімічному підході для одержання водню з води. За допомогою цього методу отримують водень з води, хоча необхідно прискорити швидкість процесу. Можливо ефективне використання штучних хлоропластів і синтетичного хлорофілу для фотохімічного розкладання води.
Біомаса. Біомаса є важливою формою накопичення енергії, у вигляді живої рослинної та тваринної, та неживої мас. Наприклад, вуглеводи, жири й білки, що входять у їжу, забезпечують енергією людський організм. Людство вже давно використовує деревину як паливо. Біомасу можна також використовувати як джерело таких видів палива, як біогаз і спирт.
Біогаз – можна отримати при переробці любої органічної сировини, відходів сільського господарства, харчової промисловості… Біогаз - подібно до природного газу є переважно метан. На заводах з добування біогазу та індивідуальних установках відходи перегнивають у автоклавах. У цих установках гниття відбувається без доступу кисню, з утворенням метану. Газ збирають чи підводять безпосередньо до місця використання: газові плити, опалення житла чи котелень.
Спирт, можна одержувати з рослин, наприклад цукрова тростина, цукровий буряк, пивоварний ячмінь, крохмалевмісні рослини. Процес отримання досягається шляхом ферментації (зброджування) і перегонки.
Біопаливо виробляють з рослинних олій, на сучасному етапі – це вирощування ріпаку. Випробовуються олії, які видобувають із соєвих бобів, соняшнику, земляних горіхів (арахісу), евкаліпта, гарбуза, пальмової, і касторової олії.
Урок №15
Тема. Контрольна робота за І семестр
Мета: Узагальнити знання учнів за І семестр; визначити рівень
навчальних досягнень учнів;
розвивати вміння використовувати набуті знання на
практиці;
виховувати самостійність та логічне мислення учнів.
Обладнання: Періодична система хімічних елементів
Д. І. Менделєєва; картки з завданнями.
Тип уроку: Контроль знань умінь і навичок.
ХІД УРОКУ
І. Організаційний етап:
Перевірка готовності класу до уроку.
ІІ. Письмова контрольна робота за варіантами:
В – І
Завдання з вибором однієї правильної відповіді(0,5 бали)
1 . Оберіть вченого, що сформулював теорію хімічної будови
органічних сполук:
а) А. С. Купер; б) Й. Я. Берцеліус;
в) О. М. Бутлеров; г) А. І. Кіпріанов.
2 . Правильно подано закінчення визначення: «Речовини, які мають
однаковий якісний, кількісний склад і молекулярну масу, але
різну будову молекул, що спричинює різні властивості,
називають - …» у рядку:
а) ізомери; б) гомологи.
3. Оберіть найпростіший за будовою та найпоширеніший у природі
газ:
а) етан; б) карбон (ІV) оксид; в) метан.
4 . Оберіть структуру, що складає основу сполуки для ациклічних
сполук:
а) родоначальна структура; б) цикл; в) замісник.
5 . Укажіть найбільшого забруднювача середовища:
а) хімічна і нафтохімічна промисловість;
б) нафтохімічна промисловість;
в) чорна і кольорова металургія;
г) теплоелектростанції, транспорт і кольорова металургія.
6 . Визначте, що є нафта:
а) водний розчин органічних речовин;
б) суміш продуктів окиснення органічних речовин;
в) суміш високомолекулярних сполук;
г) суміш вуглеводнів.
Завдання відкритої форми ( 1,5 бали)
7 . Складіть формули речовин за їх назвами:
а) 2,3,4 – триметилпентан;
б) 3,3 – діетил – 2,5 – диметилоктан;
в) 2,2,3,4 – тетраметилгексан.
8 . Назвіть види ізомерії, зобразіть 4 ізомери гексану та дайте їм
назви.
Завдання відкритої форми ( 3 бали)
9 . Бак автомобіля заповнений бензином, масова частка гептанових
ізомерів в якому становить 80% і октанових – 20%. Який об’єм
кисню потрібний для спалювання бензину масою 30 кг (н.у.)?
10 . Охарактеризувати принцип фракційної перегонки нафти. Які
фракції отримуються та їх застосування.
B – II
Завдання з вибором однієї правильної відповіді (0,5 бали)
1 . Оберіть роки, коли було сформульовано основні положення
теорії хімічної будови органічних сполук:
а) 1858 – 1861рр. б) 1845 – 1846рр.
в) 1828р. г) 1876р.
2 . Правильно подано закінчення твердження: «Сполуки, подібні за
будовою і хімічними властивостями, склад яких різниться між
собою на групу СН2, називають - …» у рядку:
а) ізомери; б) гомологи.
3 . Укажіть, які хімічні зв’язки утворюються між атомом Карбону
та чотирма атомами Гідрогену:
а) подвійні; б) потрійні; в) одинарні.
4 . Вкажіть алкан, що за нормальних умов – рідина:
а) С3Н8; б) С4Н10; в) С7Н16.
5 . Визначте при переробці якої сировини виготовляють бензин:
а) кам’яного вугілля і водню;
б) нафти і водню;
в) нафти;
г) природного газу і кам’яного вугілля.
6. Визначте комплексне спрямування використання сировини:
а) застосування нових видів матеріалів;
б) створення нових технологій;
в) розробку методів рециркуляції;
г) застосування всіх її основних частин для добування корисних
продуктів або матеріалів.
Завдання відкритої форми ( 1,5 бали)
7 . Складіть формули речовин за їх назвами:
а) 3 – етил – 2 – метилпентан;
б) 4 – етил – 2,3,3 – триметилгексан;
в) 4 – етил – 2 – метил – 4 – пропілгептан.
8 . Назвіть види ізомерії, зобразіть 4 ізомери гептану та дайте їм
назви.
Завдання відкритої форми ( 3 бали)
9 . Щомісяця в усьому світі спалюється приблизно 1,25 ∙ 108т
вугілля, масова частка Карбону в якому становить 80%. Який
об’єм вуглекислого газу (н.у.) утвориться за 1 добу, якщо
тривалість місяця 30 діб?
10 . Охарактеризувати перспективи розвитку різних джерел енергії
на сучасному етапі.
ІІІ. Домашнє завдання
Виконати варіант сусіда.
Підготувати повідомлення про вуглеводневу сировину.
ІV. Підсумок уроку
Урок №16
Тема. Синтез органічних сполук різних класів на основі
вуглеводневої сировини
Мета: Ознайомити учнів з синтезом органічних сполук різних
класів на основі вуглеводневої сировини;
розвивати навички самостійної роботи з різними джерелами
інформації;
виховувати бережне ставлення до природи.
Обладнання та реактиви: колекції «Пластмаси», «Льон»,
«Штучні і синтетичні волокна», «Сучасні будівельні
матеріали».
Тип уроку: урок вивчення нового матеріалу.
Базові поняття: органічний синтез
ХІД УРОКУ
І. Організаційний момент
Налаштування емоційного стану учнів та готовності їх до роботи.
Оголошення теми уроку.
ІІ. Аналіз контрольної роботи
Робота з класом зі з’ясування типових помилок, індивідуальна робота над помилками.
ІІІ. Актуалізація опорних знань
Урок проводиться під девізом.
«…досягнення в галузі органічного
синтезу, напевно, більш ніж успіхи
в будь – якій іншій царині органічної
хімії дозволяють судити про стан
могутності цієї науки».
Р. Вудворд
Бесіда за запитаннями
- Як ви розумієте термін «органічний синтез»?
- Які речовини використовують для органічного синтезу?
- Яка причина великої різноманітності органічних речовин?
- Які речовини, що оточують нас, утворені в результаті органічного синтезу?
ІV. Мотивація навчальної діяльності
Учні на основі обговореного матеріалу формулюють мету уроку.Ставлять перед собою завдання по даній темі уроку, записують їх на листочках. В кінці уроку з’ясовуємо на скільки завдання виконано.
V. Вивчення нового матеріалу
1.Синтез – основа промислового виробництва органічних речовин.
Повідомлення учнів
Розповідь учителя
В результаті вивчення хімії 9 – 11 класів, ми дізналися, що органічна хімія – це хімія сполук вуглецю (Карбону). Вона вивчає будову, властивості і застосування органічних речовин. Органічні речовини відомі людям давно. Вони численні і мають ряд особливостей, які відрізняють їх між собою.
Властивості органічних речовин залежать від будови їхніх молекул. Цікавою особливістю органічних речовин: насичених, ненасичених, ароматичних, циклічних вуглеводнів, є здатність до синтезу.
Органічний синтез – розділ органічної хімії і галузь хімічної технології. Надзвичайно багатогранний процес, завдяки йому добуваються найрізноманітніші сполуки і використовуються в різних галузях народного господарства.
Основною сировиною для органічного синтезу є вуглеводні нафти, кам’яного вугілля, природних, супутнього нафтового та сланцевих газів.
- Робота з малюнком 11.1 «Основні продукти первинної переробки вуглеводневої сировини».
|
Вуглеводнева сировина |
Насичені вуглеводні |
Метан |
|
Парафіни |
||
|
Ненасичені вуглеводні |
Етен (етилен) |
|
|
Олефіни |
||
|
Ацетилен |
||
|
Ароматичні вуглеводні |
|
|
|
Синтез - газ |
|
Найважливіші синтетичні продукти сучасності: пластмаси, каучуки і волокна, сечовина ( карбамід), мийні засоби клеї, мастила, засоби захисту рослин, ліки, харчові добавки, розчинники… Ці продукти користуються широким попитом. Якщо провести широкий аналіз їх використання, то можна назвати величезні плюси їх використання. Такими є різноманітні матеріали з заданими властивостями. (Учні наводять приклади відомі їм з життя, курсу органічної хімії.) Широке використання синтезованих речовин привело до погіршення екологічного стану навколишнього середовища та стану здоров’я людини. (Учні наводять відомі їм приклади.)
2. Синтез на основі метану використовують переважно для промислового виробництва галогенопохідних, ацетилену, етилену, метанолу, амоніаку …
3. Синтез на основі парафінів ( розглянутий матеріал на с. 68 підручника зводиться у таблицю.
4. Синтез на основі етилену. (розглянутий матеріал підручника на с. 68 – 69 заноситься у таблицю)
Завдання при заповнення таблиці (схеми хімічних реакцій перетворити на рівняння хімічних реакцій).
|
Тип реакції |
Схеми хімічних реакцій |
Речовини орг.. синтезу |
|
Галогенування (хлорування) |
CH4 + Cl2 → CH3Cl + HCl CH3Cl + Cl2 → CH2Cl2 + HCl CH2Cl2 + Cl2 → CHCl3 + HCl CHCl3 + Cl2 → CCl4 + HCl |
Реагент орг.. синтезу Розчинник Холодоагент (фреон) Складова пестицидів, розчинник, отримання фреонів. |
|
Піроліз метану |
СН4 → С2Н2 + Н2 (15000С ) СН4 →С + Н2 |
Ацетилен і водень Сажа і водень |
|
Окиснювальний піроліз |
СН4 + О2 → С2Н2 + Н2О СН4 + О2 → С + Н2О |
Ацетилен Сажа |
|
Взаємодія з водяною парою |
СН4 + Н2О → СО + Н2 |
Добування синтез – газу |
|
Добування ненасичених вуглеводнів |
СН4 → С2Н2 + Н2 |
Етен (етилен) |
|
Перетворення синтез - газу |
СО + Н2 → СН3ОН |
метанол |
|
|
Пряме каталітичне перетворення на спирти і формальдегід |
|
|
|
Синтез на основі парафінів |
|
|
Хлорування етану |
СН3 – СН3 + Сl2 → С2Cl6
Хлорування твердих парафінів |
Для добування нітроцелюлозних пластмас, медицина Пластифікатор, вогнестійкість. |
|
Дегідрування етану |
С2Н6 → СН4 + Н2 |
Етен ( полімери) |
|
Каталітичне окиснення бутану |
С4Н10 + О2→ СН3СООН + Н2О |
Етанова кислота (оцтова) |
|
Крекінг |
С4Н10 → СН4 + С3Н6 С4Н10 →С2Н6 + С2Н4 |
Сполуки з меншою кількістю атомів вуглецю |
|
Полімеризація етилену |
nН2С = СН2 → (- СН2 = СН2 -) |
|
Під час заповнення таблиці детально розглядається матеріал підручника та попередньо вивчений матеріал.
- Коротеньке повідомлення учнів про пестициди.
- Коротке повідомлення учнів про харчові добавки.
VІ. Узагальнення та систематизація знань
- Робота з малюнками 11.5, 11.6, 11.7 Учні у трьох групах з допомогою підручника, додаткової літератури, вчителя записують рівняння хімічних реакцій за схемами на малюнках.
- Результати проведеної роботи записуються на дошці та взаємно перевіряються.
VIІ. Домашнє завдання
§11 №1 – 4, №5, підготувати повідомлення про пластмаси.
Урок №17
Тема. Органічні речовини як основа сучасних матеріалів.
Пластмаси. Лабораторний дослід № 4 «Ознайомлення зі
разками пластмас»
Мета: ознайомити учнів з пластмасами, способами їх добування,
видами, застосуванням та властивостями їх, як сучасних
органічних матеріалів;
розвивати навички самостійної роботи з підручником; в
малих групах та індивідуально при виконанні лабораторних
дослідів;
виховувати бережне ставлення до матеріалів та обладнання;
бережне ставлення до природи.
Тип уроку: поглиблення знань, формування вмінь і навичок.
Базові поняття: пластмаси, матеріал, полімеризація, поліконденсація, маркування.
ХІД УРОКУ
І. Організаційний момент
Налаштування емоційного стану учнів та готовності їх до роботи.
ІІ. Перевірка домашнього завдання
- Два учні у письмовій формі виконують завдання №5
- Робота з класом.
Дати визначення термінам: синтез, органічний синтез, сировина, крекінг, риформінг; типи реакцій: галогенування, піроліз, окиснення, дегідрування й гідрування, гідратація і дегідратація, полімеризація.
- Взаємоперевірка завдань № 1 – 4.
ІІІ. Актуалізація опорних знань
Бесіда
- Що означає пластична маса?
- Які пластичні маси відомі вам з дитинства? Що ви з ними робили?
- Що таке матеріал?
- Які матеріали є сучасними, чи пам’ятаєте коли вони з’явилися у вашому побуті?
- Що вам відомо про сучасні пластмаси?
ІV. Мотивація навчальної діяльності
Повідомлення теми і мати уроку.
На сьогоднішньому уроці учні дізнаються про нові матеріали на основі пластмас. Про їх застосування в побуті та особливості їх використання, щоб це було безпечно для життя.
V. Вивчення нового матеріалу
Бесіда. Розповідь вчителя.
Визначення терміну: матеріал –речовина ( або комбінація речовин), оброблена чи створена людиною для виготовлення певного об’єкта з корисними функціями.
* Змагання між учнями (двох парт чи двох рядів)
1. Назвати матеріали природного походження.
2. Назвати матеріали штучно створені людиною.
Сучасні матеріали вражають розмаїттям. Це такі як: пластмаси, синтетичні каучуки й гума, штучні й синтетичні волокна.
Що спільного між ними?
- Учні дають відповідь на це запитання опрацьовуючи §12 с.73- 74.
- матеріали виготовлені з природних чи синтетичних високомолекулярних сполук.
- Сировиною для їх виготовлення є переважно продукти нафтохімії.
- З них виготовляють посуд, меблі, ізоляційні матеріали,деталі до техніки, одяг.
- Вони добре горять, або не горять зовсім.
- Добре розтягуються ,або міцні і крихкі.
- Можуть виділяти шкідливі речовини при нагріванні.
Пластмаси – матеріали, виготовлені на основі полімерів і здатні внаслідок впливу нагрівання і тиску набувати певної форми і зберігати її після охолодження або тверднення.
Можна пластмаси розподілити на групи на основі синтетичних високомолекулярних сполук та на основі біосировини, штучних матеріалів.
Пластмаси на основі біосировини - мають унікальні властивості. Такі пластмаси розкладаються в природному середовищі і не чинять негативного впливу на довкілля. Виготовлені вони на основі природних полімерів. Їх виготовляють з модифікованого крохмалю, целюлози, хітозану ( який виділяють з панцирів крабів, креветок).
Назвіть природні джерела таких сполук.
Штучні матеріали – виготовляють при обробці природних полімерів. До них додають пластифікатори, наповнювачі, барвники і цим самим задають певних властивостей.
Синтетичні сполуки – це продукти синтезу на основі вуглеводневої сировини. Виготовлення їх іде на основі переробки: нафти, газу, вугілля.
Спрогнозуйте котра група матеріалів найбільш небезпечна для екології. Чому?
Залежно від того , як на пластмаси впливає нагрівання , їх ділять на дві великі групи:термопластичні і термореактивні. До термопластичних пластмас відносяться такі пластмаси, які від нагрівання і підвищення тиску не зазнають істотних хімічних змін. Вони стають лише пластичними або текучими, а від охолодження знову тверднуть, набуваючи попередніх властивостей. До цієї групи відносять поліетилен, поліпропілен, полівінілхлорид, полістирол, поліаміди… Для них можлива ре циклізація – повторна переробка без втрати властивостей.
До термореактивних пластмас належать полімери, які від нагрівання змінюють свої фізико – хімічні властивості, зокрема втрачають здатність плавитися і розчинятися в органічних розчинниках. Це зумовлено тим, що відбуваються хімічні реакції між макромолекулами і утворюється просторова структура полімеру. До цієї групи пластмасі відносять фенол формальдегідні, сечовино формальдегідні, епоксидні, поліефірні, та деякі інші види смол.
Маркування. Що відомо учням про маркування виробів з пластмас?
1988р Товариство пластмасової промисловості запровадило систему маркування й ідентифікаційні коди для всіх видів пластмас. Маркування складається з трьох стрілочок у формі трикутника, у середині яких розміщена цифра.
РЕТЕ (РЕТ) або ПЕТ) – поліетилен терфталат
HDPE або ПВТ – поліетилен високого тиску
V, PVC або ПВХ - полівінілхлорид
LDPE або ПНД – поліетилен низького тиску
PP або ПП - поліпропілен
PS або ПС - полістирол
OTHER або ІНШЕ (на можна рециклізувати)
VI. Узагальнення та систематизація знань
Матеріал §12 с. 76 – 80 самостійно опрацьовується учнями під час виконання лабораторного досліду №4
Демонстрація №3
Інструктаж з БЖД
Лабораторний дослід № 4
Тема. Ознайомлення із зразками пластмас
Мета: ознайомитися із зразками пластмас; порівняти їх властивості.
Обладнання та реактиви: зразки пластмас (на вибір учителя), розчини: калій перманганату, сульфатної кислоти (10%); натрій гідроксиду (10%); бромна вода, органічний розчинник( бензин або ацетон), штатив з пробірками.
Інструктаж з БЖД
ХІД РОБОТИ
Розгляньте видані вам матеріали і визначте для кожного: зовнішній вигляд; колір; пластичність; еластичність; температуру плавлення ( за довідником); густину (за довідником); розчинність у воді; хімічні властивості (відношення до бромної води, розчинів калій перманганату, сульфатної кислоти (10%), натрій гідроксиду (10%).
Результати спостереження занесіть у таблицю.
|
|
Назва матеріалу |
||||
|
Ознаки порівняння |
Поліетилен |
Полістирол |
Фенопласт |
Полівініл- хлорид |
Поліметил – метакрилат |
|
Формули компонентів матеріалу
|
пСН2=СН2 |
п(С6Н5-СН=СН2) |
п(с6н3(сн3)2 –он) |
пСН2=СНСl |
пСН2=С(СН3)-СООСН3 |
|
Зовнішній вигляд
|
Твердий гранули, плівки |
Твердий Оргскло, прозорий |
|
твердий |
Твердий Оргскло крихкий |
|
Колір
|
прозорий безбарвний |
безбарвний, прозорий |
Відтінки коричнево- го |
безбарвний |
Матово - біле |
|
Пластичність
|
120-340 кг/см2 на розрив |
|
|
Висока при додаванні пластифіка- торів |
|
|
Еластичність |
150 -200% |
|
|
|
міцний |
|
Густина
|
0,93 -0,96 г/см3 |
1,05 -1,08 г/см3 |
1,2 -1,22 г/см3 |
|
1,18 -1,30 г/см3 |
|
Температура плавлення,0С |
100-1300С розм’якшення |
85 -1100С розм’якшення |
150 -1800С |
|
180 – 2000С |
|
Розчинність у воді |
- |
- |
- |
- |
- |
|
|
Поліетилен |
Полістирол |
Фенопласт |
Полівініл – хлорид |
Поліметил – метакрилат |
|
Хімічні властивості. Взаємодія з:
|
|||||
|
-бромною водою |
|
+ |
|
|
|
|
-калій пер- манганатом |
|
|
|
|
|
|
-сульфатною кислотою |
- |
- |
- |
|
- |
|
-натрій гідроксидом |
- |
- |
- |
|
- |
|
-відношення до розчинни- ків (бензину або ацетону) |
|
- |
Добре розчинн. |
|
- |
|
Галузі застосування
|
Електро- ізоляція,прозорі плівки,деталі машин |
Оргскло, скло техніка хім. посуд, упаковка |
Клеї, лаки, пластмаси ізоляція |
Гнучкі вироби,штучна шкіра,хімічна апаратура |
Оргскло, лінзи лаки, протези зуби, очі, скло |
|
Властивості, які лежать в основі застосування
|
Висока хімічна стійкість, низька тепло-й електро- провідність |
Високі фізикомеха- нічні показ- ники, діелектрик |
Термост. негорючий діелектрик
|
Термо- пластичний |
Водостійкий низька t0стійкість, мала поверхне –ва твердість |
Порівняйте властивості речовин. Зробіть висновок.
Висновок._________________________________________________________________________________________________________________________________________________________________________________________
VII. Домашнє завдання
§12, № 1 – 4, № 5,6
VІII. Підсумок уроку
Додатковий матеріал до уроку
Пластичні маси ( пластмаси, пластики). Під пластичними масами розуміють велику групу матеріалі, основу яких становлять високомолекулярні сполуки, що від нагрівання та підвищення тиску можуть набувати різної форми і зберігати її. Найхарактерніша властивість пластмас – висока пластичність.
Пластмаси в два рази легші від алюмінію і в 5 – 8 раз – від сталі. За міцністю деякі з них перевершують окремі марки сталі і можуть використовуватись для виготовлення танкової броні, ракетних двигунів і літаків. Пластмаси використовують як замінники дефіцитних кольорових матеріалів – свинцю, міді, нікелю, олова, алюмінію, а також чорних металів.
Вихідними речовинами для синтезу полімерів є низькомолекулярні сполуки (мономери). Найважливішими видами сировини для добування мономерів є попутні і природні гази, нафта та продукти сухої перегонки кам’яного вугілля.
Карболанцюгові полімери
Поліетилен. Вихідним мономером для синтезу поліетилену у промисловості є етилен.
Етилен у промислових масштабах добувають з газів крекінгу і піролізу нафтопродуктів та коксових газів. Як каталізатор цієї реакції використовують алюміній оксид чи сульфатну кислоту.
Синтез поліетилену. Уперше низькомолекулярні полімери етилену добув у 1884 році російський учений Г. Г. Густавсон. Високомолекулярні полімери етилену синтезував лише в 1936 радянський учений О. І. Дінцес і приблизно в той же період англійські дослідники Фесетт і Джібсон.
Властивості поліетилену. Поліетилен – тверда, роговидна речовина молочно – білого, а іноді жовтувато білого кольору. За зовнішнім виглядом і на дотик нагадує парафін. У звичайних умовах він досить стійкий проти дії кислот ( за винятком нітратної кислоти), лугів і органічних розчинників. При нагріванні до 800С , він може розчинятися у тетрахлорометані, бензолі, толуолі, ксилолі. Поліетилен стійкий проти дії низьких температур ( до – 700С), газо – і водонепроникний, має добрі електроізоляційні властивості.
Поліетилен – типовий, наполовину кристалічний, полімер, в якому одночасно поєднуються кристалічна й аморфна фази.
Під впливом тепла і сонячного проміння на повітрі поступово окислюється ( старіє), внаслідок чого погіршуються його фізико – механічні властивості. Стійкість проти окиснення можна підвищити введенням анти окиснювачів. Стабілізуючу властивість проявляє також сажа, додають в межах 2%.
При радіоактивному опроміненні підвищується теплостійкість, але зменшується еластичність і розчинність.
Використання поліетилену. Випускають у гранулах і у вигляді плівок. Виготовляють вироби шляхом штампування, пресування, лиття під тиском і дуття.
Широко використовується як ізоляційний матеріал при виготовленні різних деталей радіотехнічної апаратури, для ізоляції електричних кабелів, особливо для високочастотних ліній і тих, які прокладають під землею і водою. З поліетилену виробляють вентилі, клапани,крани для хімічних апаратів, хімічний посуд ля зберігання мінеральних кислот і лугів. Особливо широко використовують для виробництва водопровідних, каналізаційних та інших видів труб, які значно легші за металеві, стійкі проти корозії і не лопають при замерзанні в них води. Виготовляють значну кількість кухонного осуду: миски, хлібниці, глечики, відра…
Газонепроникну плівку поліетилену широко використовують як чудовий пакувальний матеріал для харчових продуктів і галантерейних виробів. Її також широко використовують у сільському господарстві для покриття оранжерей, теплиць і парників.
Полімери галогенопохідних вуглеводнів
Полівінілхлорид. Вихідним продуктом для синтезу полівінілхлориду є вінілхлорид СН2 = СНСl. За нормальних умов вінілхлорид – це безбарвний газ з температурою кипіння – 140С і температурою плавлення – 1590С. Він має специфічний ефірний запах і проявляє наркотичну дію.
Основну масу полівінілхлориду випускають у вигляді білого аморфного порошку, густина якого становить 1,4 г/см3 і температура розм’якшення близько 850С.
Полімер характеризується високою полі дисперсністю. Ступінь полімеризації для різних фракцій одного і того самого полімеру становить 100 – 2500. Чим більше високомолекулярних фракцій, тим вища еластичність і морозостійкість. Молекулярна маса становить 18000 – 170 000 і залежить від способу і режиму полімеризації.
Низькомолекулярні полімери хлорвінілу розчиняються в ацетоні, складних ефірах і кетонах. Полівінілхлорид стійкий проти дії кислот, лугів, спиртів, насичених вуглеводнів, нерозчинний у воді.
Полівінілхлорид належить до групи термопластичних смол і є основою у виробництві двох видів пластмас – вініпласту і пластикату. Вініпласт – жорсткий , пружний матеріал. Він не горить, висока хімічна стійкість і механічна міцність. Випускають і вигляді плівок, листів, трубок, стержнів.
Плівки використовують як антикорозійний і електроізоляційний матеріал, а також для упаковки різних продуктів і матеріалів. Виготовляють: різні комунікації, вироби, деталі, труби для транспортування агресивних речовин та порівняно у високих температурах. Ним замінюють скло, кераміку, дерево, сталь.
Недоліками вінілпласту є його невисока теплоємність, крихкість при низьких температурах і зниження механічних властивостей при тривалому використанні.
Полімери кислот
Для виготовлення полі метилметакрилату використовують метилметакрилат – легко рухливу, прозору, безбарвну рідину з температурою кипіння 100,30С.
Поліметилметакрилові смоли – безбарвні, прозорі речовини з аморфною структурою, густина їх становить 1,12 – 1,25 г/см3. Молекулярна маса залежно від способу добування становить 150 000 – 200 000 чи 20 000 – 150 000.
Полімер стійкий проти дії кислот, лугів і не розчиняється в бензині та маслах. Густина його становить 1,18 – 1,30 г/см3. При нагріванні до 180 – 2000С, він повністю переходить у пластичний стан, а при температурі вище 2700С – руйнується.
Використовують переважно як органічне скло (плексиглас). Воно прозоре, гнучке і не дає осколків, пропускає до 73% ультрафіолетового проміння, а звичайне скло – тільки 1%. Використовують скло для скління вікон автомобілів, тролейбусів, літаків, лікарень, шкіл, житлових будинків. З органічного скла виготовляють лінзи для фотоапаратів, мікроскопів, біноклів. З нього також виготовляють вази, посуд, ґудзики, лінійки, ручки.
Водними дисперсіями (типу латексу) поліакрилатів просочують деревину, шкіру, тканини, папір, щоб підвищити водостійкість і надати їм блиску.
Недоліком є низька теплостійкість і мала поверхнева твердість.
Полімери ароматичних сполук
Полістирол. Для синтезу полістиролу використовують стирол(вініл бензол) Це легко рухома, прозора рідина з температурою кипіння 1460С. Основною сировиною для їх добування є етилбензен.
Молекулярна маса становить 100 000 – 200 000 і залежить від умов та способу полімеризації. Полістирол – тверда , прозора, склоподібна речовина з густиною 1,05 – 1,08 г/см3 і температурою плавлення 85 – 1100С. Макромолекули мають лінійну будову.
Полістирол стійкий проти дії кислот ( за винятком нітратної) і лугів, вологостійкий. Розчиняється в ефірах, кетонах і ароматичних вуглеводнях, але не розчиняється у спиртах і насичених вуглеводнях. Особливою цінністю є його добрі діелектричні властивості.
У хімічному відношенні проявляє високу активність. Здатний вступати у реакції гідрування, бромування, сульфування, нітрування.
Основним споживачем полістиролу є електротехнічна промисловість. З нього виготовляють ізоляційну плівку – стирофлекс, яку використовують для виробництва конденсаторів і для ізоляції спеціальних кабелів. Виробництво хімічного посуду, деталей для холодильників, радіоапаратури, оптичних виробів та багатьох виробів широкого вжитку. Упаковка харчових продуктів, фармацевтичних препаратів. У будівництві використовують пінопласти як теплоізоляційний матеріал.
Недоліки полістиролу є відносно висока крихкість, горючість і низька стійкість проти нагрівання.
Фенопласти. Під назвою фенопласти об’єднують велику групу полімерних сполук, що добувають поліконденсацією фенолів з альдегідами. Ці сполуки ще називають феноло – альдегідними смолами.
Новолачні смоли відносяться до термопластичних. Вони залишаються розчинними і плавкими навіть після довгого зберігання, а також коли нагріти їх до 150 – 1800С. Різновидності резину стійкі проти дії лугів. Бакеліт і карболіт мають високу стійкість проти дії пари брому, хлороводню і спиртових розчинів амоніаку.
Фенолформальдегідні смоли і пластики на їх основі – одні з найпоширеніших пластичних мас. Їх широко використовують для виробництва литих і пресованих фенопластів, шаруватих пластиків, лаків, клеїв.
Цінні властивості литих резитів - термостійкість і негорючість, добре піддається обробці на верстатах. Декоративні та ізоляційні матеріали.
Фенолформальдегідні смоли, в основному, ідуть на виготовлення пресованих матеріалів, що являють собою суміш наповнювача із смолою. Щодо структури наповнювачі можна поділити на дві великі групи: волокнисті (бавовни, азбест, скляне волокно, деревина) і порошкоподібні ( деревне борошно, каолін, мікроазбест, слюда, графіт). Гетинакс (наповнювач – папір), текстоліт – бавовняна тканина, склотекстоліт – скляне волокно чи тканина,
Гетинакс використовують у електромашинобудуванні та електротехніці завдяки високим ізоляційним властивостям. Текстоліт – твердий, діелектрик - виготовляють шестірні, вкладиші підшипників, шківи, гальмівні колодки. Склотекстоліт – велика механічна міцність, діелектрик, водостійкість, легкість і пружність. Використовують в електротехніці, авто і вагонобудуванні, авіаційній і ракетній техніці.
Урок №18
Тема. Синтетичні каучуки, гума. Лабораторний дослід № 5
«Ознайомлення зі зразками каучуків»
Мета: Ознайомити учнів з синтетичними канчуками, гумою;
розвивати вміння аналізувати та порівнювати; проводити
лабораторні досліди;виховувати самостійність, спостережливість.
Тип уроку: поглиблення знань, формування вмінь і навичок.
Базові поняття: синтетичний каучук, гума, натуральний каучук,
співполімеризація.
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
1.Індивідуальне опитування за запитаннями
- Дати загальну характеристику пластмас
- Охарактеризувати групи пластмас за походженням.
- Охарактеризувати пластмаси за відношенням до температури.
- Маркування пластмас.
2.Аналіз помилок при виконанні лабораторного досліду № 4
ІІІ. Мотивація навчальної діяльності
Повідомлення теми і мети уроку.
- Повідомлення учнів
Історія виникнення і виготовлення каучуку і гуми?
IV. Вивчення нового матеріалу
Розповідь вчителя
Каучуки – полімерні матеріали різноманітного складу і призначення. Вперше були виготовлені з соку дерева гевеї. У 15 - 16 століттях з природним каучуком проводились дослідження, по покращенню його властивостей. За цей час отримали великий об’єм інформації. У 1819 році розпочали виробництво одягу. Результат був невтішний, але стимулював до досліджень.
Каучуки характеризуються - пружністю, еластичністю, здатністю утримувати наповнювачі і піддаватись дії пластифікаторів. Класифікація каучуків
|
кк |
Натуральний |
Поліізопреновий |
(-сн2- с(сн3) = сн – сн2-)n |
|
Полібутадієновий |
(-сн2 – сн = сн – сн2-)n |
||
|
Синтетичний |
Поліізопреновий |
(-сн2 – с(сн3 = сн – сн2 -)n цис і транс форми |
|
|
Поліхлоропреновий |
(сн2 – с(сl) = сн – сн2 -)n |
||
|
Полібутадієнстирольний |
(-сн2 – с(сн3 = сн – сн2 -)n (- сн(с6н5) – сн2-) |
2.Гума – продукт вулканізації каучуку. Вулканізація – нагрівання каучуку з сіркою, при цьому молекули каучуку сполучаються між собою зв’язками з атомами Сульфуру. Залежно від вмісту Сульфуру в матеріалі розрізняють:
- м’яку гуму (масова частка Сульфуру до 5%)
- тверда гума ( масова частка Сульфуру 20%).
Гума з часу виникнення і в теперішній час є цінний матеріал для техніки та народного господарства.
Учням пропонується назвати галузі застосування і вироби з гуми відомі їм. На основі яких властивостей ґрунтується використання гуми.
- Синтетичні каучуки і гума на їх основі – мають переваги над природнім каучуком.
Їх можна отримувати з одного виду речовин чи різних видів і цим самим надавати необхідних властивостей. Це явище співполімеризації – утворення полімерів за участі двох мономерів.
- Каучуки загального і спеціального призначення.
(За галузями їхнього застосування)
Учні на основі §14 с. 85 складають табличку.
|
Класифікація |
Особливості використання |
Властивості |
Вироби |
|
|
Загального призначення |
Широке коло споживчої продукції |
Висока еластичність за звичайних температур |
Шини, транспортерні стрічки, взуття… |
|
|
Спеціального призначення |
Вузька спеціалізація , специфічні, екстремальні умови |
Стійкість до дії розчинників, технічних масел, кисню, озону, зберігають високу еластичність у широкому діапазоні температур |
Ізоляція, прокладки до техніки,шланги, взуття, антикорозійне покриття |
|
V. Узагальнення та систематизація знань
1. Робота з підручником та довідниковим матеріалом.
2. Виконання лабораторного досліду
Інструктаж з БЖД
Лабораторний дослід № 5
Тема. Ознайомлення із зразками каучуків
Мета: ознайомитися зі зразками каучуків; порівняти їхні властивості.
Обладнання та реактиви: зразки каучуків (на вибір учителя); розчини: калій перманганату, сульфатної кислоти (10%), натрій гідроксиду (10%), органічний розчинник (бензин або ацетон); бромна вода, штатив із пробірками.
ХІД РОБОТИ
Розгляньте видані вам матеріали і визначте для кожного: зовнішній вигляд; колір; запах; пластичність; еластичність; густину; розчинність у воді; хімічні властивості (відношення до бромної води, розчинів калій перманганату, сульфатної кислоти (10%), натрій гідроксиду (10%), розчинників (бензину або ацетону)
Результати спостереження занесіть у таблицю.
|
|
Назва матеріалу |
||||
|
Ознаки порівняння |
Натуральний каучук |
Синтетичний каучук ізопреновий |
Синтетичний каучук дивініловий |
Синтетичний каучук хлоропреновий |
|
|
Формули компонентів матеріалу |
(-сн2- с(сн3) = сн – сн2-)n |
(-сн2- с(сн3) = сн – сн2-)n |
(-сн=сн- сн= сн-)п |
(-сн - с(сl)= сн-сн2 -)п |
|
|
Зовнішній вигляд
|
Пружна аморфна маса |
|
|
Пружна жорстка речовина |
|
|
Колір
|
Темно - коричневий |
|
|
Білий – коричневий |
|
|
Пластичність
|
350(кг/см2) |
300(кг/см2) |
|
250(кг/см2) |
|
|
Еластичність
|
850% вулканізований |
800% |
|
500 – 1000% |
|
|
Густина
|
0,90- 0,93г/см3 |
|
|
|
|
|
Температура плавлення 0С |
|
|
|
|
|
|
Розчинність у воді |
- |
- |
- |
Нерозч |
|
|
Хімічні властивості. Взаємодія з: |
|||||
|
-бромною водою |
+ |
+ |
+ |
+ |
|
|
-калій перманганатом |
+ |
+ |
+ |
+ |
|
|
-сульфатною кислотою |
- |
- |
- |
- |
|
|
-натрій гідроксидом |
- |
- |
- |
- |
|
|
-розчинником (бензином або ацетоном) |
Добре розчинний |
набухає |
|
Бензин-набухає, ацетон - нерозчинний |
|
|
Галузі застосування
|
«сира гума», техніка, медицина ебоніт |
Виготовлення всіх гумових виробів, ебоніт, кабельна промисловість |
Техніка |
Ізоляція, прокладки до техніки,шланги, взуття, антикорозійне покриття |
|
|
Властивості, які лежать в основі застосування
|
Здатність полімеризував- тися, висока еластичність |
Менша зносостійкість і еластичність ніж в натурального |
Стійкий проти стирання |
Висока світло – і термо-стійкість,не горить, діелектрик |
|
Порівняйте властивості речовин. Зробіть висновок.
Висновок._________________________________________________________________________________________________________________________________________________________________________________________
VІ. Домашнє завдання
§13, №1- 5, № 6
VІІ. Підсумок уроку
Додатковий матеріал до уроку
Природний каучук
Природній каучук є праобразом всіх отриманих синтезом полімерних матеріалів: синтетичних канчуків, пластмас, синтетичних волокон.
Відомий у Європі з кінця 15 століття. У 496р. учасники експедиції Христофора Колумба розповідали про дивовижні властивості темно – коричневих кульок – м’ячів, що їх вони бачили на острові Гаїті.
Ці пружні еластичні м’ячі індіанці виготовляли із соку дерева гевеї. Проте цим повідомленням на той час ніхто не зацікавився.
Лише 1735р. експедиція французьких учених виявила в Перу дивовижні дерева гевеї, що досягли 40м висоти і до 2м в діаметрі.
На деяких деревах були зроблені надрізи, я яких витікав густий, білий, подібний до молока, сік Індіанці називали його каа – о – чу, що означає «сльози дерева». Цей сік вони збирали в чашки, зроблені з шкаралупи горіхів. За дві години кожне дерево дає близько 250см3 соку. На повітрі сік густішав, а від нагрівання набував механічної міцності та еластичності. Індіанці виготовляли із соку гевеї незвичайне взуття: обмазували соком дерев’яні форми і потім обкурювали їх димом. При цьому утворювався щільний шар, який не пропускав води. Так вони виготовляли м’ячі, пляшки та інші вироби домашнього вжитку. Учасники експедиції зібрали колекцію виробів, а також описали добування і переробку молочного соку ( латексу) з каучуконосних дерев. Вони привезли також колекцію зразків смоли каа – о –чу. Проте матеріал, привезений у Європу з Америки, не відразу знайшов застосування. Тривалий час не вдавалося використати таку цінну властивість каучуку, як водонепроникність.
У 18 столітті шматочками каучуку найчастіше стирали написане на папері. В 1819р. шотландський інженер Чарльз Макінтош запропонував розчиняти каучук у маслі, яке добували внаслідок перегонки кам’яновугільної смоли. Він заснував першу фабрику по виробництву водонепроникного одягу. Проте цей одяг був чутливий до зміни температури – з підвищенням її вироби ставали липкими і мали неприємний запах, а із зниженням ставали жорсткими і ламалися на згинах.
Почалися пошуки речовин, які б запобігли цим небажаним властивостям. Каучук змішували з різними хімічними сполуками але безуспішно. Лише в 1839р. Ч. Гудьїр під час проведення дослідів випадково упустив пластинку каучуку, на якій була зірка, на розжарену плиту і виявив, що з липкої маси каучук перетворився на пружну еластичну речовину, яка не боїться тепла і холоду.
Історія промислового використання каучуку розпочалась з 1839р., коли був відкритий процес вулканізації, що різко підвищує фізичні властивості каучуку. З цього часу пішов швидкий ріст його промислового використання. Найбільшу кількість його стала використовувати автомобільна промисловість, на другому місті стояла електротехнічна промисловість і виробництво різних гумових виробів. Монополістом виробництва природного каучуку довгий час залишалась Бразилія. Хоча насіння гевеї під страхом смерті вивозити заборонялось, в 1876р. англійці таємно вивезли насіння гевеї і посадили його на Цейлоні.
Перший каучук з плантацій отримали в 1899р.; в 1910р. 10% всього світового виробництва каучуку давали плантації, до 1915р. відсоток зріс до 70. В 1946р. плантації Індонезії, Малайї, Індокитаю давали майже весь природній каучук.
Природній каучук являє собою пружну аморфну масу, що отримують з молочного соку (латексу), рослин – каучуконосів. Найбільш відомим каучуконосом є дерево гевея. Менша кількість каучуку міститься в багатьох культурах, переважно тропічних.
До каучуконосів можна віднести фікус, кок – сагиз, крим – сагиз.
Дослідники, які вивчали властивості латексу, помічали, що він подібний до молока. Латекс мав такий само колір і з часом, якщо його не збовтували, відстоювався, утворюючи на поверхні шар каучуку. Будова краплі латексу під мікроскопом також подібна до краплі молока. Маленькі кульки каучуку, які дуже нагадують кульки жиру в молоці, назвали глобулами. У латексі міститься в 10 разів більше каучуку, ніж жиру в молоці. Латекс гевеї - це емульсія рослинного соку з каучуком. Глобули каучуку сполучаються між собою, утворюючи більші частинки, які з’єднуються і поступово утворюють тверду масу. В латексі міститься 52 – 60% води, 34 – 37% каучуку, 2,0 – 2,7% білків, 1,7 – 3,4% смол, 1,5 – 4,0 цукрів і 0,2 – 0,7% золи.
В 50р. ХХ ст. навчились виробляти синтетичний каучук такої високої якості, що він став повністю заміняти природній.
Вивчення хімічних властивостей каучуку показало, що він володіє типовими для ненасичених сполук властивостями: приєднує Бром, бром оводень, а також піддається каталітичному гідруванню. Ще в кінці ІХХ ст.. було встановлено, що при нагріванні без доступу повітря каучук розпадається з утворення ізопрену СН2=С (СН3) – СН=СН2.
Основи сучасних уявлень про каучук висвітлив у роботах К. Гаррієс в 1905 – 1912 рр. Він скористався методом озонування,
який з того часу був взятий на озброєння хіміками при вивченні ненасичених вуглеводнів.
Природній каучук є сумішшю полімерогомологів з різною молекулярною масою від 50 000 до 3 млн., основна маса припадає на фракції з молекулярною масою більше мільйона.
Природній каучук – лінійний полімер ізопрену, володіє не тільки строго регулярною будовою, але і певною конфігурацією біля подвійного зв’язку.
У природного каучуку здатність до розтягування дуже велика і досягає 1000 і більше відсотків. Це означає, що каучук і каучукоподібні речовини можна розтягнути в 10 і більше разів, і після зняття навантаження вони знову набувають свої попередні розміри. Досить цікава природа даного явища. Каучук набуває попередніх форм за рахунок теплових рухів. В звичайному, не розтягнутому стані нитковидні молекули каучуку мають різні форми (різні конформації), переважно хаотично – клубкоподібні. Каучук в його звичайному стані можна порівняти з «клубком змій». При розтягуванні його ниткоподібні молекули розміщуються більш упорядковано: ковзаючи одна повз іншу, вони розміщуються більш чи менш паралельно. Після зняття навантаження макромолекули в результаті теплового руху згортаються і повертаються до попередніх форм.
Для здійснення даного механізму необхідно ряд умов. Молекули повинні бути досить гнучкими, здатними набувати різних форм, певні міжмолекулярні сили.
Сирий, необроблений каучук володіє незначною пружністю. Вже при невеликому підвищенні температури стає схожим на пластичну смолу. В процесі вулканізації відбувається «зшивання» ниткоподібних молекул каучуку за допомогою місточків утворених сіркою. В результаті цього дещо зростає взаємодія між ланцюгами і підвищується пружність. При подальшій вулканізації кількість «S місточків» зростає, їх стає так багато, що вони міцно «зшивають» молекули каучуку, закріплюють їх нерухомо. Так каучук перетворюється на твердий нееластичний ебоніт.
Урок 19
Тема:Штучні і синтетичні волокна. Лабораторний дослід № 6
«Ознайомлення зі зразками натуральних, штучних і
синтетичних волокон»
Мета: Ознайомити учнів з штучними і синтетичними волокнами;
розвивати вміння аналізувати та порівнювати; проводити
лабораторні досліди;виховувати самостійність, спостережливість.
Тип уроку: поглиблення знань, формування вмінь і навичок.
Базові поняття: штучні волокна, синтетичні волокна.
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання, актуалізація опорних
знань
- Два учні у письмовій формі виконують завдання №6
- Робота з класом.
1.Охарактеризувати природні каучуки. Історію їх відкриття.
2.Дати характеристику гуми.
3.Охарактеризувати, чим подібні і чим відрізняються натуральні і синтетичні каучуки.
- Взаємоперевірка завдань № 1 – 5.
- Аналіз виконання, типових помилок лабораторного досліду №6.
ІІІ. Мотивація навчальної діяльності
Проблемні питання
- Яку класифікацію ви б запропонували волокнам з яких виготовлявся одяг сучасний і ваших бабусь.
- Поясніть, чому в засобах масової інформації часто попереджають про вироби з неякісних матеріалів, часто небезпечних для здоров’я. З чим це пов’язано?
ІV. Вивчення нового матеріалу
Розповідь учителя
Розгляньте колекції природних і хімічних волокон. З котрими з них ви знайомі? Що ви про них знаєте. ( Коротенька відповідь учнів.)
1.Волокна - матеріали, що складаються з непрядених ниток або довгих тонких відрізків ниток. Це гнучкі утворення з дуже малим (порівняно з довжиною) поперечним перерізом. (Пересвідчимось у цьому на прикладі різних видів ниток)
2.Класифікація волокон ( за походженням) (Рослин з яких виготовляють тканини)
Волокна
/ │ \
Природні Хімічні
Штучні Синтетичні
│ │ │
Бавовна Віскоза Капрон, нейлон
Льон (штучний шовк) Лавсан
Коноплі Мідно – аміачне Хлорин
Вовна Триацетатне Нітрон (акрил)
Шовк Кевлар
Пропонується учням відібрати з наборів тканин ті, що їм відомі і дати їм характеристику. Вказавши при цьому переваги і недоліки тканини при використанні. Штучні волокна – продукти хімічної переробки природних волокон (целюлози).
Віскозне волокно одержують із целюлози. Віскозу застосовують для виробництва штучної шкіри (кирза), віскозних не волоконних виробів (целюлозна плівка, пластифікована гліцерилом – целофан). Для прядіння віскозного волокна.
Спочатку готують розчин, потім продавлюють його крізь вузькі отвори спеціального апарата – філь’єри. Волокна сушать і вибілюють. З волокон віскози скручують нитки, з яких тчуть приємну на дотик тканину (віскозний шовк). Тканина за блиском і деякими властивостями схожа до природного шовку.
Мідно – аміачний шовк має високу міцність, тонкий, красивий.
Триацетатне волокно – також добувають з похідних целюлози.
- Самостійна робота учнів з таблицею 14.1, послідуючий аналіз інформації.
Синтетичні волокна – виробляють з полімерів переважно прядінням з розплаву.
Преваги і недоліки синтетичних волокон.
( Робота з таблицею 14.2)
V. Узагальнення та систематизація знань
Інструктаж з БЖД
Лабораторний дослід № 6
Тема. Ознайомлення зі зразками натуральних, штучних і синтетичних волокон
Мета: Ознайомитися зі зразками натуральних, штучних і синтетичних волокон; порівняти їхні властивості.
Обладнання та реактиви: зразки волокон (на вибір учителя), розчини: калій перманганату, сульфатної кислоти (10%), натрій гідроксиду (10%); бромна вода, органічний розчинник (бензин або ацетон); штатив із пробірками.
ХІД РОБОТИ
Розгляньте видані вам матеріали і визначте для кожного: зовнішній вигляд; колір; запах; пластичність; еластичність; густину; розчинність у воді; хімічні властивості (відношення до бромної води, розчинів калій перманганату, сульфатної кислоти (10%), натрій гідроксиду (10%), розчинників (бензину або ацетону)
Результати спостереження занесіть у таблицю.
|
|
Назва матеріалу |
||||
|
Ознаки порівняння |
Бавовна |
Вовна |
Капрон |
Лавсан |
Нітрон |
|
Формули
|
(с6Н10О5)п |
R-CO – NH - R |
(-СО-NН-(СН2)5-)п |
(-co-с6н4 – соо сн2)2o-) п |
(-сн2-сн(с≡N) -)п |
|
Зовнішній вигляд
|
Волокниста, деформована м’яка |
Волокниста хвиляста м’яка |
Тверда речовина |
|
Порошок плівки гранули |
|
Колір
|
біла |
Біла –бура |
безбарвна |
|
білий |
|
Пластичність
|
41 -54 кг с/см2 |
35 -42 г/см2 |
|
|
|
|
Еластичність |
7,3% |
26% |
|
|
700 – 900% |
|
Густина
|
1,52 г/см3 |
1,35 г/см3 |
1,42 г/см3 |
1,38г/см3 |
1,14 -1,15 г/см3 |
|
Температура плавлення,0С |
|
|
2150С |
250 -2600С |
не плавиться 230 – 300 руйнується
|
|
Розчинність у воді |
- |
- |
- |
- |
- |
|
Хімічні властивості. Взаємодія з:
|
|||||
|
-бромною водою |
|
|
|
|
|
|
-калій пер- манганатом |
|
|
|
|
|
|
-сульфатною кислотою |
- |
- |
Малостійке проти дії к. |
стійкий |
- |
|
-натрій гідроксидом |
Набрякає, не розчиняється |
Розчиня -ється |
Не розчиняється |
Не розчиня – ється |
Не розчиняється |
|
-відношення до розчинни- ків (бензину або ацетону) |
- |
|
|
|
|
|
Галузі застосування
|
Одяг, тканини, вата, трикотаж |
Одяг, одіяла, |
Одяг, штучне хутро,килими, парашути, деталі для машин |
Тканини, канати, пожежні рукави |
Одяг, килими, маслостійка гума, канати |
|
Властивості, які лежать в основі застосування
|
Гігроскопічна Міцні, хімічно стійкі, пропускають повітря |
Мало гігроскопіч – на, утримує тепло, чутлива до високих температур |
Висока міцність, Негігроскопіч- ний, хімічно стійкий |
Велика міцність, зносостій- кість, термо- стійкість |
Хімічна стійкість, гігроскопічний термостійкий світлостійкий |
Порівняйте властивості речовин. Зробіть висновок.
Висновок._________________________________________________________________________________________________________________________________________________________________________________________
VІ. Домашнє завдання
§ 14, № 1- 4, № 5
Творче завдання с. 97.( створіть реальну колекцію волокон, тканин).
VІІ. Підсумок уроку
Додатковий матеріал до уроку
Нітрон – в основному використовують для виробництва волокна нітрон (СРСР), орлан (США), пан (ФРН).
Його широко використовують і чистий , і в суміші з іншими волокнами. З нього виготовляють светри, кофточки, шкарпетки, трикотажну білизну, костюмні тканини, теплі підкладки для пальт, штучний каракуль, килими, канати… Вироби з нітрону не вбирають масляних і жирних речовин, а також внаслідок пружності волокон легко відновлюють попередню форму.
Целюлоза , або клітковина, є основною складовою частиною рослинних клітин, звідки і походить її назва. Вміст в деревині близько 40 – 50%, льон 80 – 90%, джут 75%. У деяких рослин (бавовнику) вміст целюлози може досягати 97 – 98%.
Ацетатне волокно використовують для виготовлення трикотажної і шовкової тканини, а також застосовують для часткової заміни шерсті при виготовленні тонких суконь і деяких трикотажних виробів. Тканини виготовлені на основі ацетатного волокна, мають гарний блиск, еластичні, вбирають мало вологи, дають незначну усадку після прання порівняно з іншими видами штучних волокон.
Віскозне волокно – найпоширеніший вид штучного волокна.
З мідно – аміачних волокон виготовляють килими, сукна, а також трикотажні вироби і легкі тканини. Велика кількість їх іде на виготовлення мідно – аміачного шовку, який має гарний зовнішній вигляд, блиск, еластичність, легко фарбується різними барвниками.
Недоліком цього волокна є висока адсорбційна здатність щодо води, а також недостатня хімічна і механічна міцність, порівняно з натуральним шовком.
Капронове волокно – своєю еластичністю, міцністю і стійкістю проти стирання перевищує значну кількість природних і синтетичних волокон. Воно стійке проти дії лугів, мікроорганізмів, вологи. Капронове волокно широко застосовують для виготовлення різних трикотажних виробів – капронових кофточок, панчіх, шкарпеток, рукавиць, штучного каракулю…
У промисловості з капронового волокна виробляють кордову тканину для автомобільних і авіаційних шин, транспортерні стрічки, рибальські сіті, парашутні тканини.
Урок № 20
Тема:Органічні сполуки і здоров’я людини
Мета:довести до учнів відомості про позитивний та негативний вплив органічних речовин на здоров’я людини; розвивати критичне і аналітичне мислення учнів;виховувати бережливе ставлення учнів до власного здоров’я
Обладнання та реактиви: зразки органічних сполук, що можуть позитивно чи негативно впливати на здоров’я людини (лікарські препарати, засоби побутової хімії); курячий білок, етанол, пробірки.
Тип уроку:комбінований
ХІД УРОКУ
І. Організацій момент
ІІ. Актуалізація опорних знань
Запитання до учнів
1. За якою ознакою волокна класифікують на природні, штучні і синтетичні ?
2. Який зв'язок між властивостями волокон і їхнім застосуванням ?
3. Які переваги та недоліки синтетичних волокон ?
ІІІ. Мотивація навчальної діяльності
В сучасному суспільстві широко використовуються продукти органічної хімії. Кожного дня синтезуються нові речовини, які покликані забезпечити комфортне існування людям. На жаль дуже важко спрогнозувати наслідки використання синтетичних хімічних речовин. Для того, щоб знизити ризик використання даних речовин потрібно дотримуватися правил безпечного поводження з продуктами органічної хімії. На сьогоднішньому уроці ми з вами спробуємо визначити позитивні і негативні моменти та виробити основні правила поведінки з хімічними речовинами, що зустрічаються у повсякденному житті.
ІV. Вивчення нового матеріалу
1. Органічні сполуки в медицині
Органічна хімія дуже тісно пов’язана з медициною. Величезна кількість різноманітних лікарських засобів, якими володіє сучасна медицина, в переважній більшості органічні сполуки. Встановивши будову багатьох природних сполук, що використовуються в медицині, вчені-хіміки не лише зуміли синтезувати їх, а й створили  аналогічні сполуки, часто з більш ефективною дією. Крім того, були отримані нові лікарські засоби, які не знає природа, але здатні виліковувати багато хвороб.
аналогічні сполуки, часто з більш ефективною дією. Крім того, були отримані нові лікарські засоби, які не знає природа, але здатні виліковувати багато хвороб.
Значну роль в медицині відіграють синтетичні полімерні матеріали. Вони використовуються досить широко: від одноразових шприців до штучних клапанів серця
2. Органічні сполуки в продуктах харчування, їх вплив на здоров’я людини
Органічна хімія вже давно знайшла застосування в харчовій промисловості. В харчові продукти додають різні хімічні речовини. Одні з них надають їжі більш привабливий вигляд, інші – приємний запах, треті – смак. Але вони можуть виконувати і більш важливу роль – збільшувати термін зберігання продуктів. Крім традиційних цукру, меду, оцтової та лимонної кислоти на сьогоднішній день до продуктів харчування додають багато харчових добавок, які негативно позначаються на здоров’ї людини.
Інструктаж з БЖД
Демонстрація 6. Денатурація білка під дією етанолу
У пробірку налити 1 мл розчину курячого білка, додати таку ж саму кількість етанолу. Спостерігати згортання білка.
* Виходячи з даного досліду охарактеризуйте вплив алкоголю на організм людини.
3. Органічні сполуки в побуті
Мозковий штурм
Назвіть відомі вам органічні сполуки, які використовуються у повсякденному житті
Із названих учнями і записаних на дошці речовин поступово закреслити ті, без яких можна обійтися або ж замінити їх більш безпечними.
V. Узагальнення і систематизація знань
Дискусія. В ході дискусії учні формують своє ставлення до проблем:
- Шкідливий вплив на здоров’я людини органічних сполук.
2. Необхідність використання людиною органічних сполук.
VІ. Домашнє завдання Повторити теми «Жири», «Білки» (9 клас)
VІ. Підведення підсумків уроку
Урок № 21
Тема: Жири, білки як компоненти їжі, їх роль в організмі
Мета:довести до учнів відомості про біологічну роль жирів і білків у тваринних і рослинних організмах; дати уявлення про насичені і ненасичені жири, з’ясувати їхнє значення як продуктів харчування; розвивати вміння характеризувати органічні сполуки як компоненти їжі та обґрунтовувати їх біологічну роль; виховати культуру харчування
Обладнання: таблиця «добова потреба організму в білках, жирах, вуглеводах»
Тип уроку: комбінований
Базові поняття: жири, білки, гідрофільні та гідрофобні залишки, транс-жири.
ХІД УРОКУ
І. Організацій момент
ІІ. Актуалізація опорних знань
«Мікрофон»
Пригадайте, що ви їли сьогодні на сніданок. Які з цих продуктів містять жири і білки ?
ІІІ. Мотивація навчальної діяльності
Органічна хімія вивчає значну кількість речовин, що входять до складу живих організмів та є основою їх життєдіяльності. Жири, білки, вуглеводи є основними компонентами нашої їжі. Сьогодні ми повинні узагальнити знання, які ви отримали на уроках біології та хімії у попередніх класах.
ІV. Вивчення нового матеріалу
1. Їжа - джерело енергії і речовин для всіх живих організмів (бесіда)
* Пригадайте з курсу біології складові процесу живлення і поясніть, чому він є необхідною умовою існування живих істот.
* Які саме речовини надходять у складі їжі до організму людини ?
2. Жири ( розповідь з елементами бесіди)
Головна складова жирів – естери трьохатомного спирту гліцерину і карбонових кислот, що містять від 5 до 24 атомів Карбону в ланцюзі.
Температура плавлення жирів залежить від складу і будови кислотних залишків у їхніх молекулах. Насичені жири ( вони містять залишки стеаринової та пальмітинової кислот) зазвичай тверді. Олії – ненасичені жири, що містять залишки олеїнової та інших вищих ненасичених кислот.
У будь-якому природному жирі є і інші компоненти – барвники, запашні речовини, вітаміни. До складу нерафінованої олії входять фосфатиди, продукти термічного розкладання, які забезпечують функціонування клітинних мембран, оскільки містять гідрофільну і гідрофобну складову.
* Поясніть значення термінів «гідрофільний» та «гідрофобний».
В організмі фосфатиди беруть участь у транспортуванні жирів, жирних кислот і холестерину. Під час травлення жири зазнають гідролізу, продукти якого – вищі жирні кислоти – окислюються в мітохондріях. Цей процес супроводжується виділенням значної кількості енергії.
Нестача жирів у харчуванні призводить до порушення обміну речовин і енергії в організмі.
* Пригадайте, які ви знаєте жиророзчинні вітаміни ?
Також шкідливим є надлишок жирів у раціоні, дисбаланс між кількістю спожитих тваринних жирів і олій. Він є однією із причин виникнення атеросклерозу, унаслідок чого на стінках кровоносних судин утворюються бляшки холестерину.
* Чому небезпечним є відкладання холестерину на стінках кровоносних судин ?
Важливо також дотримуватися сталого співвідношення між оліями (30-40 % раціону) і тваринними жирами (60 – 70 % раціону). Вживання продуктів, що містять транс-жири , - кондитерських виробів, маргарину, майонезі слід мінімізувати аж до повної відмови від них. Також надзвичайно шкідливими є жири, що зазнали сильного нагрівання та окиснення.
 * Які страви містять такі жири ?
* Які страви містять такі жири ?
Особливо шкідливі продукти, приготовані на багаторазово використовуваній або прогірклій олії.
3. Білки (робота з підручником)
Опрацювати текст підручника, заповнюючи таблицю
|
Було відомо |
Дізнався нового |
|
|
|
V. Узагальнення і систематизація знань
Користуючись додатками 2-4 підручника підготуйте для молодших школярів поради з раціонального харчування.
VІ. Домашнє завдання
§15 с.97-101. підготувати повідомлення про значення вітамінів для здоров’я людини
VІІ. Підведення підсумків уроку
Урок № 22
Тема: Вуглеводи, вітаміни як компоненти їжі, їх роль в організмі
Мета: розширити уявлення учнів про різноманітність органічних сполук на прикладі вуглеводів; визначити значення вітамінів і вуглеводів для життєдіяльності організмів; проаналізувати їжу як джерело вітамінів і вуглеводів; розвивати вміння характеризувати органічні сполуки як компоненти їжі та обґрунтовувати їх біологічну роль; виховати культуру харчування
Обладнання: таблиця «добова потреба організму в білках, жирах, вуглеводах»
Тип уроку: комбінований
Базові поняття: моносахариди, дисахариди, полісахариди, вітаміни
ХІД УРОКУ
І. Організацій момент
ІІ. Актуалізація опорних знань
Бесіда за питаннями:
1. Який склад та властивості мають жири ?
2. Яку роль відіграють жири в живих організмах ?
3. Який зв'язок існує між амінокислотами і білками ?
4. Яке значення мають білки для живих організмів ?
ІІІ. Мотивація навчальної діяльності
Вуглеводи – потужне енергетичне джерело забезпечення життєдіяльності організму . Роль вітамінів у забезпеченні нормального функціонування організму важко переоцінити. Ці сполуки забезпечують життєво необхідні процеси в організмі , беруть активну участь в обміні речовин. Цінність харчових продуктів багато в чому визначається наявністю в ній вітамінів.
ІV. Вивчення нового матеріалу
1. Вуглеводи (розповідь з елементами бесіди)
 Вуглеводи є основним джерелом енергії організму. Енергетичний потенціал глюкози С6Н12О6 реалізується внаслідок біохімічних перетворень за участі АТФ.
Вуглеводи є основним джерелом енергії організму. Енергетичний потенціал глюкози С6Н12О6 реалізується внаслідок біохімічних перетворень за участі АТФ.
* Використовуючи знання з курсу біології розшифруйте абревіатуру АТФ.
Отриману енергію організм використовує під час м’язових скорочень, біосинтезу білків та інших життєво важливих процесів.
Тваринні організми здатні накопичувати в печінці водорозчинний полісахарид глікоген. Цей енергетичний резерв може бути швидко мобілізований за необхідності компенсувати раптову нестачу глюкози.
Резервне джерело живлення рослин – запаси нерозчинних у воді зерен крохмалю (С6Н10О5)п .
*Які сільськогосподарські культури є джерелом крохмалю ?
Під час перетравлювання крохмаль зазнає ступінчастого ферментативного гідролізу, кінцевим продуктом якого є глюкоза:
крохмаль → декстрин → мальтоза → глюкоза
* Де в організмі розпочинається гідроліз крохмалю ? Як це можна довести експериментально ?
Целюлоза має значення як корм для свійських тварин і компонент здорового харчування людини.
Фруктоза – важлива складова харчування людей з порушеним обміном речовин. Лікувальні властивості меду і фруктів багато в чому зумовлені наявністю цього моносахариду.
Дисахарид сахарозу одержують із цукрової тростини, цукрового буряку, пальмового і кленового соків.
 Середня добова норма споживання вуглеводів становить близько 500 г . Розраховуючи кількість вуглеводів у раціоні, слід уникати їхнього надмірного споживання, яке може призвести до ожиріння. Однак навіть за дотримання дієти їхня маса в добовому раціоні має становити не менше 100 г. Адже за нестачі вуглеводів в організмі порушується обмін жирів і білків.
Середня добова норма споживання вуглеводів становить близько 500 г . Розраховуючи кількість вуглеводів у раціоні, слід уникати їхнього надмірного споживання, яке може призвести до ожиріння. Однак навіть за дотримання дієти їхня маса в добовому раціоні має становити не менше 100 г. Адже за нестачі вуглеводів в організмі порушується обмін жирів і білків.
2. Вітаміни як компоненти їжі
Повідомлення учнів
Учні наперед отримують завдання підготувати короткі повідомлення про основні групи вітамінів.
V. Узагальнення і систематизація знань
1. Заповнити таблицю
|
Вітаміни |
Функції вітамінів |
Гіповітаміноз |
Основні джерела |
|
|
|
|
|
VІ. Домашнє завдання
§ 15 с.101-102, № 1-5 с.103
VІІ. Підведення підсумків уроку
Урок № 23
Тема: Харчові добавки, Е-числа
Мета: довести до учнів відомості про значення харчових добавок, їхню необхідність і небезпеку для здоров’я; визначити значення хімії в сучасній харчовій промисловості;розвивати критичне мислення учнів; виховувати культуру харчування
Обладнання та реактиви: етикетки від продуктів харчування,
Тип уроку:комбінований
Базові поняття: харчові добавки, Е-числа, консерванти, антиоксиданти, емульгатори, стабілізатори.
ХІД УРОКУ
І. Організацій момент
ІІ. Актуалізація опорних знань
Знайти відповідності між колонками таблиці
|
Речовина |
Характеристика |
|
1. Білки |
А.Резервне джерело живлення рослин |
|
2. Жири |
Б. Вуглевод, мономер |
|
3. Глюкоза |
В. Необхідні для життя аміни |
|
4. Крохмаль |
Г. Естери трьохатомного спирту гліцерину і вищих карбонових кислот |
|
5. Вітаміни |
Д. Дисахарид, зустрічається в молочних продуктах |
|
6. Лактоза |
Е. Енергетичний резерв тваринних організмів |
|
7. Глікоген |
Є. Полімери, мономерами яких є амінокислоти |
ІІІ. Мотивація навчальної діяльності
 Купуючи в магазині печиво, майонез чи інші продукти досить часто на етикетці ми бачимо літеру «Е» з номером. Що це за числа? Який вплив вони несуть на організм людини ? все це ми з вами маємо встановити на сьогоднішньому уроці.
Купуючи в магазині печиво, майонез чи інші продукти досить часто на етикетці ми бачимо літеру «Е» з номером. Що це за числа? Який вплив вони несуть на організм людини ? все це ми з вами маємо встановити на сьогоднішньому уроці.
ІV. Вивчення нового матеріалу
1. Харчові добавки – природні й синтетичні сполуки, що вводять у харчові продукти під час їхнього виробництва для надання заданих властивостей та збереження якості. Вони запобігають псуванню харчів, зміні їхнього кольору, консистенції тощо.
Морська і кам’яна сіль, мед, оцет, прянощі, рослинні барвники, селітра, сірчистий газ, яким обкурювали винарні і винні діжки, - харчові добавки, які здавна використовували люди.
У наші дні використання харчових добавок пов’язане зі створенням нових видів їжі й потребою поліпшення технології отримання традиційних і новітніх харчових продуктів.
2. Класифікація харчових добавок
- натуральні барвники виготовляють з пігментів комах, мікроорганізмів і рослин;
- синтетичні барвники мають більш інтенсивні кольори і є більш стійкими до змін температури і дії світла;
- консерванти запобігають розмноженню бактерій, грибів і призначені для подовження термінів зберігання продуктів;
- стабілізатори кольору використовуються у виробництві м’ясних та ковбасних виробів, зазвичай використовують нітрит і нітрат Натрію;
- антиоксиданти - добавки, які використовують для зберігання свіжості харчових продуктів. Ці сполуки добавляють до складу масел, аби запобігти згіркненню та зміні кольору внаслідок окиснення.
- стабілізатори, емульгатори, загусники, драгле утворювачі та ущільнювачі агенти використовують для збереження наперед заданої консистенції продукту, а також підвищення в’язкості;
- регулятори кислотності, розпушувачі, речовини проти злежування використовують переважно у хлібопекарській і кондитерській галузях;
- підсилювачі смаку і аромату посилюють смакове сприйняття, надають продукту привабливого, апетитного запаху;
- підсолоджувачі – використовуються для виготовлення дієтичних харчів спеціального призначення, зокрема для хворих на цукровий діабет.
3. Умови надання речовині статусу харчової добавки і ідентифікаційного номера – Е – числа
- речовину перевірено на безпечність;
- її застосування не введе споживача в оману щодо типу й складу харчового продукту, до якого її введено;
- для цієї речовини визначено критерії чистоти, необхідні для досягнення певного рівня якості харчів.
Відповідно до європейської цифрової кодифікації харчові добавки класифікують у такий спосіб:
- Е 100…Е182 – барвники;
- Е 200 і далі –консерванти;
- Е 300 і далі – антиоксиданти;
- Е 400 і далі – стабілізатори консистенції;
- Е 450 і далі, Е 1000 – емульгатори;
- Е 500 і далі – регулятори кислотності, розпушувачі;
- Е 600 і далі – підсилювачі смаку і аромату;
- Е 700 – Е 800 – запасні індекси для іншої можливої інформації;
- Е 900 і далі – глазурувальні агенти, піногасники, поліпшувачі хліба.
Лабораторний дослід № 7
Інструктаж з БЖД
Тема: Ознайомлення зі змістом етикеток на харчових продуктах
Мета: ознайомитися з інформацією, що міститься на етикетках до харчових продуктів
Обладнання: етикетки до харчових продуктів, які учні самостійно приносять на урок
Хід роботи
1. Уважно прочитайте етикетку до харчового продукту, заповніть таблицю
|
Інформація на етикетці |
Показники |
Вплив на організм людини |
|
Білки |
|
|
|
Жири |
|
|
|
Вуглеводи |
|
|
|
Вітаміни |
|
|
|
Хімічний склад |
|
|
|
Харчові добавки |
|
|
|
Е – числа |
|
|
|
Калорійність |
|
|
|
Термін придатності |
|
|
|
Спосіб зберігання |
|
|
|
Виробник |
|
|
2. Зробіть висновок: Етикетки до харчових продуктів необхідні для _____________________________________________.
VІ. Домашнє завдання
§16, № 1-5 (середній рівень), № 8 (достатній та високий рівні) с. 110
VІІ. Підведення підсумків уроку
Урок № 24
Контрольна робота
І варіант
Завдання з вибором однієї правильної відповіді (0,5 б)
1. Виберіть хімічну формулу поліпропілену:
а)(-СН2–СН2-)п; в)(- Н2С – СН (С6Н5)-)п;
б)(-Н2С–НС(СН3)-)п; г)(-Н2С – НС = СН – СН2 -)п
2. Вкажіть сполуку, яка здатна полімеризуватися:
а) етан; б) етен; в) метан; г) бензен.
3. В основі виробництва маргарину лежить процес: а) гідролізу жирів; б) гідратації жирів; в) гідрування жирів; г) дегідрування жирів.
4. Крохмаль синтезується в рослинах із: а) фруктози; б) сахарози; в) глюкози; г) пентози.
Завдання з вибором кількох правильних відповідей (1 б)
5. Виберіть властивості , характерні для крохмалю: а) повністю розчиняється у воді; б) дає синє забарвлення з йодом; в) піддається гідролізу; г) у гарячій воді утворює клейстер.
6. Вкажіть твердження щодо жирів: а) є естерами гліцерину та вищих карбонових кислот; б) складається з амінокислот; в) до складу рідких жирів входять ненасичені вищі карбонові кислоти; г) при гідролізі розщеплюються з утворенням гліцерину та вищих карбонових кислот.
Завдання на встановлення правильної послідовності (1б )
7. Установіть послідовність утворення продуктів гідролізу крохмалю: а) глюкоза; б) декстрин; в) мальтоза.
Завдання на встановлення відповідності ( 1 б )
8. Встановіть відповідність між формулами полімерів та їх назвами.
А) (- СН2 – СН2 -)п 1. тефлон
б) ( - СН2 – СНСl)п 2. поліпропілен
в) ( СН2 – СН(СН3))п 3. поліетилен
г) ( - СF2 – CF2) п 4. полівінілхлорид
Завдання відкритої форми ( 2 б )
9. Поясніть, у результаті яких процесів змінюються властивості каучуку при вулканізації.
10. Укажіть переваги і недоліки використання синтетичних волокон.
11. Визначте масу продукту гідролізу сахарози, якщо реагує 54 г води.
ІІ варіант
Завдання з вибором однієї правильної відповіді ( 0,5 б )
1. Вкажіть сполуку, полімеризацією якої одержують тефлон: а) етилен; б) хлорвініл; в) тетрафлуоретилен; г) пропілен.
2. Виберіть продукт полімеризації етилену, який має технічне значення: а) пластмаса; б) волокно; в) гума; г) каучук.
3. Вкажіть продукт гідрування триолеїну: а) гліцерин; б) трипальмітин; в) тристеарин; г) олеїнова кислота.
4. Вкажіть вуглевод, який належить до дисахаридів: а) глюкоза; б) сахароза; в) целюлоза; г) фруктоза.
Завдання з вибором кількох правильних відповідей ( 1 б )
5. Капрон – це волокно: а) штучне; б) синтетичне; в) природне; г) поліамідне.
6. Вкажіть насичені вищі карбонові кислоти: а) стеаринова; б) пальмітинова; в) олеїнова; г) лінолева.
Завдання на встановлення правильної послідовності ( 1 б )
7. Установіть послідовність синтезу білків тваринними організмами: а) денатурація білків їжі; б) синтез поліпептидної молекули; в) утворення третинної структури; г) гідроліз поліпептидних молекул.
Завдання на встановлення відповідності ( 1 б )
8. Установіть відповідність між назвами та молекулярними формулами вуглеводнів.
А) фруктоза 1. С6Н12О6
б) сахароза 2. С5Н10О4
в) целюлоза 3. (С6Н10О5)п
4. С12Н22О11
Завдання відкритої форми ( 2 б )
9. Поясніть взаємозв’язок між будовою та властивостями каучуку.
10. Укажіть переваги і недоліки використання природних волокон.
11. Визначте масу продукту гідролізу целюлози, якщо реагує 27 г води.
Урок № 25
Тема: Поняття про синтетичні лікарські засоби (на прикладі аспірину)
Мета: розширити уявлення учнів про природні джерела органічних речовин, природні і синтетичні органічні сполуки, значення органічного синтезу для створення нових лікарських засобів; розвивати вміння аналізувати та пояснювати роль синтетичних лікарських препаратів; усвідомлення лікувального та руйнівного впливу ліків на ЦНС; виховувати бережливе ставлення до власного здоров’я
Обладнання:портрети Дж. Вейна, П. Ерліха, Ф. Гофмана.
Тип уроку: комбінований
Базові поняття: синтетичні лікарські засоби, аспірин, сальварсан, скринінг, біотехнології, нанотехнології.
ХІД УРОКУ
І. Організацій момент
ІІ. Актуалізація опорних знань
Запитання до учнів:
Уявіть собі , що ви захворіли , у вас з’явився нежить, підвищилися температура тіла . Які будуть ваші дії ?
ІІІ. Мотивація навчальної діяльності
Сьогодні ми не уявляємо нашого життя без синтетичних лікарських засобів так як вони допомагають нам справитися з хворобою швидше і ефективніше, ніж методи народної медицини. Але невиправдане вживання синтетичних лікарських засобів може негативно впливати на організм людини. Сьогодні ми маємо зважити всі «за» і «проти».
ІV. Вивчення нового матеріалу
Лекція
1. Синтетичні лікарські засоби – одне з найважливіших досягнень синтетичної органічної хімії. Завдяки їм стало можливим виліковування багатьох недугів, які раніше були фатальними для хворих. 1865 року англійський хірург Джозеф Лістер уперше використав під час операції карболову кислоту ( фенол ) для дезінфекції інструментів і рук хірурга. Це істотно зменшило смертність поміж хірургічних хворих, оскільки запобігало бактеріальним інфекціям. Така лікарська новація врятувала мільйони людських життів.
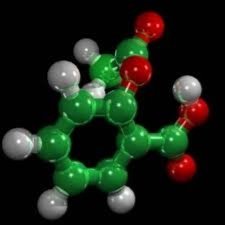 2. Аспірин – загально прийнята назва ацетилсаліцилової кислоти – найпоширенішого болезаспокійливого, жарознижувального і протизапального засобу. Ще в давнину для лікування інфекційних хвороб і подагри, для полегшення болю і зниження температури використовували різноманітні екстракти вербової кори.
2. Аспірин – загально прийнята назва ацетилсаліцилової кислоти – найпоширенішого болезаспокійливого, жарознижувального і протизапального засобу. Ще в давнину для лікування інфекційних хвороб і подагри, для полегшення болю і зниження температури використовували різноманітні екстракти вербової кори.
Науковці встановили, що активним лікувальним компонентом цих трунків є саліцилова кислота. Згодом було розроблено метод її синтезу, тож у медицині широко почали використовувати сіль саліцилової кислоти – натрій саліцилат. Однак обидві сполуки були досить токсичними, що спонукало дослідників до пошуку способу синтезу речовини, яка справляла б такий самий ( або сильніший ) терапевтичний ефект з меншою шкодою для організму.
1893 р. співробітник німецької терапевтичної фірми «Байєр» Фелікс Гофман синтезував ацетилсаліцилову кислоту. Доступність сировини і методики синтезу забезпечили можливість промислового виробництва ліків, що були запатентовані під назвою «аспірин». Тобто вперше було запроваджено технологію масового промислового виробництва синтетичного лікарського засобу.
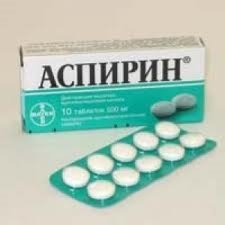 Ці ліки відразу набули неабиякої популярності й зберегли її по сьогодні. Обсяг їхнього виробництва за рік сягає десятків тисяч тонн. Аспірин має яскраво виражені протизапальну, жарознижувальну й певну знеболювальну дії. Однак цим не вичерпується його вплив на організм, оскільки дослідження виявляють нові грані біологічної активності і перспективні напрями використання ацетилсаліцилової кислоти.
Ці ліки відразу набули неабиякої популярності й зберегли її по сьогодні. Обсяг їхнього виробництва за рік сягає десятків тисяч тонн. Аспірин має яскраво виражені протизапальну, жарознижувальну й певну знеболювальну дії. Однак цим не вичерпується його вплив на організм, оскільки дослідження виявляють нові грані біологічної активності і перспективні напрями використання ацетилсаліцилової кислоти.
1982р. англійський фармаколог сер Джон Вейн був удостоєний Нобелівської премії з медицини за розгадку механізму фізіологічної дії аспірину.
3. Лікування хвороб із застосуванням синтетичних хімічних препаратів , що мали спрямовану бактерицидну дію, започаткував німецький лікар, бактеріолог і біохімік Пауль Ерліх. Створений ним препарат сальварсан виявляє високу ефективність проти збудників не лише сифілісу, а й інших небезпечних хвороб. Так само, як і аспірин, цей лікарський засіб увійшов до «першої десятки» борців з недугами.
«Робоча» назва сальварсану «препарат 606» означає, що П.Ерліх і його співробітники синтезували 605 речовин. Однак лише 606 спроба виявилася вдалою – добута речовина згубно діяла на збудника хвороби – бліду спірохету. Це приклад пошуку нових біологічно активних речовин методом фармакологічного скринінгу (просіювання).
Попри великі витрати часу і праці, метод скринінгу дотепер не втратив свого значення. Однак більш перспективним є цілеспрямований органічний синтез. Це наочний приклад того, як розуміння зв’язку складу і будови речовин з їхніми властивостями і біологічною активністю стає підґрунтям для створення сполук із наперед заданими властивостями та ефективних ліків на їх основі.
Важливого значення у виробництві сучасних лікарських засобів набули біотехнології як промислові методи одержання біологічно активних речовин. Нанотехнології – перспективний напрям не лише синтезу біологічно активних сполук, а й їхнього прицільного доправляння до хворого органа.
4. Недоліки синтетичних лікарських засобів. Список синтетичних лікарських засобів практично невичерпний. Сульфаніламідні препарати і антибіотики як специфічного, так і широкого спектра дії, знеболювальні, судинорозширювальні, проти судомні … Корисні чи шкідливі вони ?
На прикладі аспірину легко пересвідчитися: ацетилсаліцилова кислота попри беззаперечну лікувальну дію може спричинити в організмі низку небажаних, шкідливих змін. Тож нагальним завданням хіміків є синтез сполук, що не поступаються аспірину за лікувальним ефектом, однак позбавленні притаманних йому недоліків. Перші кроки в цьому напрямі вже зроблено. Врахування особливостей білка-ферменту , на який впливає аспірин, стало підґрунтям для синтезу ліків нового покоління.
V. Узагальнення і систематизація знань
Робота з підручником.
Доповнення конспекту лекції та систематизація нового матеріалу у формі схем, таблиць
VІ. Домашнє завдання
§17, № 1-4 (середній рівень), № 6 (достатній і високий рівні)
VІІ. Підведення підсумків уроку
Додатки
Корисні й нейтральні добавки
- Е101 — рибофлавін (вітамін B2).
- E140 — хлорофіл (безпечна речовина, що надає рослинам зеленого кольору).
- Е152 — вугілля (всім відома корисна копалина, абсолютно нешкідлива).
- Е160a — каротини (речовини, що близькі за властивостями до вітаміну А).
- Е161b — лютеїн (вітаміноподібна речовина, що сприяє поліпшенню зору, використовується в ліках).
- E163 — антоціани (рослинні пігменти, що надають забарвлення листкам і пелюсткам квітів).
- E181 — таніни (група речовин, аналогічних до компоненту чаю, що надають йому терпкого смаку).
- E202 — калій сорбат (один із найбільш популярних консервантів, абсолютно нешкідливий).
- Е260 — оцтова (етанова) кислота (нешкідливий компонент натурального походження).
- E296 — яблучна кислота.
- Е270 — молочна кислота (природна речовина, що утворюється при молочнокислому бродінні.
- E290 — карбон(IV) оксид (вуглекислий газ, що перетворює напій у газування).
- Е300 — аскорбінова кислота (вітамін C).
- E306-E309 — токофероли (вітаміни Е різних форм).
- Е406 — агар-агар (натуральний і нешкідливий).
- Е440 — пектини містяться у всіх наземних рослинах (особливо багато в яблуках).
- Е500 —натрій гідрокарбонат (харчова сода).
- Е507 — хлоридна кислота (аналогічна речовина виробляється в шлунку).
- Е641 — L-лейцин (одна з корисних амінокислот).
- Е642 — лізин (корисна амінокислота).
- Е-916, Е917 — кальцій йодид (збагачує продукти харчування корисним для здоров’я йодом).
Небезпечні добавки, дозволені в Україні
- E102 — тартразин (може спричиняти приступ астми, заборонений у ряді країн).
- E110 — агент жовтого кольору (може спричиняти алергію, нудоту, заборонений у ряді країн).
- Е122 — азорубін, кармуазин (може спричиняти алергію, заборонений у ряді країн).
- E123 — амарант (спричиняє вади розвитку плода, заборонений у ряді країн).
- Е124 — канцероген (провокує приступи астми, заборонений у ряді країн).
- Е127 — еритрозин (може спричиняти гіперактивність щитовидної залози, заборонений у ряді країн).
- E129 — агент червоного кольору (канцероген, заборонений у ряді країн).
- Е132 — індигокармін (може спричиняти нудоту, підвищення тиску, алергію, заборонений у Норвегії).
- E200 — сорбінова кислота (може спричиняти шкірні реакції).
- E210 — бензойна кислота (потенційний канцероген, може провокувати приступи астми).
- Е211 — натрій бензоат (потенційний канцероген).
- Е216–E217 — солі бензойної кислоти (канцерогени).
- Е220 — сульфур(IV) оксид (спричиняє роздратування кишечника, 1/4 усіх людей погано переносять Сульфур).
- Е221 — натрій сульфіт (руйнує вітаміни B1 (тіамін) і H (біотин), може провокувати приступи астми й ниркову недостатність).
- E235 — пімарицин, натаміцин (може спричиняти алергію, нудоту, понос).
- E249 — калій нітрит (можливо, канцероген, заборонений у дитячому харчуванні).
- Е250 — натрій нітрит (можливо, канцероген).
- Е251 — натрій нітрат (в організмі перетворюється на канцероген).
- Е322 — лецитини (в добавках частіше використовують потенційно небезпечний, генетично модифікований лецитин із трансгенної сої).
- Е450 — пірофосфати (надмірне вживання загрожує остеопорозом (розпушення кістки) і появою каменів у нирках).
- Е512 — станум(II) хлорид (спричиняє блювоту, міститься в консервах).
- Е621 — натрій глютамат (якщо перевищити норму (висипати в чашку з локшиною кілька пакетиків), можна отруїтися).
- Е622 — калій глутамат (найпоширеніша «фастфудна» добавка, при переїданні спричиняє нудоту, пронос).
- Е926 — хлор(II) оксид (канцероген).
- Е951 — аспартам (може спричиняти мігрень, висипання на шкірі й погіршувати мозкову діяльність).
- Е952 — цикламова кислота та її солі (заборонена в США й Великобританії, уважається канцерогеном).
Харчові добавки, дозволені для використання в Україні
(зі списку, що затверджений спеціальною Постановою Кабінету Міністрів України)
|
Е152 |
вугілля |
|
Е160а |
каротини |
|
Е160з |
екстракт паприки |
|
Е162 |
червоний буряковий бетанін |
|
Е164 |
шафран |
|
Е260 |
оцтова (етанова) кислота |
|
Е296 |
яблучна кислота |
|
Е406 |
агар |
|
Е420 |
сорбіт і сорбітовий сироп |
|
Е440 |
пектини, желатин |
|
Е422 |
гліцерол |
|
Е460 |
целюлоза |
|
Е637 |
ефірні масла спиртові, водно-спиртові, аромат копчення, ванілін |
|
Е901 |
віск бджолиний (білий і жовтий) |
|
Е902 |
віск свічковий |
|
Е905c |
парафін |
|
Е908 |
віск рисових висівок |
|
Е1510 |
спирт етиловий |
|
Е1420 |
крохмаль ацетиленований |
Урок 26
Тема: Шкідливий вплив вживання алкоголю, наркотичних речовин, тютюнокуріння на організм людини.
Мета: Поглибити знання учнів про хімічну природу шкідливих речовин у складі алкогольних напоїв, тютюну, наркотичних засобів; розвивати вміння висловлювати судження щодо згубної дії алкоголю, тютюну, наркотиків на здоров'я людини; виховувати вміння берегти своє здоров'я.
Обладнання: Таблиці: «Кулестержнева модель молекули нікотину», «Морфін, героїн, мет-енкефалін».
Тип уроку: Засвоєння нових знань.
Базові поняття і терміни: Морфін, героїн, мет-енкефалін, нікотин, опіати, гашиш, галюциногени, стимулятори, токсини.
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання, актуалізація опорних знань
Фронтальна бесіда
- Що таке синтетичні лікарські засоби?
- В чому їх переваги і недоліки? Назвіть їх.
- Які ви знаєте шкідливі речовини у складі алкогольних напоїв, тютюну, наркотичних засобів? Назвіть їх.
- Чим вони небезпечні для здоров'я?
ІІІ. Мотивація навчальної діяльності, повідомлення теми, мети уроку
Найвразливіша група населення – це діти. Дорослішаючи вони все більше відчувають на собі всі труднощі життя. Через незавершеність процесу становлення психічного статусу вони безпомічні, довірливі, фізично слабкі перед проблемами. На думку експертів очікується наростання питомої ваги важких форм психічних розладів у дітей-підлітків, причина яких у зловживанні біологічними, лікарськими, хімічними речовинами, не внесеними у список наркотиків, що приводить до токсикоманії.
ІV. Вивчення нового матеріалу
1. Шкідливі звички, що загрожують життю і здоров'ю людини.
Робота зі схемою
|
Шкідливі звички |
![]()
![]()
![]()
![]()
|
Паління |
|
Вживання наркотиків |
|
Вживання токсичних речовин |
|
Вживання алкоголю |
2.Хімічна природа шкідливих речовин і їх вплив на організм людини.
Наркотичні речовини – група сполук різної хімічної природи, що спричиняють стимулюючий, пригнічувальний або галюциногенний вплив на центральну нервову систему, у наслідок чого завдають шкоди організму (спричиняють патологічну залежність від наркотиків).
Опіати - наркотичні алкалоїди опіуму, природним джерелом якого є молочний сік опійного маку. Це передусім, природні сполуки морфін і кодеїн.
Героїн – напівсентитична похідна морфіну. Його добувають ацилуванням опію.
Повідомлення учнів про вплив цих речовин на організм (випереджувальне завдання)
Алкоголь – легальний наркотик, що шкодить здоров'ю людей. Етанол – природна діюча речовина алкогольних напоїв, у наслідок вживання яких змінюється фізичний і психічний стан людини.
Повідомлення учнів про вплив алкоголю на організм (випереджувальне завдання)
Нікотин – легальний небезпечний наркотик, який спричиняє стійку патологічну залежність. Потрапляє до організму курців і людей навколо них разом з тютюновим димом, що містить близько 5 тисяч шкідливих речовин.
Повідомлення учнів про вплив речовин, що містяться в тютюновому диму на організм (випереджувальне завдання)
Самостійна робота з підручником, с 117
Як виявити хімічним шляхом нікотин у тютюновому диму?
Токсичні речовини – леткі речовини, що входять до засобів побутової хімії. Вони викликають сп’яніння, отруєння, запаморочення, слухові і зорові галюцинації. У разі вживання гинуть клітини печінки, порушення зсідання крові, руйнуються клітини головного мозку, розвивається енцефалопатія, пригнічуються функції нервової системи.
V. Узагальнення і систематизація знань
1)Учитель пропонує учням висловити свої думки щодо причин, які спонукають підлітків випробувати дію шкідливих речовин.
- Паління: бажання бути дорослим; за «компанію»; зняття стресу; приклад дорослих; конфлікти в родині.
- Алкоголізм: бажання бути дорослим; спадковість; зняття стресу; приклад дорослих; конфлікти в родині; слабка сила волі.
- Наркоманія, токсикоманія: стрес, цікавість, наслідування товаришів, слабка сила волі, бездіяльність, безвихідність, відсутність порозуміння з боку батьків.
2)Формування висновків.
Г.Гейне писав, що єдина краса людини, відома йому, - це здоров’я. Як зберегти його на довгі роки? Висновок простий: щоб бути енергійним, творчо активним, не вкорочувати власне життя, необхідно з молоду шанувати своє здоров’я. Ні в якому разі не піддаватися шкідливим звичкам. Пам’ятати, що людина – сама творець свого здоров’я!
VІ.Домашнє завдання
§18. Здійсніть самоконтроль с.120
VІІ. Підсумок уроку
Урок 27
Тема: Органічні сполуки в побуті.
Мета: Розширити уявлення про природні й синтетичні органічні сполуки в побуті, значення органічного синтезу для створення нових речовин. розвивати логічне мислення, пізнавальний інтерес у дітей; виховувати самостійність, спостережливість, сприяти екологічному вихованню.
Обладнання: Опорна схема: «Класифікація хімічних речовин», органічні сполуки.
Тип уроку: Засвоєння нових знань.
Базові поняття і терміни: Побуті природні речовини, « століття хімії», «століття синтетики».
ХІД УРОКУ
І. Організаційний момент
ІІ. Мотивація навчальної діяльності, повідомлення теми, мети уроку
Подібно до того, як буває хвороба тіла,
буває також хвороба способу життя.
Демокріт
ІІІ. Вивчення нового матеріалу
- Природні і синтетичні органічні сполуки у повсякденному житті.
Розповідь вчителя
Із найдавніших часів люди турбувалися про своє житло, одяг, посуд і навіть прикраси. Упродовж 7-10 тисячоліть, починаючи з неоліту, люди використовували в побуті природні речовини: жири, віск, смоли, бальзами, ефірні масла, природні барвники. Скіфські жінки натирали тіло пастою із води, ладану і витяжки кедра і кипарису. Як розчинник використовували оливкову олію на Сході. Стародавні римляни натирали столи, стіни м᾽ятою задля приємного запаху. Для того, щоб уникнути інфекційних хвороб спалювали кедр. Смолою і бджолиним воском змащували човни і кораблі. Уже в ХV ст. до н. е єгиптяни застосовували тваринний і борошняний клей. Ще в давнину навчились обробляти шкіру, використовуючи дубильні речовини рослинного походження. Греки, римляни, єгиптяни відбілювали тканину з допомогою сонячних променів, сичу тварин протягом багатьох століть використовували для прання. В VІ ст. до н. е фінікійці навчилися варити із тваринного жиру і деревного попелу мило. Французький король Людовік ХІV започаткував виробництво туалетного мила.
Наприкінці ХІІ ст. стали відомі синтетичні миючі засоби. У другій половині ХХ ст. починають використовувати сучасні мийні засоби, збільшивши випуск товарів побутової хімії. Такі образні характеристики нашого часу, як « століття хімії», «століття синтетики», науково свідчать про те, що хімія широко використовується в найрізноманітніших сферах людської діяльності, в тому числі й у побуті людей.
2. Класифікація хімічних речовин:
а) побутові хімічні речовини (миючі, пральні, дезинфікуючі, засоби для прибирання та ін.);
б) хімічні речовини спеціального призначення (будівельні, добрива та підкорми, отрутохімікати та ін.).
3.Екологічно безпечні речовини для використання у повсякденному житті.
Усвідомивши небезпеку забруднення навколишнього середовища хімічними сполуками, які постійно виділяються в нього, не властивими природі або не характерними для неї в таких кількостях , для виконання багатьох домашніх робіт замість препаратів побутової хімії можна використовувати нешкідливі продукти та речовини, які як правило, наявні вдома.
Лимонний сік можна використовувати для видалення плям іржі з посуду, а також полірування столового срібла. Лимонний сік може використовуватися при митті скла й видалення плям з алюмінію, одягу й порцеляни, може відбілювати під впливом сонячного світла.
Лимонна кислота використовується для видалення накипу у електрочайниках та пральних машинах. До речі, один з найдешевших засобів для видалення накипу складається практично на сто відсотків з лимонної кислоти.
Оцет ефективно видаляє воскові плями й плями від усіляких смол, добре дезінфікує (чистий оцет можна використовувати для обробки туалету), очищає плитку, кахель (тільки потім як слід провітрити приміщення), видаляє накип (налийте в чайник разом з водою небагато оцту). Крім того, з оцту можна приготувати ефективну й безпечну "рідину для миття скла", яка прекрасно чистить і не залишає розводів. Для цього потрібно лише розбавити дві чайні ложки оцту в 1 л води. За допомогою оцту можна також чистити цеглу й камінь. Останнім часом на ринку з'являється багата кількість засобів з оцтом і, як правило, оцту не шкодують. До речі, концентрована (льодова) оцтова кислота сильний подразнювач слизових оболонок і може викликати подразнення і опік, потрапивши на шкіру. Тоді дійсно краще виготовити засіб у домашніх умовах з харчового 3-5% оцту і додати його „на свій смак”.
Натуральні природні олії та есенції (лимон,евкаліпт, ялина, апельсин, лаванда). Для того, щоб освіжити повітря в приміщенні, можна використовувати спеціальні ароматичні лампи, які включають максимум на 20 хвилин, закапав туди попередньо лише трохи ароматичної есенції. Мені цікавіше різні хитрощі аромотерапії, коли, наприклад, на газовий пальник або електронагрівач кидають декілька кристаликів ванілі чи чорного перцю.
Майцена (кукурудзяний крохмаль) може використовуватися для чищення вікон, полірування меблів, чищення килимів.
Звичайне господарське мило на 100% натуральне, що повністю органічно переробляється (тому що складається із природних жирів), яке, до того ж, ще й очищує, видаляє бактерії, миє... Бактерицидна дія господарського мила в декілька разів більша за туалетне мило.
Соняшникова олія. Існують домашні рецепти засобів догляду за меблями. Для цього змішують рафіновану олію зі звичайним етиловим спиртом. Таким засобом можна видалити білі плями, що залишають на полірованій поверхні гарячі чашки з чаєм.
Масло доволі успішно виводить чорнильні плями. Тільки потім треба не забути негайно видалити пляму від самого масла за допомогою теплої води та звичайного мила.
ІV. Узагальнення і систематизація знань
Бесіда
- Вам потрібно видалити різні плями з одягу: від іржі, вершкового масла, іоду, соняшникової олії, м᾽ясного соусу. У вашому розпорядженні є: пральний порошок, порошок крейди, бензин, лимонна кислота, паперові серветки. Підберіть засоби виведення для кожної плями. (Іржа – лимонна кислота, вершкове масло – бензин або порошок крейди, м᾽ясний соус – пральний біоактивний порошок, іод – бензин).
2.Який об᾽єм оцтової есенції густиною 1,070 г/мл потрібно взяти для приготування столового оцту об᾽ємом 200мл і густиною 1,007г/мл? Асова частка оцтової кислоти в есенції дорівнює 80%; в оцті – 6%
Розв'язання:
Дано:
![]() (есенції) = 1,070 г/мл m (розч.) = V (розч.)
(есенції) = 1,070 г/мл m (розч.) = V (розч.)
(оцту) = 1,007 г/мл 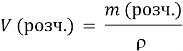
V (оцту) = 200 мл m (реч.) = (реч.) m (розч.)
1 (CH3COOH) = 80% m (розч.) = 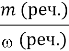
2 (CH3COOH) = 6%
![]()
V(есенції) - ?
- Визначаємо масу оцту, який потрібно приготувати:
m (оцту) = 1,007 г/мл 200 мл = 201,4 г
- Обчислюємо масу оцтової кислоти, яка міститься в оцті:
m (CH3COOH) = 0,06 201,4 г = 12,1 г
- Визначаємо масу есенції, яка містить 12,1 г оцтової кислоти:
m(есенції) = ![]() = 15,1 г
= 15,1 г
-
Знаходимо об᾽єм оцтової есенції: V(есенції) =
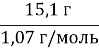 = 14,1 мл
= 14,1 мл
Відповідь: потрібно 14,1 мл есенції
V. Домашнє завдання
У вас виникла підозра, що бензин розведений водою. Чи можна за допомогою негашеного вапна перевірити наявність води в бензині? Чи будуть потрібні для цього ще які-небуть реактиви? (Якщо бензин містить воду то при додавання до нього негашеного вапна утвориться розчин з лужною реакцією. Це легко виявити за допомогою універсального індикаторного паперу, лакмусу чи фенолфталеїн).
VІ. Підсумок уроку
Урок 28
Тема: Поняття про побутові хімікати.
Мета:Розширити знання учнів про товари побутової хімії і їх значення в побуті; розвивати вміння використовувати теоретичні знання для безпечного й ефективного використання побутових хімікатів; виховувати самостійність, допитливість, бережливе ставлення до природи.
Обладнання: малюнки товарів побутової хімії, схема «Призначення товарів побутової хімії.»
Тип уроку: Засвоєння знань, умінь, навичок.
Базові поняття і терміни: Побутові хімікати, токсичні, їдкі, дезінфікування.
ХІД УРОК
І. Організаційний момент
ІІ. Актуалізація опорних знань, перевірка домашнього завдання
Бесіда
- Чи трапляються органічні речовини у складі побутових хімікатів?
- Чи безпечні вони для здоров'я людини і довкілля?
ІІІ. Мотивація навчальної діяльності
Повідомлення теми, мети уроку
ІV. Вивчення нового матеріалу
1.Побутові хімікати широко використовують у домашньому господарстві. Найрізноманітніші форми (розчини, гелі, порошки, пасти, креми, піни, суспензії, емульсії, гранули, таблетки, олівці, стікери, аерозолі)
2Класифікація товарів побутової хімії.
Товари побутової хімії зазвичай класифікують за призначенням.
Робота зі схемою, с.122.
Поміж них часто трапляються токсичні, їдкі, шкідливі для здоров'я сполуки.
V. Узагальнення і систематизація знань
Безпечне й ефективне використання побутових хімікатів можливе лише за дотримання певних норм, нехтування якими неприпустимі. До небезпечних хімічних речовин належать речовини, які при контакті з людиною можуть спричинити різні ушкодження.
Колективна робота (поясніть це, залучивши знання з основ здоров'я і власний повсякденний досвід).
- Леткі речовини не можна нагрівати.
- З їдкими речовинами можна працювати, тільки використовуючи захисні засоби.
- Отруйні речовини можуть викликати отруєння організму.
- Займисті речовини не можна зберігати поблизу вогню.
VІ. Домашнє завдання
§ 19 с. 121-122
VІІ. Підсумок уроку
Урок 29
Тема: Загальні способи поводження з побутовими хімікатами. Лабораторний дослід №8. Ознайомлення зі змістом інструкцій до товарів побутової хімії.
Мета: Ознайомити учнів з правилами поводження з побутовими хімікатами; розвивати навички виконання лабораторних дослідів, вміння використовувати теоретичні знання про вплив продуктів побутової хімії на довкілля; виховувати бережливе ставлення до навколишнього середовища.
Обладнання: Таблиці: «Знаки екологічного маркування різних країн світу», «Фізико-хімічні та токсичні властивості хімікатів», «Типові піктограми на етикетках товарів побутової хімії та їхнє тлумачення».
Тип уроку: Комбінований
Базові поняття і терміни: Пілінг, піктограми, канцерогени, екомаркування, екосимвол.
ХІД УРОКУ
І. Організаційний момент
ІІ. Актуалізація опорних знань, перевірка домашнього завдання
Бесіда
- За якими критеріями можна класифікувати засоби побутової хімії?
- Як правильно використовувати засоби побутової хімії?
ІІІ. Мотивація навчальної діяльності, повідомлення теми, мети уроку
Розповідь вчителя
Щорічно десятки тисяч отруєнь, у тому числі з летальним результатом, пов’язані з препаратами побутової хімії. Це свідчить не тільки про серйозні недоліки в рецептурі препаратів, а й слабке інформування населення про небезпечні властивості засобів побутової хімії. Тому слід звертати увагу на правила використання препаратів побутової хімії. У разі порушення цих правил можливі не тільки важкі отруєння, але й хімічні ураження шкіри, слизових оболонок. До того ж препарати побутової хімії, як правило, після використання погано розкладаються й забруднюють навколишнє середовище.
ІV. Вивчення нового матеріалу
1.Правила поводження з побутовими хімікатами.
Робота з підручником, с. 122. Колективне обговорення
2.Шкідливі речовини у складі побутових хімікатів.
Фенол – отруйна речовина, що трапляється в буденному житті (меблі), в сучасній косметології глибокий пілінг.
Формальдегід зумовлює хронічне отруєння людей.
Демонстрація
«Інструктаж з БЖД»
У дві пробірки наливаємо розчин білка об’ємом 1-2 мл кожна. У першу добавимо стільки само насиченого водного розчину фенолу, у другу – дрібку кристалічного натрій хлориду і етанол об’ємом 2 мл. В обох пробірках унаслідок денатурації білка випадає осад. Це свідчить про застосування фенолу і етанолу для дезінфекції.
3.Запобігання забруднення довкілля під час використання органічних речовин у побуті.
Найбільш небезпечними є такі речовини:
- канцерогени, що спричиняють ракові захворювання;
- мутагени, які зумовлюють зміни в генах, що призводить до різноманітних порушень функцій організму;
- репротоксиканти і тератогени порушують репродуктивні функції і внутрішньоутробний розвиток плоду.
4.Як мінімізувати ризики, пов’язані з використанням засобів побутової хімії?
а) маркування товарів побутової хімії;
б) надання переваги товарам безпечним для здоров’я і довкілля, на упаковках яких є екомаркування (екосимвол – це графічний символ, який наносять на етикетку, рекламу або упаковку продукту як спеціальну інформацію для споживача);
в) економне використання засобів для миття, чищення, прання;
г) сортування сміття і утилізація.
V. Узагальнення і систематизація знань
«Інструктаж з БЖД»
Лабораторний дослід №8. Ознайомлення зі змістом інструкцій до товарів побутової хімії.
Мета: навчитися аналізувати зміст інструкцій товарів побутової хімії.
Обладнання: Таблиці: «Знаки екологічного маркування різних країн світу», «Фізико-хімічні та токсичні властивості хімікатів», «Типові піктограми на етикетках товарів побутової хімії та їхнє тлумачення», етикетки товарів побутової хімії.
Хід роботи
1. Роздивіться етикетки побутової хімії. Яку інформацію вони містять?
2. Проаналізуйте зміст інструкцій з використання цих споживчих продуктів. Що в цих інструкціях ви вважаєте найважливішим? Чим зумовлені застереження наведенні в інструкціях?
3. Зробити висновок про доцільність наявності інструкцій на упаковках товарів побутової хімії .
VІ. Домашнє завдання
§ 19 с. 122-125, здійснити самоконтроль с.126.
VІІ. Підсумок уроку
Урок 30
Тема: Мило, його склад, мийна дія. Синтетичні мийні засоби. Лабораторний дослід №9. Порівняння властивостей мила і синтетичних мийних засобів.
Мета: Ознайомити учнів зі складом і властивостями мила, охарактеризувати синтетичні мийні засоби, їх склад, різноманітність і використання, порівняти мийні властивості мила й синтетичних мийних засобів, з᾽ясувати вимоги, яким повинні відповідати синтетичні мийні засоби з точки зору охорони навколишнього середовища; розвивати навички виконання лабораторних дослідів; виховувати бережливе ставлення до охорони довкілля.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, штатив з пробірками, господарське мило, синтетичний мийний засіб, дистильована вода, мідний дріт, піпетка, розчин кухонної солі.
Тип уроку: Комбінований.
Базові поняття і терміни: Жири, вищі карбонові кислоти (ВКК), синтетичні мийні засоби (СМЗ).
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
- Поясніть, що таке екологічне маркування продукції. Назвіть причини, що спонукають вас вибирати таку продукцію.
- Наведіть конкретні приклади форм побутових хімікатів.
- Проаналізуйте зміст етикеток та інструкцій товарів побутової хімії, що є у вашій оселі. Які з них містять небезпечні речовини? Які мають екологічне маркування?
ІІІ. Актуалізація опорних знань
Робота біля дошки.
Виші карбонові кислоти вступають в реакцію нейтралізації з лугами ( в розчині ). Напишіть можливі рівняння реакції.
С15Н31СООН + NаОН = С15Н31СООNа + Н2О
С17Н35СООН + КОН = С17Н35СООК + Н2О
ІV. Мотивація навчальної діяльності
Учитель повідомляє тему уроку та його мету, зазначає, що на цьому уроці учні дізнаються про особливості сучасних СМЗ. Отримають інформацію про вплив СМЗ на навколишнє середовище.
V. Вивчення нового матеріалу
Розповідь учителя
Мило виробляли вже із середніх віків. Традиційний процес миловаріння полягає в нагріванні жирів із лугом до утворення однорідної тягучої рідини. При добавлянні до неї насиченого розчину кухонної солі розчинність мила зменшується, воно виділяється з розчину і спливає на поверхню. Цей процес називається висолюванням. Мило збирають і заповнюють ним форми, де воно твердне. Інший спосіб виготовлення мила полягає в дії лугу або соди на жирні кислоти.
1.Склад і мийна дія мила.
Мила – солі утворені аніонами залишків вищих карбонових кислот і катіонами лужних елементів – Натрію і Калію.
Як і жири, мила можна класифікувати за агрегатним станом у звичайних умовах. Так, розрізняють тверді мила - натрієві солі ВКК, і рідкі - калійові. Їхні аніони містять від 10 до 20 атомів Карбону. (Якщо атомів Карбону в аніоні солі менше 10, то сполука не виявляє мийної дії, а якщо більше 20, то сіль практично нерозчинна в воді.) Відповідно формула мила: С17Н35СООNа – натрій стеарат, С17Н35СООК – калій стеарат. Склад мила зумовлює його властивості як поверхнево-активні речовини (ПАР, детергент). ПАР знижує поверхневий натяг і містить у своєму складі як гідрофільні, так і гідрофобні групи. Неполярна СпН2п+1 (гідрофобна) частина аніона контактує із жировою складовою забруднення, відштовхується від води, а полярна СООNа (гідрофільна) залишається у воді, сполучаючись з її молекулами водневими зв’язками. Усі ПАР сприяють швидкому змочуванню водою забруднених поверхонь, відокремленню від них часточок бруду і переходу їх у розчин.
Демонстрація З тонкого мідного дроту зробимо плоску спіраль, змастимо її олією, помістимо на поверхню води, спіраль не тоне. Піпеткою в середину спіралі помістимо краплю мильного розчину-почне обертатися, а розчину кухонної солі-руху не буде. Унаслідок добавляння розчину прального порошку-швидко тоне.
Робота з підручником. Учні знайомляться з мийною дією мила, с.129.
2.Синтетичні мийні засоби.
Нині мила все більше витісняються синтетичними мийними засобами (СМЗ), або детергентами, які значно ефективніші за мило. Використання мила має певні недоліки. Луг, який утворюється під час гідролізу, роз’їдає тканини, руйнує барвники. Мило втрачає свої властивості у твердій воді, бо йони Кальцію і Магнію, що містяться в ній, утворюють з аніонами жирних кислот малорозчинні солі. Основу СМЗ становлять поверхнево-активні речовини; у них є також різні добавки вибілювачі (хімічні, оптичні), ароматизатори, пом’якшувачі води, антистатики, дезінфікуючі речовини тощо. СМЗ здебільшого містять кілька поверхнево-активних речовин, які за властивостями доповнюють одна одну. Мийна ефективність більшості ПАР посилюється в лужному середовищі і за присутності різних електролітів. Із цієї причини майже в усі СМЗ добавляють неорганічні солі: сульфати, карбонати, полі фосфати. Вміст ПАР різних типів у цих засобах сягає в середньому 35% за масою.
3.Вплив синтетично мийних засобів на навколишнє середовище.
Надлишок сполук фосфору призводить до масового розвитку мікроскопічних водоростей, мікроорганізмів, бактерій, що сприяє заболоченню. Потрібен біологічний та хімічний розклад ПАР на безпечні речовини перед викидом стічних вод. У побуті та виробництві ощадливо використовувати мийні засоби, дотримуючись рекомендацій наведених в інструкції.
VІ. Узагальнення і систематизація знань
«Інструктаж з БЖД»
Лабораторний дослід №9. Порівняння властивостей мила і синтетичних мийних засобів.
Мета: навчитися виготовляти тверду воду, проводити розчинення мийних засобів, розвивати спостережливість, вміння порівнювати мийну здатність у твердій воді мила і СМЗ.
Обладнання: пробірки, мило, СМЗ, водопровідна вода, морська сіль, оцет, крейда.
Хід роботи.
1.Приготуйте тверду води.
2. Приготуйте мильний розчин і прального порошку.
3.У мильний розчин добавте твердої води і струсіть. Опишіть спостережувані зміни.
4. У розчин прального порошку добавте твердої води і струсіть. Опишіть спостережувані зміни.
5. Порівняйте мийну здатність у твердій воді мила і СМЗ.
VІІ. Домашнє завдання
§ 20. Підготувати презентацію «Як моя родина використовує мило і СМЗ».
VІІІ. Підсумок уроку
Урок 31
Тема: Органічні розчинники, їх застосування.
Мета: Ознайомити учнів зі складом і властивостями органічних розчинників, поглиблювати знання про застосування розчинників на виробництві й у побуті; розвивати логічне мислення, пізнавальний інтерес у дітей; виховувати самостійність, спостережливість.
Обладнання: Таблиця «Застосування органічних розчинників у техніці і побуті».
Тип уроку: Засвоєння знань, умінь, навичок.
Базові поняття і терміни: Денатурат, уайт-спірит, сольвент, скипидар, перхлоретилен, хімчистка.
ХІД УРОКУ
І. Організаційний момент
ІІ. Перевірка домашнього завдання
Учні презентують свої проекти «Як моя родина використовує мило і СМЗ».
ІІІ. Актуалізація опорних знань
Бесіда
- Які розчинники широко застосовують на виробництві у побуті, чи безпечні вони?
ІV. Мотивація навчальної діяльності
Повідомлення теми, мети уроку
V. Вивчення нового матеріалу
1. Органічні речовини – як розчинники.
Відомо дуже багато органічних сполук, які застосовуються як розчинники. До їхнього складу входять представники різних класів органічних сполук, з них найпоширенішими є: 1) вуглеводні – петролейний ефір, бензин, гас, бензол, толуол, ксилол, пропан і інші; 2) спирти – ізопропіловий, аміловий, метиловий, етиловий тощо; 3) аміни – диметиламін, етиламін, анілін; 4) кетони – ацетон, метилетилкетон тощо; 5) хлороорганічні сполуки – чотири хлорид вуглецю, дихлоретан, хлороформ та інші; 6) сполуки, що містять азот, - нітрометан, нітробензол тощо. Майже всі вони є отруйними.
Широко застосовують спирти як розчинники, сировину для штучного каучуку та смол, лікарських та вибухових речовин, парфюмерних виробів тощо.
Гліцерин. В медичній практиці звикло використовується гліцерин, що містить 12-16% води. Це прозора, безбарвна, без запаху в’язка рідина з солодкуватим смаком. Володіє вираженою розчинною здатністю по відношенню до значної кількості лікарських речовин
Етанол – розчинник, що застосовують для виготовлення парфумів, лікувальних екстрактів і настоянок, вибавляють плями від трави, фломастерів.
Спирт денатурований – рідина з неприємним запахом з добавлянням речовин і барвників, що використовують для вибавляння плям, виробництва лакофарбових матеріалів, знежирювання поверхонь.
Органічні розчинники використовують у виробництві пластмас, синтетичного каучуку, у лакофарбовій, фармацевтичній, текстильній, парфумерно-косметичній, медичній промисловості, у сільському господарстві, для хімічного чищення одягу (хімчистка).
- Органічні розчинники, що містять один або декілька компонентів.
Самостійна робота з підручником с. 133-135
Учні виписують у зошит розчинники, їх склад, одержання, застосування.
VІ. Узагальнення і систематизація знань
- Які представники класів органічних сполук входять до складу органічних розчинників?
- Наведіть приклади розчинників, що добувають фракційною перегонкою нафти.
VІІ. Домашнє завдання
§ 21. Підготувати презентацію «Як моя родина безпечно використовує органічні розчинники».
VІІІ. Підсумок уроку
Урок 32
Тема:Практична робота №1 «Видалення забруднень органічного походження з поверхні тканини».
Мета: ознайомитися зі способами усунення різних забруднень із поверхні тканини; навчитися видаляти різні плями;
продовжити формувати навички роботи з лабораторним обладнанням і хімічними реактивами, дотримуватись правил техніки безпеки;
виховувати бережливе ставлення до обладнання, реактивів та власного здоров’я.
Обладнання: колби плоскодонні з корками, скляні палички, шматочки пінопласту, розчини прального порошку (1%), лимонної кислоти (1%), нашатирний спирт (1%), бензин, порошок крейди, забруднені тканини (бавовняна ганчірка, якою витерли пил, ганчірка з плямами олії, яблучного соку), вата, фільтрувальний папір, порошок крейди, бензин.
Тип уроку: Урок комплексного застосування знань, практична робота.
Базові поняття: жири, мийна дія, СМЗ, розчинники.
ХІД УРОКУ
І. Організаційний етап
Учитель до початку уроку роздає необхідне обладнання й зошити для практичних робіт. Учитель по повідомляє тему уроку та план проведення практичної роботи, просить учнів пригадати основні правила поведінки в кабінеті хімії під час виконання практичних робіт.
Учні разом з вчителем формулюють мету уроку.
ІІ. Актуалізація опорних знань
Бесіда
- Порівняйте мило і СМЗ.
- Поясніть мийну дій СМЗ.
- На чому ґрунтується дія розчинників?
- З чим пов`язана токсична дія розчинників?
Перевірка домашнього завдання
У разі виникнення потреби вчителем надаються необхідні пояснення.
Інструктаж з БЖД
Розповідь учителя
Учитель нагадує учням основні правила техніки безпеки,
підкреслюючи, що: необхідно обережно поводитися із скляним посудом, реактиви не можна брати руками, з розчинами необхідно поводитися обережно й не допускати їх потрапляння в очі, на шкіру, одяг.
Інструктаж з проведення практичної роботи
Розповідь учителя
Учитель пояснює принципи оформлення результатів практичної роботи в зошитах.
Учитель розповідає про порядок проведення практичної роботи.
( Робота виконується згідно інструкції в зошиті для лабораторних дослідів та практичних робіт (рівень стандарту)).
ІІІ. Проведення практичної роботи
Тема. Видалення забруднень органічного походження з поверхні тканини.
Мета: ознайомитися зі способами усунення різних забруднень із поверхні тканини; навчитися видаляти різні плями.
Обладнання: колби плоскодонні з корками, скляні палички, шматочки пінопласту, розчини прального порошку (1%), лимонної кислоти (1%), нашатирний спирт (1%), бензин, порошок крейди, забруднені тканини (бавовняна ганчірка, якою витерли пил, ганчірка з плямами олії, яблучного соку), вата, фільтрувальний папір, порошок крейди, бензин.
Хід роботи
|
Послідовність дії |
Завдання, запитання |
Спостереження,відповіді |
|
Дослід 1. Видалення пилових і жирних забруднень за допомогою прання. У першу колбу налийте 100-150мл водопровідної води, а в другу – 1% розчин прального порошку. Помістіть у кожну колбу шматок забрудненої тканини і кілька шматків пінопласту.закрийте колби корками і струшуйте їх упродовж 5хв. Вийміть тканину з колб, промийте проточною водою і відіжміть. |
Розгляньте зразки і порівняйте їх зовнішній вигляд. Поясніть відмінність. Опишіть механізм мийної дії прального порошку. |
|
|
Дослід 2.видалення жирних плям. 1. Покладіть тканину на фільтрувальний папір. Змочіть жирну пляму на тканині нашатирним спиртом за допомогою ватного тампона, витримайте 3-4 хв і промийте холодною водою. Вижміть. |
Розгляньте зразок. Опишіть, що спостерігаєте. |
|
|
2.Покладыть тканину на фільтрувальний папір, нанесіть на пляму суміш порошку крейди з бензином (пастоподібну). Накрийте іншим листом фільтрувального паперу, покладіть вантаж і залиште до наступного уроку ( разі, коли пляма залишилася, обробку повторіть). |
Розгляньте зразок. Опишіть, що спостерігаєте.
|
|
|
Дослід 3. Видалення плями від фруктів. Покладіть тканину на фільтрувальний папір. Змочіть пляму від фруктів на тканині розчином лимонної кислоти за допомогою ватного тампона, витримайте 3-5хв і промийте теплою водою. Відіжміть. |
Розгляньте зразок. Опишіть, що спостерігаєте. |
|
Висновок.__________________________________________________________________________________________________
Учні виконують досліди. Учитель допомагає їм, демонструє в разі потреби прийоми поводження з лабораторним посудом. Після закінчення роботи учні повинні навести порядок на робочих місцях.
ІV. Домашнє завдання
Повторити §21.
V. Підбиття підсумків уроку
Бесіда
- Чи досягнуто мету роботи, яку учні ставили перед початком уроку? Яким чином?
- Які труднощі виникали у вас під час виконання практичної роботи?
- Які у вас склалися враження від роботи?
- Чи зробив хтось «особисті» відкриття?
- Як ви оцінюєте власну роботу?
Урок № 33
Урок – проект Попередження забруднення довкілля при використанні органічних речовин в побуті.
Тип проекту:
- за методом діяльності – інформаційний ( спрямований на збір інформації, її аналіз та узагальнення фактів);
- за видом діяльності – навчальний.
Термін виконання – тиждень.
Цілі:
- розвивати вміння систематизувати інформацію;
- розвивати вміння висловлювати своє ставлення до певної проблеми;
- формувати навички роботи над колективним проектом;
- виховувати любов до рідної землі;
- виховувати екологічне мислення.
Очікуваний результат проекту (кінцевий продукт): створено рекомендації « Правила екологічної поведінки в побуті» та підготовлено презентацію.
Учитель заздалегідь готує:
- Відео або слайди.
- Інформація з довідкової літератури.
План дій:
- Підготовчий етап – визначення мети проекту, обговорення проблеми;
- Планування:
- Вибір джерел інформації – шкільна бібліотека, мережа Інтернет, додаткова література, періодичні видання.
- Способи збирання інформації – робота з літературою, мережа інтернет.
- Систематизувати ідеї для проекту.
Очікуваний результат етапу: учні під керівництвом вчителя спланували проект та їхню презентацію,навчилися розподіляти обов’язки та розвинули вміння ефективно співпрацювати під час групової роботи.
- Основна робота за проектом та консультації вчителя
Учні збирають матеріали та інформацію для презентації. Вчитель заохочує учнів до роботи, дає індивідуальні поради щодо оформлення, допомагає у створенні презентації.
Очікуваний результат етапу: учні підготували необхідні матеріали для проекту.
- Оформлення звіту – узагальнення матеріалів, виготовлення стенду або слайдів у вигляді тез «Правила екологічної поведінки в побуті»
Очікуваний результат етапу: зібрані ідеї, учні навчилися систематизувати ідеї колективного інформаційного проекту.
- Презентація проекту.
Очікуваний результат етапу: учні презентували проект, отримали досвід публічного захисту своїх ідей.
-
Підбиття підсумків та оцінювання
- Обговорити результати роботи: що учням сподобалося під час виконання проекту, що можна було зробити краще, які виникли труднощі та як їх долали, плани на майбутнє.
- Учитель оцінює проект за критеріями:
|
Робота з проектом |
Макс. бал |
Оцінки учня |
|
Матеріали до проекту (схема ідей, план роботи групи, оцінювання) |
4 |
|
|
Письмові матеріали до плакату |
4 |
|
|
Підготовка та проведення презентації |
4 |
|
|
Заохочувальні бали |
1-2 |
|
"Сколько бы люди не отличались друг от друга, проблемы окружающей среды предъявляют им категорическое требование – сохранить пригодное для жизни и благоприятное состояние их общего дома – планеты Земля."
Б. Уорд, П. Дюбо
Хід уроку
Слово вчителя.
Будь-яка діяльність людини так чи інакше пов'язана із використанням або перетворенням природи. Діяльність людини в сфері домашнього господарства не є винятком.
Науково-технічний прогрес характеризується не тільки видатними досягненнями, але й виникненням цілого ряду проблем у зв’язку із забрудненням навколишнього середовища.
Використання хімічних речовин у побуті – далеко не винахід нашого часу. Є чимало відомостей про те, що ще задовго до нашої ери люди використовували хоч і недосконалі, але все ж досить ефективні хімічні речовини. Розвиток хімічної промисловості іде дедалі зростаючими темпами. і сучасна людина при повсякденному житті використовує речовини – продукти хімічної промисловості, які не характерні для живих організмів. Вони, включаючись у колообіг речовин у природі стають складовою живих організмів, в тому числі і людини. Наслідки такої діяльності людини не завжди позитивні, а при сьогоднішніх темпах появи нових речовин стають загрозливими. Чому? Ми спробуємо відповісти в кінці уроку.
Після вступного слова вчителя учні презентують свої проекти.
Група Дослідники.
Хімія в побуті.
В гробниці єгипетського фараона Тутанхамона археологи знайшли пахощі, яки зберегли аромат протягом тридцяти віків. Взагалі у далекому минулому хімічні речовини особливо часто використовувалися в культових обрядах і в косметиці. Під час релігійних церемоній в курильницях запалювали запашні суміші. Східні поети оспівували насурмлених красунь. Мумії єгипетських фараонів збереглися до наших днів, оскільки їхні тіла були гарно набальзамовані.
В стародавніх рукописах ми знаходимо згадування про масла і склади для полірування деревини і каміння, засоби для дезінфекції та консервування їжі.
З незапам’ятних часів відомі й складові малювальних фарб.
Починаючи з І століття до н.е. в культурних центрах Середземномор’я широке використання отримало мило. Чимало рецептів побутових хімічних препаратів існувало в той час в Індії, Китаї, країнах Середньої Азії та Закавказзя.
Широко використовувалися хімічні засоби в повсякденному житті в середні віки. Розвиток міст, ремесел, торгівельних зв’язків у чималій степені цьому сприяли.
Хімічні засоби з давніх часів використовувалися й на Русі. Особливо розвиненим було солеваріння, обробка і вичинювання шкір, переробка бджолиного воску.
З розвитком писемності з’являються й порадники з побутової хімії. Так, в одному зі старовинних російських лікарських порадників дається така порада: “Якщо хочеш, щоб тебе не їли комарі, то візьми хустку, змочи її дьогтем і поклади на голову, на шапку”. З давніх часів використовувався для прання луг, який виробляли з деревної золи; був розповсюджений і зберігся до наших часів спосіб відбілювання тканин шляхом попереднього замочування і вистилання їх на сонці.
Здавна люди навчились використовувати для чищення виробів із кольорових металів підручні засоби, причому деякі з них не втратили свого значення й досі. Наприклад, для чищення бронзи в різних країнах користувалися кислим молоком. На Русі для чищення самоварів використовували ягоди бузини, золу, крейду, капустяний розсіл.
Звісно, більшість таких рецептів, вдало й звичайно випадково винайдених, передавалося від батька до сина. Багато відкриттів трималося у суворому секреті, особливо це стосується робіт алхіміків. Цікаво, що один з перших патентів у світі мав пряме відношення до побутової хімії. Мова йде про англійський патент №4 від 1617 р., в якому пропонується новий спосіб захисту рицарських обладунків від іржі за допомогою покриття їх спеціальним маслом.
Більш пізні досягнення побутової хімії добре відомі і багато з них зберегли своє значення до наших днів. Безумовно, вони були пов’язані з успіхами хімії як науки, з виникненням можливості використовувати більш або менш чисті хімічні речовини або суміші таких речовин, використовувати хімічні продукти, які стала випускати промисловість в кінці ХVІІІ - на початку ХІХ сторіччя.
Група Статисти.
За даними Всесвітньої організації охорони здоров’я (ВОЗ) здоров’я населення на 50% залежить від способу життя, на 20% – від якості оточуючого середовища, ще на 20% – від спадкоємних особливостей організму і на 10% – від розвитку охорони здоров’я.
Діяльність людини, її життя на жаль майже постійно супроводжується дією різних небезпечних факторів. У світі застосовують майже 300 тис. різноманітних речовин, які використовують в різних галузях діяльності людини. Більшість з них несумісні з життям. Це – ксенобіотики (гр.. ксенос – чужий, біос – життя). Ксенобіотиками або чужорідними називають речовини, що надходять в організм з навколишнього середовища і не використовуються ним у якості джерел енергії, пластичних матеріалів чи каталізаторів. Вони можуть потрапити в організм з їжею, з напоями, через шкіру або з повітрям, під час дихання.
Небезпека впливу таких речовин на організм людини є результатом неграмотності, необізнаності, низького рівня культури – загальної, екологічної. Часто джерела небезпеки в довкіллі створюються самою людиною, коли через необережність, необачність, зухвалість, безвідповідальність людина сама створює небезпечні для життя умови.
Людина сама створила цілий клас хімічних сполук, що стійкі в навколишньому середовищі, здатні накопичуватися в природних об`єктах (водорості, рачки, риби), а потім потрапляти з їжею в організм, що в тисячі раз перевищують допустимі норми. До них належать засоби для миття, очищення, дезинфекції,полірування предметів, виведення із них плям, а також фарби, лаки, клеючі матеріали та ін., асортимент яких постійно зростає. Це також – продукти хлорування целюлози під час виготовлення паперу, органічні сполуки хлорування питної води, діоксиноподібні домішки у продуктах згоряння пластикового сміття. Чудові та корисні вогнетривкі рідини ( моторні масла, гідравліка) та електростійкі матеріали в конденсаторах насправді виявилися досить шкідливими «ендокринними руйнівниками», що зберігаються в грунтах і водоймах десятки років. Усі вони становлять потенціальну небезпеку для здоровя людини, особливо дітей. Такі речовини руйнують гормональну та імунну систему.
За статистикою у США отруєння і смертність дітей від токсичних хімічних речовин посідає друге місце, Польщі на побутові препарати припадає 28%, у Франції - 23% від усіх зареєстрованих отруєнь.
Вважають, що більше 90% пухлин у людини після 50 років мають метаболічне походження і викликані хімічним забрудненням організму.
В навколишнє середовище, отож і в організм людини, надходить величезна кількість штучно створених сполук.
У побуті ми практично щоденно зустрічаємося з продуктами хімічної промисловості та з хімічними процесами. Це прання білизни, миття посуду, доглядання за підлогою та меблями застосування клею, а також готування їжі, умивання з милом, догляд за шкірою обличчя та інша особиста гігієна тощо.
У побуті широкого застосування набули мийні засоби. Річ у тім, що чиста вода добре видаляє із забрудненої поверхні лише розчинні в ній речовини. Часточки нерозчинних речовин, але які змочуються водою (гідрофільні), можна видалити за рахунок механічного впливу. Якщо ж речовини не змочуються водою (гідрофобні) І до того ж мають підвищену в'язкість, то практично їх не можна видалити водою. Це стосується жирових забруднень, воску, стеарину, олії, різних органічних речовин, тощо. У таких випадках застосовується мило, а ще краще — синтетичні мийні засоби (СМЗ), що належать до групи поверхнево-активних речовин (ПАР). ПАР є в складі миючих засобів для посуду, СМЗ для прання, засобів для миття автомобілів.
Група Екологи.
Про поверхнево активні речовини.
Практично все населення планети контактує з ПАР, кількість яких у навколишньому середовищі зростає з кожним роком. Зовсім не випадково тарілка аж рипить після миття хімічним засобом. Вимиваючи бруд і жир, ті ж ПАР створюють на посуді стійку плівку, яку можна знищити також спеціальним хімічним розчином. Крім того значна частина засобу змивається в каналізаційні води і потрапляє у водний басейн. Інтенсивне використання синтетичних ПАР спричинює забруднення, які можна порівняти із забрудненням нафтою Світового Океану і пестицидами — ґрунту і води, тобто проблема запобігання забруднення навколишнього середовища детергентами має глобальний характер.
Крім синтетичних, відомі ПАР біологічної природи, які утворюються в живих організмах і приймають активну участь у їх функціонуванні. Визначення вмісту біоПАР, вивчення взаємодії людини і тварин з синтетичними і рослинними ПАР навколишнього середовища, має важливе теоретичне і практичне значення для сучасної гігієни, екологічної біохімії і фізіології.
ПАР здатна зменшувати поверхневий натяг води на межі поділу фаз і збільшувати змочування твердої поверхні.
Мила, потрапляючи в річку чи озеро, швидко розкладаються, тому що містять нерозгалужені вуглеводневі ланцюги, які руйнуються бактеріями. Розчини деяких синтетичних ПАР не руйнуються, оскільки містять алкілсульфати або алкіл(арил)сульфонати з розгалуженими або ароматичними вуглеводневими ланцюгами. Мікроорганізми не можуть засвоїти такі сполуки. Отже, при створенні нових ПАР необхідно враховувати не тільки їх ефективність, але й здатність до розщеплення мікроорганізмами .
На нашому ринку більшість мийних засобів містять натрій фосфат, який після застосування потрапляє безпосередньо у стічні води, ґрунт, річки та озера. Він накопичується, а потім починає діяти як добриво. Існує термін — «еутрофія», що в перекладі з давньогрецького означає «добре харчування», яке викликає бурхливе «цвітіння», а потім — неминуче «старіння» водойми. У місцях накопичення цієї шкідливої речовини на поверхні води спостерігається «урожай» синьо-зелених водоростей, які розмножуються надзвичайно швидко: один грам натрій фосфату стимулює утворення 5–10 кг водоростей! Населення України становить 47 млн. Якщо підрахувати, що на кожну людину витрачається в рік 5 кг мийних засобів, то протягом року у воду потрапляє 115 тисяч тонн натрій фосфату, що потенційно могло б забезпечити ріст одного трильйона водоростей! Від екологічної катастрофи країну врятує тільки недостатня для росту і розвитку водоростей кількість світла і тепла в осінньо-зимовий період. А як зміниться ситуація при глобальному потеплінні клімату? Перспективи можуть лякати.
Забруднення повітря.
Забруднення повітря речовинами, які використовуються в побуті, сприяє росту алергічних захворювань органів дихання. Дослідження проведені Вінницьким медичним інститутом показали, що понад 90% алергічних захворювань невідома медичним закладам. Серед населення відзначається загрозливе поширення медикаментозної алергії. Це пояснюється безконтрольним вживанням медикаментозних препаратів і їх попаданням в навколишнє середовище. На рівні сучасних знань алергічні захворювання є практично невиліковними
Група Хіміки.
Фізико-хімічні властивості поверхнево активних речовин.
ПАР — речовини, молекули яких із справжнього або колоїдного розчину здатні концентруватися на границі розподілу фаз.
Відомі на сьогоднішній день ПАР — дві великі групи сполук: біологічного походження та синтетичні. Перші утворюються в живих організмах, беруть участь у різних функціях клітини та організму в цілому. Це ліпіди, фосфоліпіди, жирні кислоти та їх солі, біологічно активні речовини. Ендогенні біологічні ПАР — ПАР травного каналу (жовч та її компоненти), шкіри, слизових оболонок, легень. Інші — синтетичні ПАР (детергенти) — група хімічних сполук, здатних вибірково адсорбуватися на межах розподілу фаз і знижувати поверхневий натяг рідин. При наявності такої речовини в розчині її молекули виходять на поверхню розчину або на поверхню будь-якого, зануреного у цей розчин, тіла. Поверхнева концентрація молекул ПАР стає на декілька порядків вищою, ніж концентрація їх в об’ємі .
Не дивлячись на методи очистки від ПАР: адсорбція, коагуляція, озонування, переведення ПАР у піну з подальшим її видаленням, значна кількість ПАР потрапляє у зовнішнє середовище. При проникненні ПАР у ґрунт не виключена ймовірність їх міграції у підземні і поверхневі води, транслокація в рослини, а також поступлення в організм тварин. Тому проблема вивчення можливої несприятливої дії ПАР на організм набуває особливої актуальності і має важливе значення для гігієнічної регламентації даного чинника в об’єктах навколишнього середовища
Група Біологи
Вплив поверхнево активних речовин на організм тварин і людини
Дослідження вмісту ПАР в організмі жуйних тварин показали, що: по-перше, значна кількість ПАР потрапляє в організм у складі кормів; по-друге, велика кількість ПАР синтезуються в організмі тварин; по-третє, мікрофлора кишківника чутлива до дії ПАР.
Встановлено, що найвищий вміст (мг/кг) ПАР характерний для спинного мозку, півкуль головного мозку, печінки і нирок. У шлунково-кишковому тракті найвищий рівень ПАР виявлено в слизовій оболонці. Велика кількість їх є в навколовушній залозі, слизових оболонках і слизових нашаруваннях тонкого і товстого відділів кишечнику. Органи і тканини з високим (головний і спинний мозок, наднирники) та середнім (печінка, нирки, селезінка, легені) вмістом фосфоліпідів мають, відповідно, високий та низький вміст ПАР. Слід враховувати й те, що більшість ліпідних компонентів, особливо мембранних структур, володіють значною поверхневою активністю, а найбільш досліджений поверхнево активний комплекс легень на 80 % складається з фосфоліпідів. Зокрема ПАР, які синтезуються в організмі, беруть участь у побудові мембран і в саморегуляції обмінних процесів, транспорті метаболітів. Змінюючи властивості біологічних мембран, їх електричний заряд і проникність, ПАР можуть впливати на функціональний стан залоз внутрішньої секреції (наднирники, підшлункова залоза).
При вивченні динаміки синтезу ліпідів встановлено, що ПАР посилюють синтез ліпідів у печінці. Підвищений вміст ПАР та їх метаболітів в організмі тварин порушує обмін ліпідів.
Окремі ПАР мають подразнювальні властивості. Шкідливий вплив ПАР залежить від виробничих, технологічних процесів, якості сировинних матеріалів. Деякі речовини викликають різко виражені дерматити, зміни у поведінці тварин. Відомо, що при контакті рук людини з водними розчинами деяких мийних засобів і детергентів спостерігається зниження кількості загальних ліпідів, амінокислот і зміна рН шкіри. Виявлена залежність між зниженням активності ферментів шкіри при дії ПАР і обезводненням шкіри.
Механізм сенсибілізуючої дії мийних препаратів на основі ПАР можна представити таким чином: детергенти взаємодіють з ліпідно-білковими мембранами клітин органів і тканин і викликають зміни структури і функції клітин. Вплив детергентів на морфологічну структуру мембрани супроводжується зміною її ферментативної активності. Змінений білок або комплекс «хімічна сполука — білок» сприймається імунною системою як чужорідний і проти нього виробляються антитіла.
Доведено, що тканини печінки затримують ПАР, які входять до складу синтетичних мийних засобів. СМЗ пригнічують жовчотворну функцію печінки. Дія мийних засобів на клітини печінки характеризується різким збільшенням проникності клітинних мембран, спричинюючи алергічний ефект дії ПАР.
ПАР змінюють електропровідність клітин слизової оболонки верхніх дихальних шляхів, а тим самим, і проникність мембран клітин. ПАР, які мають полярні групи, подібніші до ліпоїдних компонентів мембран. Надходження їх в організм тварин може впливати на серцево-судинну систему. ПАР у тварин знижують активність підшлункової залози і фільтрувальну здатність нирок, змінюють активність ферментів крові.
Швидке і значне надходження з кишечника у кров та органи, а також швидше виведення з них різних речовин під впливом ПАР, пояснюється підвищеною проникністю біологічних мембран.
ПАР — один із найпоширеніших чинників навколишнього середовища, які при взаємодії з іншими хімічними сполуками, впливають на його якісний стан і створюють загрозу порушення екологічної рівноваги у біосфері.
Про пестициди.
Засоби боротьби з побутовими комахами та гризунами, хімічні засоби захисту рослин, деякі засоби для виведення плям і склеювання, окремі види автокосметики – отруйні, з ними необхідно поводитися дуже обережно. Такі препарати обов’язково мають напис “Отрута” або “Отруйно”.
Багато засобів для виведення плям, полірування та склеювання, догляду за виробами зі шкіри, деякі рідкі засоби для чистки, боротьби з побутовими комахами, хімічні засоби захисту рослин і мінеральні добрива пожеженебезпечні. Пожеженебезпечні також препарати в аерозольних упаковках. Зберігати їх треба тільки далеко від джерел тепла.
Наприклад, пестициди – хімічні речовини для захисту сільськогосподарської продукції, для знищення паразитів у тварин, для боротьби з носіями небезпечних захворювань. За останні десятиріччя кількість різних видів пестицидів дуже виросла, тільки в США вона сягнула до 900. В колишньому СРСР в 1986 р. було використано пестицидів в середньому біля 2 кг на 1 га(приблизно на 87% пашні) або біля 1,4 кг на душу населення, а в США 1,6 кг на 1 га (на 61% пашні) або 1,5 кг на душу населення.
Пестициди розповсюджуються на великі відстані, дуже віддалені від місць їх використання. Більшість з них залишаються в ґрунті досить довго (період піврозпаду діелдрину перевищує 20 років). При використанні навіть менш летючих компонентів більше 50% активних речовин у момент дії переходять прямо в атмосферу, а для таких пестицидів, як діелдрин, характерна дистиляція з парами води на земній поверхні. Ця частина пестицидів, що не досягає рослин, підхоплюється повітрям і осідає в районах суші або океану, дуже віддалених від зони використання речовини, і в кінці кінців потрапляє в різні екосистеми, включаючи океан, прісноводні водойми, наземні біоми, в значній кількості накопичується в ґрунтах.
Пестициди є єдиним засмічувачем, який свідомо вноситься людиною в навколишнє середовище. Вони вражають різні компоненти природних екосистем: зменшують біологічну продуктивність фітоценозів, різноманітність видів тваринного світу, знижують чисельність корисних комах і птахів, і кінець кінцем є небезпечними для самої людини. Вони вирізняються не тільки високою токсичністю, а й великою біологічною активністю і здатністю накопичуватися в різних ланках харчового ланцюга. Навіть у мізерних кількостях пестициди пригнічують імунну систему організму, підвищуючи таким чином його чутливість до інфекційних захворювань. У більших концентраціях ці речовини здійснюють мутагенний і канцерогенний вплив на організм людини.
Тому зараз в багатьох країнах світу починають зменшувати кількість пестицидів або зовсім від них відмовляються.
Отже, люди повинні замислюватися над тим, які хімічні речовини доцільно використовувати в побуті, як ці речовини впливають на навколишній світ і до чого може призвести неконтрольоване їх використання.
Група Біотехнологи.
Біотехнологія охорони довкілля – відносно молода галузь, налічує трохи більше ста років. Але розвивається досить стрімко, коли люди зрозуміли, що сталий розвиток цивілізації, збереження біорізноманіття на планеті, здоровя, добробут та саме існування людини на землі залежить від чистоти навколишнього середовища. Тому впровадження нових форм охорони довкілля є невідкладною проблемою глобального масштабу. Біотехнологія охорони довкілля включає в себе очищення всіх головних трьох складових планети – грунтів, води, повітря – а також запобігання забруднення їх ксенобіотиками. Очищення повітря і грунтів біотехнологічними методами здійснюються за допомогою води. Тому нічого дивного, що найбільшого поширення біотехнологічні процеси набули в очищенні побутових і промислових стічних вод, у підготовці питної води і у відновленні якості відкритих басейнів ( озер, річок, бухт). В Україні започаткували використання спеціально селекціонованих мікроорганізмів – деструкторів органічних речовин, які забруднюють воду, в практиці очищення промислових стоків.
Урок№ 34
Тема: Контрольна робота за ІІ семестр
Мета:Визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Обладнання: Періодична система хімічних елементів Д.І. Менделєєва, таблиця розчинності, картки-завдання.
Тип уроку: Урок контролю знань.
ХІД УРОКУ
І. Організаційний момент
ІІ. Письмова контрольна робота
Варіант І.
І рівень
- Позначте процес, який лежить в основі виробництва маргарину:
А Гідроліз жиру;
Б Гідрування жиру;
В Гідратація жиру;
Г Дегідрування жиру.
- Укажіть фракцію нафти, в якої найвища температура кипіння:
А Газойль;
Б Лігроїн;
В Гас;
Г Бензин
- Позначте, за допомогою яких зв`язків утворюється вторинна структура білків:
А Металічних;
Б Водневих;
В Йонних;
Г Ковалентних.
- Позначте функцію білків, які належать до ферментів:
А Утворюють опорні м`язи та тканини організмів;
Б транспортують поживні речовини;
В каналізують хімічні реакції в організмі;
Г Захищають організм від хвороб.
- Укажіть характеристику процесу каталітичного крекінгу:
А Радикальне розщеплення карбонового ланцюга;
Б Радикальне розщеплення карбонового ланцюга, ізомеризація і циклізація;
В радикальне розщеплення карбонового ланцюга, ізомеризація, циклізація і дегідрогенізація;
Г Радикальне розщеплення карбонового ланцюга, ізомеризація, циклізація та гідратація.
- Укажіть правильне закінчення речення – «Залишки молекул амінокислот сполучені в молекулі білка…..»:
А Водневим зв`язком;
Б пептидними групами атомів;
В Йонним зв`язком;
Г Металічним зв`язком.
ІІ рівень.
- Скільки ізомерів може мати сполука складу С3Н9N?
а) 3; б) 4; в) 5; г) 6. Назвіть усі сполуки.
- Позначте правильне закінчення твердження – «Реакція омилення – це процес…»:
А взаємодії миючого засобу із жиром;
Б утворення мила з карбонових кислот;
В взаємодія жирів з розчинами лугів;
Г гідроліз жирів лугом.
- Знайдіть відповідність.
Назва реакції - Схема реакції
1) полімеризації а) (CuOH)2 CO3 = CO2 + …
2) окисно-відновна б) ... = CaCO3 + CO2 + H2O
3) розкладу в)CH2=CHСl+CH2=CHСl+…=
=[–(Сl)CH–CH(Сl)–]n
4) обміну г) Zn + HNO3 = 2 NO2 + …
Відповідь: 1)___; 2)___; 3)___; 4)___.
ІІІ рівень.
- Напишіть рівняння реакцій перетворень:
Крохмаль →глюкоза → етанол → карбон (ІV) оксид→
→ натрій гідрокарбонат.
- Складіть рівняння реакцій перетворень:
СН4 → С2Н2→ С6Н6 → С 6Н 5СІ→ С 7Н8. Назвіть усі сполуки.
ІV. Рівень
- До розчину масою 150г з масовою часткою сахарози 2% додали сахарозу масою 25г. Обчисліть масову частку розчиненої речовини в утвореному розчині.
Варіант ІІ
І рівень
1.Позначте неправильне твердження:
А Білки – це високомолекулярні пептиди;
Б Білки – це полімери зшитої будови;
В Білки – це ферменти;
Г білки – це поліпептиди, утворенні залишками молекул амінокислот.
- Укажіть речовину, яка використовується як відновник у доменній печі:
А СН4; Б СО; В Н2; Г NН3.
- Укажіть основний компонент природного газу:
А Азот; Б Метан; В Етан; Г Етен.
- Позначте правильне закінчення твердження – « До складу молекул рідких жирів входять залишки молекул…»:
А Насичених карбонових кислот; Б Альдегідів;
В Ненасичених карбонових кислот; Г Спиртів.
- Укажіть правильне закінчення речення – « Миюча дія мила зменшується у твердій воді, бо…»
А Йони натрію взаємодіють з аніонами мила;
Б йони гідрогену взаємодіють з аніонами мила;
В Йони кальцію взаємодіють з аніонами мила;
Г Йони амонію взаємодіють з аніонами мила.
- Позначте правильне закінчення твердження – « Гідрування ненасичених жирів використовується для….»:
А Одержання твердих жирів з рідких;
Б Одержання рідких жирів з твердих;
В Розчинення ненасичених жирів у воді;
Г Перегонки речовин.
ІІ рівень.
- Скільки структурних ізомерів може мати сполука С3Н 7NO2, що відноситься до класу амінокислот?
а) 2; б) 3; в) 4; г) 5.
- Укажіть правильне закінчення твердження – «гідроліз жирів у техніці використовують для одержання ….»:
А гліцерину;
Б етанолу;
В карбонових кислот;
Г естерів.
- Знайдіть відповідність.
Назва реакції - Схема реакції:
1) нітрування а) ... = Н+ + Н 2РО4
2) нейтралізації б) N2 + O2 = 2 NO
3) дисоціація в) С6Н6 + HNO3 = …
4) зворотна г) ... = Na2SO4 + H2O
Відповідь: 1)___; 2)___; 3)___; 4)___.
ІІІ рівень
- Напишіть рівняння реакцій, за допомогою яких можна
здійснити такі перетворення:
Метан → ацетилен → бензол → хлорбензол→ фенол.
- Складіть рівняння реакцій перетворень:
СаС2 → С2Н2 → С6Н6→ С6Н5NO2 → C6H7N Назвіть усі сполуки.
ІV рівень.
- Обчисліть об`єм газової суміші (н. у.), яка складається з хлор- етану масою 101г та хлору масою 35,5г.
ІІІ. Домашнє завдання
Виконати варіант сусіда
ІV. Підсумок уроку
Урок 35
Екскурсія «Газова промисловість, переробка газу, екологічні проблеми та альтернативи».
Мета: розширити і закріпити знання учнів про газопереробну промисловість, проблеми, що є на сучасному етапі, та можливі шляхи їх вирішення; розвивати екологічне мислення; виховувати бережне ставлення до довкілля.
Перебіг екскурсії.
Газова промисловість включає розвідку, видобуток, транспортування, зберігання і переробку природного газу, супутнього нафтового газу, який видобувається разом із нафтою (слайд 1,2, 3).
В Україні поступове зменшення видобутку газу почалося ще з 1976 р., що було зумовлено відсутністю великих родовищ (із запасами більше 30 млрд. м3). Така тенденція спостерігалася до 1998 р., коли видобуток природного газу склав лише 26,5% від рівня 1975 р.
Із 1999 по 2008 р. тенденція змінилася, і обсяги видобутку природного газу збільшилися на 16% порівняно з 1999 р. (див.слайд 4)
Починаючи з 1995 р. щоб залучити інвестиції в цю галузь, держава стала надавати приватним підприємствам ліцензії на розвідку і видобуток природного газу. Нині частка приватних підприємств у загальному видобутку складає близько 8% . Проте можна відзначити, що приватна форма власності в газовидобувній промисловості не вирішила проблеми дефіциту інвестицій. Зростання загального видобутку природного газу за рахунок приватних підприємств становило 41,4%, а за рахунок підприємств державної компанії – 58,6%. Видобувні підприємства державної компанії НАК "Нафтогаз України", як і раніше, мають домінуюче становище в цій сфері (приблизно 92%). Серед них – ДК "Укргазвидобуток", ДАТ "Чорноморнафтогаз" і ВАТ "Укрнафта".
За рахунок власного видобутку забезпечується лише 25% потреби національної економіки України у природному газі, решта – за рахунок імпорту.
Суттєвими конкурентними перевагами діючої газотранспортної системи (ГТС) є те, що вона має велику пропускну спроможність та здатна виконувати одночасно функції транзиту внутрішнього розподілу. Підземні сховища газу здатні згладжувати пікові та сезонні коливання в споживанні, посилюючи при цьому надійність як транзитних постачань, так і внутрішнього газопостачання споживачів України(слайд 5).
За період незалежності України довжина газотранспортної мережі була збільшена на 6,8 тис. км. Географічне розташування країни дозволяє успішно використовувати ГТС для транзиту природного газу навіть за умов незначного власного видобутку. Нині Україна здійснює транзит до 75% російського газу до Європи. Пропускна спроможність ГТС дозволяє збільшити ці обсяги (слайд 7).
Газова промисловість - це підприємства з видобутку, транспортування, зберігання та переробки природного газу(слайд 6). Ця галузь має велике народногосподарське значення. Природний газ використовується в промисловості як найбільш ефективне мінеральне паливо і як важлива хімічна сировина. Використання газу в комунальному господарстві має сезонний характер. Оскільки газ протягом року подається рівномірно, досить актуальним завданням є будівництво газосховищ.
Газ - дешевий вид палива. Він є цінною хімічмою сировиною. На відміну від інших видів палива, менше забруднює атмосферу. Промислові скупчення газу бувають трьох типів: поклади (вільний газ у порах гірських пород), газоконденсатні (газ, збагачений парою рідких вуглеводів) і попутний газ (розчинений у нафті). Нафту і природний газ використовують як високоефективне паливо і цінну сировину для хімічної промисловості. На нафту в структурі видобутку палива, у перерахунку на умовне паливо, припадає 7,2%, на природний газ -26,1%.
Українські геологи розвідують нові родовища нафти та газу. В Україні розвідано біля 300 родовищ, які є базою нафтогазової промисловості. Найбільш перспективним за видобутком нафти і газу вважається Дніпровсько-Донецький регіон, де зосереджено до 85% ресурсів країни. Відкриті газові родовища в Карпатському регіоні.
Нафту і природний газ в Україні видобувають у Предкарпатті, на Лівобережжі та в Причорноморському нафтогазоносному регіоні. Провідне місце належить Лівобережжю. Тут, у Чернігівській, Сумській та Полтавській областях є родовища високоякісної нафти. Вони мають значну кількість попутного природного газу, який використовується для газифікації навколишніх міст і сіл.
Найбільші родовища газу зосереджені в Харківській області, серед яких особливо відоме Шебелинське. Менше 1/5 частини видобутку природного газу України зосереджено в Прикарпатті, це Дашава і родовища Івано-Франківської області. Доволі значні родовища природного газу на півдні країни і передусім у Криму. В останні роки зростає видобуток газу з дна Чорного моря.
В Україні склалася густа мережа газопроводів, які ведуть від родовищ Харківської області, Передкарпаття і Криму до великих індустріальних центрів: Полтави, Києва, Кривого Рогу, Дніпрпетровська, Одеси, Харкова, Симферополя, Севастополя, Ялти тощо.
Найбільшими родовищами газу є Шебелинське, Західнохрестищенське та Єфремівське (сумарні запаси перевищують 970 млрд. куб. м). Понад 80% видобутих нафти та газу припадає на Дніпровсько-Донецьку нафтогазоносну область.
В Україні найперспективнішим регіоном для промислового видобутку газу (метану) є Донецький вугільний басейн. Ресурси метану в басейні, тільки у вугільних пластах до глибини 1800 метрів, складають 1,2 трлн. куб. м. Цей розмір дорівнює запасам найкрупніших газових родовищ світу і складає біля 206 млрд. куб.
Газова промисловість України одна з наймолодших галузей паливно-енергетичного комплексу. Вона довгий час розвивалася прискореними темпами. Особливо швидко вона розвивалася в післявоєнний період, коли республіка була найважливішим районом по видобутку газу в СРСР. Розвиток газової промисловості на Україні почався з промислової експлуатації Дашавського родовища в Львівській області. Природний газ цього родовища поступав не тільки у Львів та Київ, але й у Москву, Мінськ, Вільнюс та Ригу.
Нині основний видобуток природного газу в Прикарпатському нафтогазовому районі ведеться на Рудківському, Калушському, Опарському, Битківському родовищах. Але запаси на цих родовищах дуже вичерпані, а Дашавське родовище використовується як газосховище, туди природний газ закачується з газопроводу Уренгой-Помари-Ужгород.
До 1950 року Карпатський нафтогазовий район був основним у видобутку природного газу в Україні та СРСР. В 1960 році почала розвиток газова промисловість у Східних областях України.
З 1956 року розпочато експлуатацію Шебелинського родовища в Харківській області, запаси якого оцінювались в 500 млрд. куб. м і воно було одним з найбільших у Європі.
Сучасні запаси природного газу на Україні складають приблизно 800 млрд. куб. м, а видобуток знизився з 61 млрд. куб. м у 70-х роках до 20 млрд. куб. м. Біля 1/2 загальних потреб Україна одержує з Росії, а 25% - з Туркменії.
В умовах переходу до ринкової економіки та дефіциту капіталовкладень на Україні почали розвиватися міні-НПЗ (слайд 8). Такі НПЗ нині функціонують в багатьох державах світу. З 1996 року вони з’явились в Україні, хоча кількість міні-НПЗ країни поки що поступаються кількості великих у відношенні 2/6. Одною з переваг міні-НПЗ перед нафтопереробними гігантами є в тому, що їх можна розгорнути ближче до місця запасу сировини.
У Полтавській області працює такий міні-НПЗ. Місцеве підприємство працює на газовому конденсаті та виробляє достатньо якісні нафтопродукти. Технологічний вихід продуктів переробки такий: 60% від загальної кількості - бензини, 30% - дизельне паливо, 5-7% - мазут.
Потужність підприємства дозволяє переробляти 18 тис. тон газоконденсату на рік. Розрахункова вартість заводу складає 9 млн. гривень.
Але особливо загострилися проблеми, пов’язані з негативним впливом енергетики на стан навколишнього середовища. Масове використання викопного палива - нафти, газу завдає збитків природі і здоров’ю людини через викиди, що містять важкі метали та інші шкідливі речовини.
Рослини та океан вже не встигають поглинути всю кількість вуглекислоти, яка утворюється внаслідок спалювання органічного палива. Це веде до поступового збільшення її коцентрації в атмосфері, що посилює «парниковий ефект» і викликає потепління клімату. Якщо тенденція зростання споживання енергії та викідів двоокису вуглецю збережеться, то вже до 2025 року на землі потеплішає на 2 С, що призведе до глобальних катострофічних наслідків: зміщення кліматичних зон, знищення багатьох видів рослин, скорочення лісових площ, збільшення пустель, розтавання льодовиків тощо. Все це створить небезпеку голоду, хвороб, масових міграцій населення із зон екологічного лиха. Деякі небезпечні тенденції мають субглобальний масштаб: забруднення Світового океану нафтовою плівкою, скорочення озонового шару, який захищає життя на землі від жорстокого ультрафіолетового випромінювання Сонця, деградація лісів, головної «фабрики» кисню.
Наша країна одночасно є крупним покупцем природного газу, та його виробником, та великим транзитором. Найближчим часом в результаті економічної кризи споживання природного газу в Україні, мабуть, буде скорочуватись. Збільшення обсягів виробництва власного природного газу є для України приорітетним економіко-політичним завданням.
Характеризуючи сучасний стан газової промисловості за видами діяльності, можна відзначити таке.
На сучасному етапі розвитку господарських відносин Україна є енергодефіцитною державою, яка задовольняє свої потреби у енергоресурсах за рахунок власного видобутку лише на 45 %, зокрема, видобуває 10–12 % загального обсягу споживання нафти, 20–25 % – природного газу, 90–92 % – вугілля. Крім того, енергоємність ВВП України нині більше ніж удвічі перевищує аналогічний показник розвинених країн і продовжує зростати, а ефективність використання традиційних видів паливно-енергетичних ресурсів як у національній економіці в цілому, так і в аграрному секторі зокрема, є низькою. Актуальності набуває виробництво біогазу на основі біоенергетичної утилізації органічних відходів, отриманих у результаті господарської діяльності аграрних підприємств. Необхідність виробництва та використання біогазу зумовлюється високим рівнем енергоємності технологічних процесів у аграрній сфері, наявністю в Україні суттєвого потенціалу енергозбереження та ресурсів біомаси для отримання даного виду альтернативного палива, значною потенційною ємністю вітчизняного ринку біогазових установок. Доведено, що в сучасних умовах виробництво біогазу є ефективним у великих аграрних підприємствах, причому для його отримання найбільш доцільним є використання таких видів сировини, як гній ВРХ і свиней. З’ясовано, що виробництво біогазу в аграрних підприємствах України перебуває у стадії реалізації експериментальних зразків, пілотних проектів і потребує активізації та прискореного розвитку.
Одним із альтернативних джерел енергії є отримання біогазу в енергозберігаючих комплексах безвідходного виробництва біогазу та екологічно чистих добрив. Проблема переробки сміття є актуальною для багатьох країн, зокрема, і України. Ми познайомимося із досвідом переробки сміття у Швеції ( на прикладі м. Лінчопінг), а саме, виробництво на його основі біогазу (слайд 9). Звичайні органічні відходи тваринницьких комплексів та переробної промисловості є основним джерелом живлення мікрофлори, життєдіяльність якої забезпечує нормальне проходження біологічних процесів в ґрунті, сприяє збільшенню кількості гумусу.
Однак фізико-хімічні, біологічні властивості вказаних відходів не дозволяють використовувати їх безпосередньо як цінне органічне добриво. У не переробленому вигляді їх використовують тільки локально. Коєфіцієнт корисної дії таких добрив сладає близько 10-15%.
Біогаз – це газ, який виробляється (слайд 10) із органічних відходів (відходів їжі, тваринництва) з допомогою бактерій і має склад, подібний до природного газу: до 98% метану, а також сірководень, вуглекислий газ, воду і ін.
Виробництво біогазу починається із подрібнення сировини (слайд 11). Пізніше сировина транспортується у ємність, у якій вона нагрівається до 700С протягом 1 год. для знищення шкідливих мікроорганізмів. Потім вона переходить у ємність, куди додаються бактерії. Там сировина витримується при 380С протягом 30 днів. У цій ємності виробляється біогаз, який містить до 30% вуглекислого газу. Пізніше він очищається водою, і концентрація метану доводиться до 98%. Біогазом заправляють автомобілі і автобуси. У Лінчопінгу всі автобуси працюють на біогазі. У Швеції на бензин встановлений дуже високий податок, тому купувати біогаз значно дешевше, ніж бензин.
Відходи виробництва біогазу використовуються як органічне добриво.
Склад 1-ї лінії когенераційний комплексу безвідходного виробництва добрив замкнутого типу: (слайди 12,13,14,15,16,17).
- Система для загрузки сировини
- Система подрібнення сировини
- Ємності для підготування консистентної біомаси (мішалки).
- Біореактори попереднього зброджування та тарування біомаси.
- Біореактори мезофільного зброджування
- Біореактори термофільного зброджування
- Біореактори доброджування суміщені з субстрактором-теплообмінником
- Система опалення
- Блок систем силових енергоустановок
- Система автоматики та контролю
- Система газопроводів
- Система очистки біогазу від домішків.
- Система перекачування біогазу
- Газгольдери для біозазу та ємності для зберігання біогазу та метану.
- Метанова міні-заправочна станція для транспортного цеху.
- Тепло-електро біогазовий генератор.
- Ємності для зберігання рідкого біодобрива.
- Сепараційний вузол
- Дільниця обогачення рідких біодобрив
- Дозувально-фасувальний вузол біогумусу
- Дозувально-фасувальна лінія розливу рідких біодобрив.
Біогаз має ряд переваг перед природним газом, а саме:
- Біогаз виробляється із біологічної сировини, отже, його виробництво і спалювання є частиною природного циклу вуглецю, це не приводить до накопичення природного газу в атмосфері і тепличного ефекту. Природний газ добувається з глибини землі, він не є частиною атмосфери, отже, при його спалюванні відбувається накопичення вуглекислого газу.
- Біогаз – це відновлюване джерело енергії, тобто він ніколи не вичерпається. Природного газу і нафти при теперішніх темпах їх використання за прогнозами нам вистачить не більше, ніж на 50 років.
- Біогаз виробляється близько до споживача, сировина для його виробництва теж знаходиться недалеко від заводів. Немає необхідності транспортувати газ на великі відстані.
Як бачимо, досвід Швеції може бути корисним для України. Звісно, що для запровадження такої практики, зокрема створення сортувальних станцій та заводів з переробки і спалювання сміття необхідно докласти значних зусиль зі сторони влади, бізнесу та громадських організацій.
Підсумкова бесіда.
Україна – енергозалежна держава. Газова промисловість залежить від імпорту.
В Україні існує багато джерел енергії з біомаси. Паливом з біомаси є переважно відходи деревини лісової промисловості та сільськогосподарські відходи. Відходи деревини і побічних продуктів розпилювання деревини складаються з тирси, стружки, обаполів та кори. Лісосічні відходи – це крони дерев, гілки та мертві дерева, що залишаються після остаточного вирубу, а також лісосічні відходи та хмиз з молодих лісопосадок - після їх проріджування. Зазначені відходи розщеплюють або подрібнюють і доставляють на електростанції, де їх спалюють і виробляють тепло та енергію.
Сільськогосподарські відходи - це солома зернових культур, таких як пшениця, ячмінь та овес. З виробництва продукції з кукурудзи та соняшника як паливо можна використовувати стовбури та інші відходи. Солома і стовбури рубаються і використовуються як паливо подібно до деревинних відходів.
Гній також є продуктом, який можна використовувати у якості сировини для виробництва біогазу. Біогаз є газоподібним продуктом процесу анаеробного зброджування. В цьому процесі використовуються такі ресурси біомаси, як гній тварин, відходи харчової промисловості, осад стічних вод або сепаровані побутові відходи. В процесі анаеробного зброджування генерується багатий на метан біогаз та рідке добриво, яке має хороші живильні властивості.
Слайди



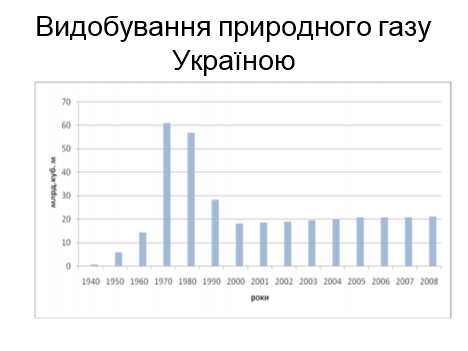


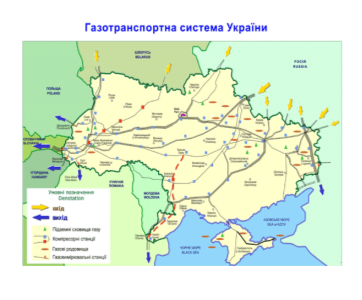
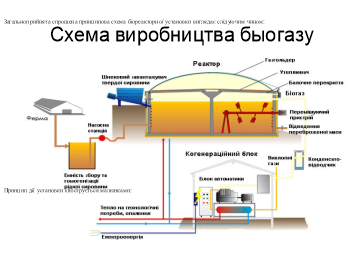






Література
1. Дубковецька Г.М., Міщук Т.І. Зошит з хімії для лаборатор-
них дослідів та практичних робіт 11 клас рівень стандарту.-
Тернопіль, Мандрівець 2011.
2. Г.А. Лашевська, А.А. Лашевська. Хімія: Підручник для 11 класу загальноосвіт. навч. закл. : рівень стандарту. – К.: Генеза, 2011. – 160с.
3. І. І. Черевань. Хімія. 11 клас: Зошит для лабораторних дослідів і практичних робіт (рівень стандарту). – Х.: Видавництво «Ранок», 2011. – 32 с.
4. Хімія: довідник для абітурієнтів та учнів загальноосвітніх навчальних закладів: навчально-методичний посібник (
М.В.Гриньов,Н.ІШиян,Ю.В.Самусенко[ та ін.].-К.:Літера ЛТД, 2012.-464 с.
5. Хомченко Г.П. Посібник з хімії для вступників до вищих навчальних закладів 2-ге вид.виправл.( Пер.з рос.-К.:Арій, 2010.-480 с.: іл.
1


про публікацію авторської розробки
Додати розробку